替代模板印迹-高效液相色谱测定空气PM2.5中的羰基化合物
2019-05-30方思炀陈诗丽何嘉铧沈丽思刘洋洋赖家平
方思炀, 陈诗丽, 何嘉铧, 王 浩, 沈丽思, 刘洋洋, 孙 慧,3*, 赖家平
(1. 广州大学环境科学与工程学院, 广东 广州 510006; 2. 华南师范大学化学与环境学院, 广东 广州 510006; 3. 广东省放射性核素污染控制以及资源化重点实验室, 广东 广州 510006)
大气中的羰基化合物(carbonyls, Cs)主要来自植物/人为排放、燃料的不完全燃烧以及挥发性有机物(VOCs)在大气中的二次反应。20世纪60年代,美国洛杉矶烟雾事件的发生,使得作为光化学烟雾重要组分的Cs物质得到了人们极大的关注[1-4]。近年来,我国汽车数量急剧增加,截至2017年,我国汽车保有量已达3.1亿辆,大量的Cs排放已经成为不容忽视的环境问题。Cs不仅是光化学烟雾的主要成分之一,更是自由基、臭氧(O3)、过氧羧酸硝酸酐(PAN)等的重要来源。大部分Cs具有毒性和刺激性,对眼睛、呼吸道黏膜等具有强烈的刺激作用[5]。目前国际上对于Cs的通用测定方法多为衍生法,利用2,4-二硝基苯肼(2,4-dinitrophenylhydrazine, 2,4-DNPH)与Cs中的羰基反应得到稳定的Cs-DNPH腙类化合物,再经过液-液萃取分离并浓缩后,用于高效液相色谱(HPLC)分析[6,7]。但是常用的液-液萃取方式需要加入大量有机溶剂,分析成本高,而且会造成二次污染。另外,在衍生过程中,为了得到较高的Cs衍生效率,往往需要加入过量衍生剂;而传统液-液萃取方式并不具备选择性,在处理过程中会将Cs-DNPH腙类物质与未反应的2,4-DNPH共同萃取到有机相中。未反应的2,4-DNPH不仅在浓缩阶段容易产生沉淀,使Cs-DNPH腙类物质被共沉淀出来,从而大大限制了浓缩效率,降低分析灵敏度;并且,在色谱分析过程中,当2,4-DNPH浓度很高时,其过大的峰面积易与相邻色谱峰重叠,影响Cs的准确测定。
本实验拟采用固相萃取(SPE)和分子印迹技术相结合的方式,替代传统的液液萃取方法,以清除样品中过量2,4-DNPH,提高测定灵敏度,实现大气中Cs的快速测定。SPE是一种方便快速的样品预处理方式,然而SPE柱常用的填料C18、C8、石墨化炭黑等尽管吸附性能良好,但对目标物质基本不具备选择性,不利于目标物质的分离提取。将SPE和分子印迹技术相结合可以较好地解决这个问题[8-10]。
分子印迹技术是根据目标分子的形状、尺寸以及官能团来定制特异性载体的技术。在模板分子存在的情况下,由功能单体和交联剂共聚反应可得分子印迹聚合物(molecularly imprinted polymers, MIPs)。在MIPs的制备中,模板分子的选择很重要。考虑到2,4-DNPH具有很高的反应活性,在自由基作用下,2,4-DNPH可能与反应中间体的羰基发生键合作用,从而被键合到聚合物的骨架上,难以洗脱下来,阻碍印迹位点的生成;并且,在MIPs的使用过程中,被键合到骨架上的2,4-DNPH会逐渐渗漏,影响实验结果。因此,本实验拟以2,4-DNPH的结构类似物2,4-二硝基苯胺(2,4-dinitroaniline, 2,4-DNAN)为替代模板分子来制备分子印迹固相萃取(molecularly imprinted solid phase extraction, MISPE)柱。本实验优化了MIPs制备方法、交联剂种类、洗脱剂种类等,并通过选择性实验探讨了MISPE的特异选择性。本技术成功地应用于广州市大学城校园空气质量的检测和分析。在大气羰基污染物的检测过程中,实现了2,4-DNPH背景干扰的消除,并能够大幅度浓缩样品溶液,提高羰基化合物Cs的富集效率和监测灵敏度。
1 实验部分
1.1 仪器、试剂与材料
1200型高效液相色谱(Agilent公司,美国); 754紫外可见分光光度计(上海菁华科技仪器有限公司); SK3200HP型超声波清洗器(上海科导超声仪器有限公司);隔膜真空泵(天津市腾达过滤器件厂); PM2.5切割器、KC-6120型大气综合采样器(青岛崂山电子仪器总厂有限公司); ZHWY-100B振荡器(广州科桥实验技术设备有限公司); DGG-9053AD型电热恒温鼓风干燥箱(上海森信实验仪器有限公司); HH-1数显恒温水浴锅(金坛市杰瑞尔电器有限公司); BS224S型电子天平(北京赛多利斯仪器系统有限公司); R-210/R215旋转蒸发仪(BUCHI实验室设备贸易(上海)有限公司); TDL-60C低速台式离心机(上海予腾生物科技有限公司); WP-UP-WF-30微量分析型超纯水机(四川沃特尔水处理设备有限公司)。
2,4-二硝基苯肼(BDH公司,英国); 2,4-二硝基苯胺(Aldrich公司,美国);甲基丙烯酸(methacrylic acid, MAA)、乙腈、偶氮二异丁腈(2,2′-azobis(2-methylpropionitrile), AIBN)(上海诺合化工科技有限公司);二乙烯基苯(divinylbenzene, DVB)、乙二醇二甲基丙烯酸酯(ethyleneglycol dimethacrylate, EDMA)(上海阿拉丁生化科技股份有限公司);色谱纯乙腈(天津致远化学试剂有限公司);无水乙醇、甲醇、磷酸、甲苯(天津市科密欧化学试剂有限公司);以上试剂除了特殊说明,其他均为分析纯。
以下试剂为实验室合成:甲醛-DNPH,乙醛-DNPH,丙酮-DNPH,丙烯醛-DNPH,丙醛-DNPH,甲基乙基酮-DNPH,丁烯醛-DNPH,丁醛-DNPH,异戊醛-DNPH,戊醛-DNPH,苯甲醛-DNPH,己醛-DNPH,邻甲基苯甲醛-DNPH,对甲基苯甲醛-DNPH, 2,5-二甲基苯甲醛-DNPH。
实验室用水均为超纯水。
1.2 SPE柱的制备及性能考察
1.2.1MIPs的制备
沉降聚合法:在50 mL圆底烧瓶中加入91.7 mg模板分子2,4-DNAN、171 mg功能单体MAA及30 mL乙腈,超声5 min使其充分混匀;加入1.43 mL交联剂EDMA(或DVB)和30 mg引发剂AIBN,适当摇匀后超声至充分混匀,再通入氮气10 min,以形成氮气充盈的稳定环境。通气完毕后立即密封圆底烧瓶,置于60 ℃油浴中共聚反应24 h,取出冷却至室温。将共聚得到的聚合物转入100 mL碘量瓶中,用洗脱液(醋酸-甲醇,2∶8, v/v)反复洗脱,直到上清液用紫外分光光度计测量时无2,4-DNAN检出,再用超纯水冲洗至上清液呈中性,接着用无水乙醇冲洗3~5次后置于60 ℃干燥箱中烘干即得印迹聚合物。
本体聚合法:首先取91.7 mg 2,4-DNAN和171 mg MAA溶解于12 mL乙腈中,超声15 min后于4 ℃的冰箱中暗置8 h,再加入1.43 mL EDMA (或DVB)和30 mg AIBN,超声15 min至分散均匀后连续通入氮气5 min,随后封闭容器,于60 ℃油浴中反应24 h。反应所得的聚合物整体材料通过粉碎、研磨,并用水进行湿筛,留下粒径为25~30 μm的颗粒物。用洗脱液(醋酸-甲醇,2∶8, v/v)洗脱至上清液用紫外分光光度计测量时无模板分子检出。再用无水乙醇将颗粒物洗涤至中性,离心分离去除上清液,于60 ℃干燥箱中烘干即得印迹聚合物。
共聚过程中不加入模板分子,分别采用沉降聚合法和本体聚合法合成了以DVB和EDMA为交联剂的非印迹聚合物(non-molecularly imprinted polymers, NIPs)。
1.2.2SPE柱的制备
取100 mg MIPs于烧杯中,加入5 mL无水乙醇,超声至分散均匀,转入已经加入筛板的固相萃取空柱中,让聚合物在重力作用下自然沉降,待沉降完全后加入第二块筛板,即得MISPE。NISPE的制作过程同上。
1.2.3萃取性能考察
装好的SPE柱在每次使用前均用5 mL甲醇进行活化,然后用3×1 mL装载液平衡柱子。考察SPE柱在水相和有机相中的萃取效率时,分别取各物质的水溶液(50 mg/L)或甲苯溶液(5 mg/L)过柱,控制流速,每加载4 mL,收集一次流出液。测定流出液吸光度,并对照原始溶液的吸光度值,计算其吸附效率。最后用2∶8(v/v)的醋酸-甲醇洗脱吸附的物质,使SPE柱再生。
SPE柱的吸附效率(E)通过紫外分光光度计测定滤液的吸光度变化来计算:E=(1-A1/A0)×100%,式中,A1为滤液的吸光度,A0为溶液原始吸光度。
1.3 HPLC检测条件
色谱柱:Agilent Extend-C18柱;流速:1.0 mL/min;柱温:20 ℃;进样量:10 μL;检测波长:360 nm;液相色谱梯度洗脱条件:流动相A为水,流动相B为乙腈。线性梯度洗脱:0~20 min,60%B~70%B; 20~23 min,70%B~100%B; 23~27 min,100%B; 27~28 min,100%B~60%B; 28~33 min,60%B。
1.4 样品采集及处理
采集大气样所用的滤膜用1 mg/L的2,4-DNPH乙腈溶液浸泡30 min后,于60 ℃烘箱中烘干30 min后密封,置于冰箱备用。组装KC-6120型大气综合采样器和PM2.5切割器进行大气采样。采样瞬时流量为100 L/min,连续采样2 h,本次实验分别在广州大学生活区和广州大学校门口的高速公路旁各选取3个不同位点,并分别于雾霾天气和非雾霾天气进行采样,一共采集12个样品,采样完成后将滤膜密封好带回实验室,密封于4 ℃冰箱中保存。
将负载PM2.5的滤膜置于结晶皿上,加入10 mL乙腈溶液超声15 min至颗粒物完全洗脱后,再加入15 μL衍生溶液(1 mg/L的2,4-DNPH溶液),以确保醛酮化合物完全衍生化,然后用2~3 mL乙腈溶液将滤膜冲洗干净后弃去。收集所有溶液,随后用0.22 μm的有机滤头过滤以除去杂质,再通过旋转蒸发仪将样品蒸干后用100 μL色谱纯乙腈重新溶解。然后加至MISPE柱,用3×1 mL甲苯溶液将Cs-DNPH从MISPE柱上淋洗出来。收集全部流出液于鸡心瓶中,经旋蒸氮吹后再重新用20 μL色谱纯乙腈溶解,用于HPLC分析。MISPE柱用2×1 mL洗脱液处理,将2,4-DNPH及空气样品中可能存在的其他杂质洗脱出来,使MISPE柱得到再生。
2 结果与讨论
2.1 分子印迹聚合物的制备
本实验采用两种方法合成2,4-DNAN的分子印迹聚合物:沉淀聚合法和本体聚合法。在聚合物合成过程中,聚合溶剂和交联剂的选择对聚合产物的理化性能影响较大。
溶剂的作用主要有两点:一是溶解模板分子、功能单体、交联剂和引发剂;二是作为致孔剂,令聚合物产生孔穴结构,有利于模板分子的洗脱与再结合。DVB和EDMA是制备分子印迹聚合物中常用的两种交联剂,在引发剂或者光照的作用下,可以产生自由基聚合,生成具有三维结构的高分子聚合物。从它们的分子结构可以看出,DVB含有苯环,制得的聚合物疏水性较强;用EDMA制备的聚合物则具有一定的亲水性。本实验拟通过考察具有不同极性及亲疏水性能的聚合物的吸附性能,来遴选出对2,4-DNPH具有最佳选择性和吸附能力的固相萃取材料。
因球形印迹聚合物粒径比较均匀,传质速度较快,故首先用沉淀法合成聚合物微球。考虑到模板分子的结构与性质,本实验考察了乙腈及氯仿作为聚合溶剂(30 mL)的效果。实验发现,当聚合溶液中含有氯仿时,得到的聚合物微球粒径始终很小,而且几乎不成球状,黏度较大。而采用纯乙腈做溶剂时,虽然可以获得球形聚合物微球,但使用EDMA作为交联剂时,所得聚合物粒径仅为1 μm左右;以DVB作交联剂时,粒径在2~5 μm之间。而且随着溶剂体积的增加,粒径逐渐减小。这样的微球作为固相萃取柱填料时,柱压很大,萃取速度很慢,不适合现场快速分析。因此,本实验减小致孔剂体积,改用本体聚合法,以乙腈为溶剂,分别选用EDMA和DVB为交联剂来合成MIPs。经过研磨筛分后得到粒径为25~30 μm的聚合物,制备出DVB-MISPE柱和EDMA-MISPE柱,并分别考察其萃取性能。另外不添加模板分子,用同样的方法制备出非印迹柱,即DVB-NISPE柱和EDMA-NISPE柱。
2.2 SPE柱对2,4-DNAN以及2,4-DNPH的萃取效率
分别取溶解在不同溶剂中的2,4-DNAN以及2,4-DNPH溶液,加载至SPE柱上,收集流出液,测定DVB-MISPE柱和EDMA-MISPE柱的萃取效率。由图1可以看出,无论装载水相溶液还是有机相(甲苯)溶液,EDMA-MISPE的萃取效率都明显高于DVB-MISPE的萃取效率。在水相中(见图1a), EDMA-MISPE对2,4-DNPH与2,4-DNAN都有很高的萃取效率,当样品装载量达到1 mg时,EDMA-MISPE对二者的萃取效率仍保持在96%以上。而DVB-MISPE对2,4-DNPH的萃取效率明显小于2,4-DNAN,而且随着样品装载量的增加,萃取效率下降较快。当2,4-DNPH装载量达到1 mg时,DVB-MISPE的萃取效率已经降低至20%左右。在有机相(甲苯)中(见图1b), DVB-MISPE对2,4-DNPH与2,4-DNAN的萃取能力更是远远低于EDMA-MISPE。当样品装载量为0.06 mg时,DVB-MISPE已经失去萃取功能;同样条件下EDMA-MISPE对2,4-DNPH的萃取效率仍在85%左右,而对于模板分子2,4-DNAN则有接近100%的萃取效率。在MIPs中,交联剂充当着聚合物分子链之间的“桥梁”,通过交联作用,分子互相连接形成具有一定机械稳定性的聚合物[11]。交联剂影响着聚合物的交联程度和刚性,而且交联剂的极性也决定了两种MIPs的吸附效果。从EDMA和DVB的分子结构(见图2)可以看出,DVB含有苯环,所以刚性较强;而EDMA具有链式结构,其柔软性更好,能够形成较为灵活的结合位点,提高分子识别效率,从而导致EDMA柱的萃取效率高于DVB柱。另一方面,与DVB-MISPE相比,EDMA-MISPE柱具有适中的亲水性和疏水性,无论在水相流动相,还是在有机流动相中,分析物都可以与EDMA-MISPE柱床填料充分接触并发生作用。综合上面两方面的原因,在两种介质中EDMA-MISPE都比DVB-MISPE萃取效率高。鉴于Cs-DNPH腙类物质的疏水性较强,在有机相中溶解度较大,所以在Cs物质测定中均以有机相作为溶剂。因为EDMA-MISPE在有机相中具有良好的吸附容量,在后续试验中我们选择EDMA-MISPE柱进行样品前处理。
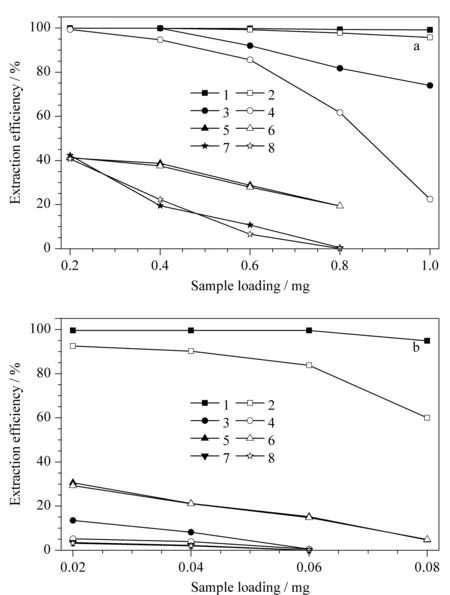
图 1 不同SPE柱在(a)水相以及(b)甲苯中对2,4-DNAN和2,4-DNPH的萃取效率Fig. 1 Extraction efficiencies of 2,4-DNAN and 2,4-DNPH on different SPE columns in (a) aqueous phase and (b) toluene 1. 2,4-DNAN on EDMA-MISPE; 2. 2,4-DNPH on EDMA-MISPE; 3. 2,4-DNAN on DVB-MISPE; 4. 2,4-DNPH on DVB-MISPE; 5. 2,4-DNAN on EDMA-NISPE; 6. 2,4-DNPH on EDMA-NISPE; 7. 2,4-DNPH on DVB-NISPE; 8. 2,4-DNAN on DVB-NISPE.

图 2 EDMA和DVB的分子结构式Fig. 2 Molecular structures of EDMA and DVB
此外,在相同条件下我们比较了印迹柱和非印迹柱的萃取效率。结果表明,印迹柱对2,4-DNAN以及2,4-DNPH的萃取效率远远大于非印迹柱。这是因为MIPs表面携带有大量为目标物质“量身定制”的吸附位点,其表面孔穴的数量以及其与目标物质的互补度都决定着萃取效率的高低[11,12]。MIPs在合成过程中添加了2,4-DNAN作为替代模板分子,2,4-DNAN与大量的功能单体MAA以非共价键的形式结合,在引发剂AIBN诱导下,交联剂和功能单体围绕2,4-DNAN发生共聚反应。由于模板分子本身具备一定的表面刚性,因此,聚合完毕并洗脱掉模板分子以后就在聚合物的表面形成了大量与模板分子相匹配的结合位点。而NIPs由于共聚过程中缺少模板分子的支撑作用而无法形成与2,4-DNAN相匹配的特异性识别位点,因此NIPs柱萃取效率较低。
2.3 选择性考察
取2,4-DNAN、2,4-DNPH、氨鲁米特、邻氨基苯甲酸甲酯、对羟基苯甲酸乙酯、对氨基苯甲酸甲酯及对氨基苯甲酸乙酯的水溶液(50 mg/L),分别加载至EDMA-MISPE柱,控制流速,每加载4 mL,收集一次流出液,测定其吸光度,并对照原始溶液的吸光度值,计算其萃取效率。比较EDMA-MISPE对2,4-DNPH及其6种结构类似物(结构式见图3)的萃取效率。结果表明,EDMA-MISPE柱对2,4-DNPH和2,4-DNAN的萃取效率远远高于其他分析物。当样品加载量为0.4 mg时,EDMA-MISPE柱对2,4-DNPH和2,4-DNAN的萃取效率仍接近100%,对氨鲁米特的萃取效率为13%,对其他分析物的萃取效率均小于5%(见图4)。需要说明的是:当样品加载量达到0.4 mg时,已经超过了SPE柱对于对氨基苯甲酸乙酯的萃取极限,溶剂流过时,反而将SPE柱上原来吸附的对氨基苯甲酸乙酯也冲洗下来,因此滤液中对氨基苯甲酸乙酯的吸光度增加,萃取效率计算为负值。EDMA-MISPE柱对2,4-DNPH和2,4-DNAN的萃取效率远高于其他几种物质,说明萃取效果与化合物的分子结构相关。所制备的MISPE柱对2,4-DNPH具有很好的选择性吸附性能,证明2,4-DNAN适合做2,4-DNPH的替代模板。
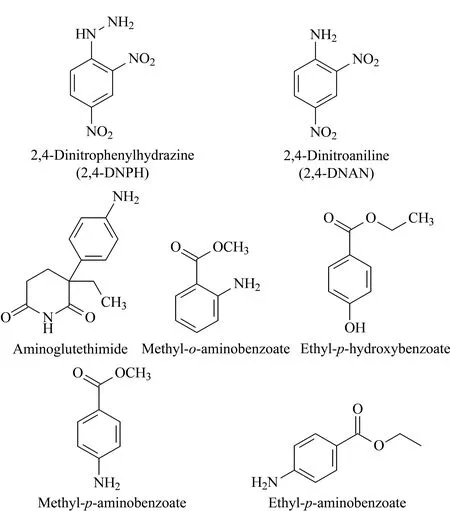
图 3 几种类似物的分子结构式Fig. 3 Molecular structures of several analogues
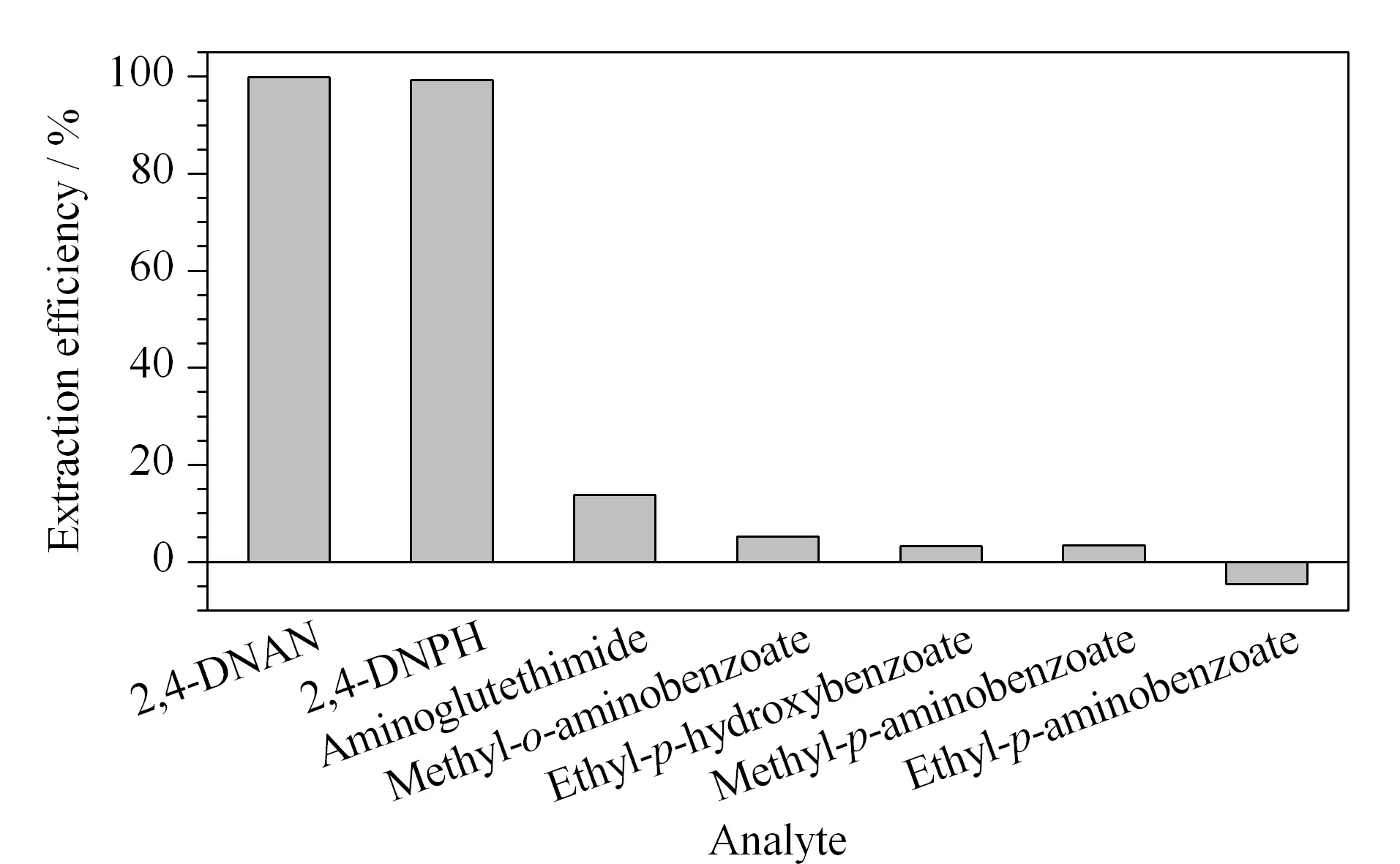
图 4 EDMA-MISPE柱对几种结构类似物的萃取效率Fig. 4 Extraction efficiencies of several structureanalogues on the EDMA-MISPE column

图 5 印迹柱、非印迹柱及C18柱的选择性对比Fig. 5 Comparison of selection of MISPE, NISPE,and C18-SPE
为了考察传统的C18-SPE柱以及非印迹柱(EDMA-NISPE柱)是否具有选择性,是否能够用于2,4-DNPH和Cs-DNPH的分离,分别将4 mL的2,4-DNAN, 2,4-DNPH以及Cs-DNPH腙类物质的甲苯溶液(5 mg/L)加载到印迹和非印迹柱以及传统的C18-SPE柱上,收集流出液,并测量其吸光度。结果(见图5)表明,非印迹柱和C18-SPE柱对2,4-DNPH、2,4-DNAN以及Cs-DNPH腙类物质的萃取效率都较低,而且不具备选择性,所以不能用于分离2,4-DNPH和Cs-DNPH腙类物质。而EDMA-MISPE柱对2,4-DNAN和2,4-DNPH都有很高的萃取效率,对Cs-DNPH腙类物质萃取效率较低。分析原因,MIPs对目标物质的识别作用取决于结合位点的形状以及与目标分子的结构互补性。2,4-DNPH与模板分子2,4-DNAN的结构高度相似,因此能够与结合位点进行特异性结合而留在MISPE柱上;而Cs-DNPH腙类物质和模板分子结构差别较大,而且分子中没有NH2基团,因此会随着溶剂流出。
为了进一步考察EDMA-MISPE柱的选择性,我们接着将14种Cs-DNPH腙类物质(0.1 mmol/L)和2,4-DNPH(50 mmol/L)的混合溶液100 μL加载到EDMA-MISPE柱上,用4 mL甲苯溶液淋洗,收集全部流出液,氮气吹干后再重新用100 μL色谱纯乙腈溶解,用于HPLC分析。经EDMA-SPE柱处理前后的HPLC色谱图如图6所示。经过EDMA-SPE柱萃取后,HPLC图谱中的2,4-DNPH峰面积明显缩小,而Cs-DNPH腙类物质的峰面积变化不大,峰形更好。这进一步证实了MISPE柱具有很好的选择性,能够将2,4-DNPH从混合样品中除去,起到净化Cs-DNPH腙类样品的作用。
2.4 MISPE固相萃取条件的优化
为了最大可能地分离2,4-DNPH与Cs-DNPH腙类物质,除去空气样品中的过量衍生剂2,4-DNPH,我们对固相萃取条件进行了优化。
将100 μL标准溶液(0.1 mmol/L Cs-DNPH腙类物质和50 mmol/L的2,4-DNPH混合溶液)加载至MISPE柱。首先分别用4 mL的甲苯、氯仿、二氯甲烷、甲醇、乙腈淋洗SPE柱,收集全部的淋洗液进行色谱分析,结果见表1。比较5种不同的淋洗液的淋洗效果,发现采用甲苯进行淋洗时,淋洗出来的2,4-DNPH非常少,而Cs-DNPH腙类物质则有97.0%±5.3%被淋洗出来,2,4-DNPH和Cs-DNPH腙类物质能够得到有效分离。然而随着淋洗液的极性增强(比如二氯甲烷、氯仿、甲醇和乙腈), 2,4-DNPH和Cs-DNPH腙类物质的分离效果逐渐下降。使用这些溶剂淋洗时,部分2,4-DNPH分子会随Cs-DNPH腙类物质一起被淋洗流出。

图 6 混合标准溶液用EDMA-MISPE柱处理前、后的HPLC色谱图Fig. 6 HPLC chromatograms of mixed standard solution before and after extraction by the EDMA-MISPE column 0. 2,4-DNPH; 1. formaldehyde-DNPH; 2. acetaldehyde-DNPH; 3. acetone-DNPH; 4. methyl ethyl ketone-DNPH; 5. crotonaldehyde-DNPH; 6. propionaldehyde-DNPH; 7. butyraldehyde-DNPH; 8. benzaldehyde-DNPH; 9. isovaleraldehyde-DNPH; 10. valeraldehyde-DNPH; 11.o-methylbenzaldehyde-DNPH; 12.p-methylbenzene formaldehyde-DNPH; 13. hexanal-DNPH; 14.2,5-dimethylbenzaldehyde-DNPH.

表 1 淋洗与洗脱过程中MISPE柱上2,4-DNPH与Cs-DNPH腙类物质的回收率
根据MIPs的分子识别原则,结合位点和目标物质间的结合主要依靠氢键和静电作用力,在惰性或者低极性溶剂中,MIPs与目标物质的特异性结合能力较强。采用甲苯作为淋洗液时,2,4-DNPH与MIPs间的特异性作用得以保持,2,4-DNPH被牢固地吸附在SPE柱上,其他的Cs-DNPH腙类物质则被甲苯溶液淋洗下来。随着淋洗液的极性增强,2,4-DNPH与MIPs间的氢键作用被破坏,部分2,4-DNPH分子会随Cs-DNPH腙类物质一起被淋洗流出。尤其是用乙腈进行淋洗时,乙腈溶液几乎将全部的2,4-DNPH和Cs-DNPH腙类物质从SPE柱上洗脱出来。
淋洗及洗脱条件对MISPE的吸附容量和选择性有很大影响,因此在后续实验中,我们采用甲苯作为淋洗剂,利用MIPs对2,4-DNPH的高度特异性识别能力将空气样品溶液中的2,4-DNPH选择性地吸附在SPE柱上,从而可以起到净化Cs-DNPH腙类样品的作用,而且避免了大量2,4-DNPH在后续浓缩过程中析出并夹带出醛酮分析物。因为乙腈对2,4-DNPH和Cs-DNPH腙类物质都有很强的洗脱能力,因此可在淋洗步骤之后,用作洗脱剂将残留的2,4-DNPH洗脱下来。在实际样品分析中,考虑到空气样品的复杂性,我们选用了洗脱能力更强的醋酸-甲醇(2∶8, v/v)溶液进行洗脱,以保证更彻底地除去SPE柱上吸附的各种物质,缩短SPE柱的再生时间。

图 7 样品经EDMA-MISPE柱萃取浓缩(a)前、(b)后的HPLC色谱图Fig. 7 HPLC chromatograms of sample (a) before and(b) after extraction by the EDMA-MISPE column0. 2,4-DNPH; 1. formaldehyde-DNPH; 2. acetaldehyde-DNPH; 3. acetone-DNPH; 4. methyl ethyl ketone-DNPH; 5. crotonaldehyde-DNPH; 6. propionaldehyde-DNPH; 7. butyraldehyde-DNPH; 8. benzaldehyde-DNPH; 9. isovaleraldehyde-DNPH; 10. valeraldehyde-DNPH; 11.o-methylbenzaldehyde-DNPH; 12.p-methylbenzene Formaldehyde-DNPH; 13. hexanal-DNPH; 14.2,5-dimethylbenzaldehyde-DNPH.

图 8 实际空气PM2.5样品中各类Cs物质的质量浓度Fig. 8 Mass concentrations of carbonyls in theair PM2.5 samples 1. formaldehyde-DNPH; 2. acetaldehyde-DNPH; 3. acetone-DNPH; 4. methylethyl ketone-DNPH; 5. crotonaldehyde-DNPH; 6. propionaldehyde-DNPH; 7. butyraldehyde-DNPH; 8. benzaldehyde-DNPH; 9. isovaleraldehyde-DNPH; 10. valeraldehyde-DNPH; 11.o-methylbenzaldehyde-DNPH; 12.p-methylbenzaldehyde-DNPH; 13. hexanal-DNPH; 14.2,5-dimethylbenzaldehyde-DNPH.
2.5 实际样品测定
本次实验分别在广州大学生活区和广州大学校门口的高速公路旁各选取3个不同位点,于雾霾天气和非雾霾天气,以2,4-DNPH为衍生剂按照1.4节进行采样和处理,一共得到12个样品。采集之后的样品通过EDMA-MISPE柱去除未反应的2,4-DNPH,并浓缩至20 μL,接着采用HPLC进样分析。结果如图7所示,样品经过EDMA-MISPE处理之后,大量背景干扰被除去。与未经过SPE柱处理的样品相比,尽管样品体积缩小为原来的1/5,但2,4-DNPH的峰高却比处理前降低很多;且浓缩后Cs-DNPH腙类物质的峰明显可见,分析灵敏度大大升高。无论是雾霾天气还是非雾霾天气,在校门口公路边和宿舍区均能检测到14种目标物。
比较宿舍区和校门口公路旁各种Cs含量(见图8),结果发现,由于大学城道路宽阔,行车较少,并且学校外围绿化带较多,因此,无论是雾霾天气还是非霾天气条件下,校门口公路处的醛酮物质总浓度均低于宿舍区处。非霾天气时,宿舍区的丙酮、苯甲醛、邻甲基苯甲醛及2,5-二甲基苯甲醛明显高于公路旁,推测为宿舍区学生活动较多,且靠近食堂和商业区,大量油烟废气排放到空气中,并逐渐累积所致。实验结果还表明,宿舍区下午Cs物质浓度略微高于上午,公路边则是上午略微高于下午。观察发现,宿舍区上午学生较少,人为活动少;中午以后食堂及各种商业活动开始排放油烟废气,因此宿舍区下午的Cs物质浓度较上午略有升高。而校门口的公路旁,来往车辆排放的尾气是空气中Cs物质的主要来源。因为大部分高校的课程主要安排在上午,导致上午出现短暂的上班高峰期,空气中的Cs物质浓度较高,而下午则错峰出行,所以上午时分空气中的Cs物质浓度会高于下午。
在雾霾天气条件下,总体上看,两个地点多数组分含量相差不大,但宿舍区的乙醛和丙醛浓度明显高于比公路边;而公路旁的苯甲醛、对甲基苯甲醛以及2,5-二甲基苯甲醛浓度则略高于宿舍区。由于宿舍区靠近食堂,乙醛和丙醛受食堂的燃料燃烧影响较大,而苯甲醛类则主要来自于汽车尾气的排放,而雾霾期间风力较小,不利于污染物扩散,从而导致各类污染物在其排放源附近大气中不同程度地累积。
甲醛与乙醛的浓度比值被广泛用来判断自然排放的VOCs对大气醛酮物质的贡献,比值越大证明Cs更多的来自于自然排放,一般在森林地区,其值可达10左右[13]。由图8数据可以计算得知,在大学城,无论是宿舍区还是马路边,其值均未超过3,证明空气中的醛酮物质主要来自人为排放VOCs在大气中的光氧化。
比较雾霾天气和非雾霾天气下,宿舍区与公路旁PM2.5样品中各种Cs物质的总量,从表2可以看出,PM2.5中Cs化合物的总质量浓度随着空气污染程度的加重而增加;但是在不同的天气状况下,大气PM2.5中各种羰基化合物的含量分布不同。灰霾天甲醛、乙醛、丙酮总的质量浓度与非灰霾天接近,占比却从非灰霾天的49.77%下降至27.19%,这是由于丙醛、戊醛、异戊醛和苯甲醛等羰基化合物在灰霾天浓度明显地快速增长。在灰霾天,丙醛、苯甲醛、异戊醛和戊醛是占比较大的羰基化合物,这与吕辉雄等[14]的观察相似。在本研究中发现非灰霾天时戊醛比异戊醛稍多,质量浓度分别为1.18 μg/m3及0.92 μg/m3,分别占比6.30%和4.92%;在灰霾天则发生逆转,异戊醛占比远超过戊醛。灰霾天异戊醛质量浓度明显升高,测得含量为7.47 μg/m3,占比达到21.20%,而戊醛质量浓度仅升到2.84μg/m3,占比为8.05%。这可能与戊醛和异戊醛在不同气相条件下的气固比有关。气固比越小,羰基化合物越趋向于分配到颗粒相中[15-17]。本实验测得戊醛在灰霾天和非灰霾天的气固比分别为0.43和0.07。比较两种天气时戊醛的气固比,灰霾天是非灰霾天的6倍。这说明,在非灰霾天气时,戊醛更趋于以固态形式存在;在灰霾天气时,戊醛更趋于以气态形式存在。而异戊醛在灰霾天和非灰霾天的气固比都接近零,分别为0.00及0.01,也就是说异戊醛绝大部分以颗粒态形式存在。灰霾天气风速较小,空气不易扩散;而且广州湿度较大,在二次有机气溶胶的环境下,随着吸湿颗粒的增长,异戊醛的质量浓度随着PM2.5的积聚也快速增长。所以,与戊醛相比,在灰霾天采集到的PM2.5颗粒中,异戊醛的浓度增长较快,在Cs总量中占比增大。
另外实验发现,丙醛和异戊醛的浓度具有较好的相关性,说明异戊醛和丙醛具有共同的来源。丙醛普遍被认为仅来源于人类活动,所以异戊醛的激增,有可能也是人为排放的污染源造成的。因为异戊醛在雾霾天气时,含量急剧增高,所以可用作衡量雾霾空气质量的标志物。
由表2可以看出,本实验对于14种常见醛酮物质的检出限是0.017~ 0.17 ng/m3。根据加州空气资源委员会(California Air Resources Board, CARB)发布的慢性病参考暴露极限(Chronic Reference Exposure Limit, REL)标准,Cs不应超过3 μg/m3;另外,世界卫生组织(World Health Organization, WHO)规定,平均30 min内,室内甲醛含量不超过100 μg/m3[18,19]。由于本方法的检出限远低于这些指导值,因此该方法足够灵敏。

表 2 PM2.5中羰基化合物的浓度及百分比
3 结论与展望
本实验以2,4-DNAN为替代模板、MAA为功能单体合成了对2,4-DNPH具有特异性识别能力的MISPE柱。分别探究了两种不同交联剂(EDMA和DVB)以及不同萃取相对MIPs萃取效果的影响。经过吸附试验证实,以EDMA为交联剂,能够显著提高MIPs的印迹效率,EDMA-MISPE的选择性以及萃取容量均优于DVB-MISPE。本研究解决了传统SPE材料选择性低,不能去除2,4-DNPH背景干扰的瓶颈问题。更重要的是,除去了2,4-DNPH的样品可以充分浓缩,从而大大提高了测量灵敏度。本实验合成的MIPs有望应用于各种空气样品中醛酮检测的样品前处理过程,满足环境样品中痕量Cs的检测要求。