大鼠颈动脉球囊损伤后单核细胞趋化蛋白-1诱导蛋白的表达变化
2019-05-30蹇明辉陈文明李朝富
蹇明辉,陈文明,李朝富
(遵义医科大学附属医院 心血管内科,贵州 遵义 563099)
目前,经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是治疗冠状动脉粥样硬化性心脏病(冠心病)最为有效的手段之一,但是,PCI术后血管再度狭窄(Restenosis,RS)的发生率仍然高达17%~32%[1-2]。在PCI术后血管再狭窄发生、发展的过程中,血管平滑肌细胞(Vasclar smooth muscle cell,VSMC)的过度增殖和迁移起着非常重要的作用[3],如果能有效抑制VSMC过度的增殖和迁移,那么,PCI术后再狭窄的发生就有能得到有效的控制。单核细胞趋化蛋白-1诱导蛋白(Monocyte chemotactic protein-1 induced protein,MCPIP) 是一个具有转录活性,或有RNase活性的锌指蛋白,参与细胞内的多种病理过程,研究表明MCPIP是与心血管疾病、炎症、自身免疫等相关的一种多功能蛋白[4-6]。研究还证实,在动脉粥样硬化模型鼠主动脉中,发现MCPIP mRNA 表达量比野生型鼠增加了2.5倍;在人的动脉粥样硬化斑块组织中发现 MCPIP 表达较正常血管组织明显增加[7]。在PCI术后再狭窄进程中,MCPIP 是否参与其中,作者未见文献报道。因此,本研究通过建立球囊损伤动脉模型,模拟PCI术后再狭窄的过程,探讨血管损伤后MCPIP 的表达变化与血管新生内膜形成的关系。
1 材料与方法
1.1 主要试剂和仪器 MCPIP和β-actin一抗(北京博奥森生物技术有限公司);RNA逆转录试剂盒和Real-Time PCR反应试剂盒(宝生物工程(大连)有限公司);2.0 mm×12.0 mm球囊导管(美国Baxter Healthcare公司);BX43显微镜(日本Olympus公司);凝胶成像系统(美国BIO-RAD公司);MCPIP和β-actin引物(广州锐博生物科技有限公司)。
表1引物序列和扩增产物长度

引物名称引物序列基因扩增片段长度MCPIP上游 TCGGCCAGATGTG CCTATCA191 bp下游 CTTGGAGGTCCCGGTATG TG TCβ-actin上游 CCACGAACTACCTTCAACTCC132bp下游 GTGATCTCCTTCTGCATCCTGT
1.2 实验动物及分组 SPF级健康雄性SD大鼠50只(由重庆腾鑫生物技术有限公司提供),体重 300±20 g,随机为成 5 组:假手术组,损伤后3、7、14、28 d组,每组10只。
1.3 大鼠颈动脉球囊损伤模型建立 参照文献建立颈动脉球囊损伤模型[8-9],大鼠经腹腔注射水合氯醛(10%,3 mL/kg)麻醉后再注射肝素钠(625 U/kg)。固定大鼠,于颈部正中切口,分离左侧颈总动脉、颈外和颈内动脉,结扎颈外动脉远端,用0号丝线临时阻断左颈总动脉血流。球囊导管(2.0 mm×12.0 mm)由颈外动脉进入颈总动脉,将球囊充盈。把充盈的球囊在颈总动脉内缓慢来回反复抽拉3次,退出球囊,结扎颈外动脉。假手术组大鼠只分离左颈总动脉血管。术后给予青霉素(30万单位)肌肉注射,连续3d,每天1次。分别于3、7、14、28 d处死大鼠,留取颈动脉血管组织。
1.4 颈动脉血管组织HE染色 损伤的颈动脉血管经石蜡包埋、切片行HE染色,显微镜下观察结果并拍照,用(Image-pro Plus)IPP图像分析软件测量血管腔面积 (LA)、内弹力板围绕面积(IELA)、外弹力板围绕面积(EELA),计算内膜面积 (IA)和中膜面积(MA),其中 IA=IELA-LA,MA=EELA-IELA,每个样本切片 5张,分别测量后取平均值,并计算 IA/MA。
1.5 Western blot法检测MCPIP的蛋白表达 将损伤的颈动脉血管组织用蛋白提取液提取蛋白,然后进行蛋白定量,并确定蛋白的上样浓度(60 μg)。制胶上样,恒压电泳和转膜(湿转),将膜用脱脂奶粉封闭 2 h,加入一抗(MCPIP 1∶200、β-actin 1∶200),于冰箱4℃过夜,加二抗孵育1 h,于BIO-RAD凝胶成像仪显影,对电泳条进行分析,计算目的蛋白相对表达量。
1.6 Real-time PCR法检测MCPIP的mRNA表达 颈动脉损伤血管组织按照RNA提取操作步骤提取RNA,将RNA进行逆转录反应后,首先确认引物的反应性,确定反应体系(25 μL),按照PCR反应扩增步骤进行:① 预变性:95 ℃、5 min;②PCR反应42个循环:95 ℃,15 s ,60 ℃,40 s;③融解曲线:95 ℃,5 s,60 ℃,5 min。目的基因的相对表达量=目的基因表达/内参β-actin基因表达。
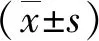
2 结果
2.1 大鼠颈动脉球囊损伤后内膜形态学变化 HE染色结果发现,假手术组血管内膜光滑,无明显增厚现象,颈动脉球囊损伤后 3 d,血管内膜无明显增生,7 d 时,可见新生内膜,增生的平滑肌细胞向内膜下迁移,管腔开始狭窄,各损伤组内膜/中膜面积比值明显增大(P<0.01);14 d 时,可见明显新生内膜,平滑肌细胞排列紊乱,管腔明显狭窄,内膜面积超过中膜(P<0.01);28 d 时,血管内膜继续不规则增生,血管腔狭窄程度继续加重,管腔面积狭窄程度更加明显(P<0.01,见图1、表1)。

A:假手术组;B:损伤7 d组;C:损伤14 d组;D:损伤28 d组;I:内膜;M:中膜。 图1 HE染色观察大鼠颈动脉球囊损伤后内膜形态学的变化(×400)
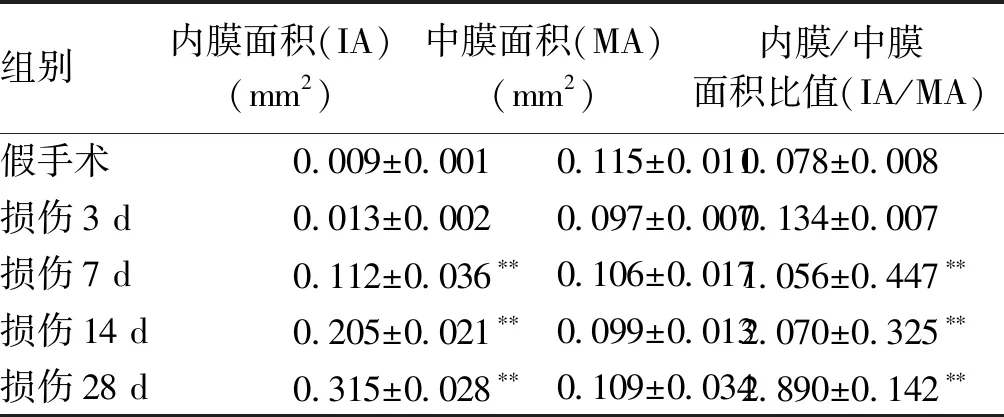
组别内膜面积(IA)(mm2)中膜面积(MA)(mm2)内膜/中膜面积比值(IA/MA)假手术 0.009±0.0010.115±0.0110.078±0.008损伤3 d 0.013±0.0020.097±0.0070.134±0.007损伤7 d 0.112±0.036∗∗0.106±0.0171.056±0.447∗∗损伤14 d 0.205±0.021∗∗0.099±0.0132.070±0.325∗∗损伤28 d 0.315±0.028∗∗0.109±0.0342.890±0.142∗∗
**:与假手术组比较,P<0.05。
2.2 大鼠颈动脉球囊损伤后血管MCPIP mRNA表达变化 Real-Time PCR结果显示,与假手术组相比,大鼠颈动脉球囊损伤3 d 后,损伤血管壁MCPIP mRNA表达开始增加,但是无统计学意义,随损伤时间的延长,MCPIP mRNA表达量也呈上升趋势,至损伤后28 d,MCPIP mRNA 达到最高值(P<0.01,见图2)。

**:与假手术组比较,P<0.05;1:假手术组;2:损伤3 d;3:损伤7 d;4:损伤14 d;5:损伤28 d。图2 损伤血管 MCPIP mRNA的表达变化
2.3 大鼠颈动脉球囊损伤血管MCPIP蛋白的表达变化 Western blot结果显示,与假手术组相比,大鼠颈动脉球囊损伤3d后,血管壁损伤MCPIP 蛋白表达无明显变化,损伤7 d 后,损伤血管壁MCPIP蛋白表达水平开始增加(P<0.01),且随损伤时间的延长,MCPIP 蛋白表达水平也呈上升趋势,至损伤后28 d,MCPIP蛋白表达达到最高值(P<0.01,见图3)。
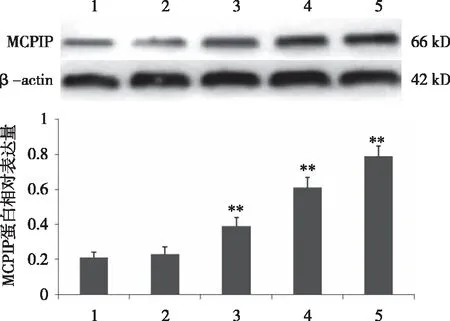
**:与假手术组比较,P<0.05;1:假手术组;2:损伤3 d;3:损伤7 d;4:损伤14 d;5:损伤28 d。图3 损伤血管MCPIP的蛋白表达
3 讨论
PCI术后血管再狭窄的发生是局部血管损伤后的一种修复反应过程,其作用机制主要包括血管弹性回缩、血管重塑、血栓形成、血小板沉积、以及VSMC过度增殖及迁移等,其中VSMC增殖和迁移能力的增强是再狭窄的主要机制[10]。因此,VSMC的增殖与迁移在PCI术后再狭窄中占主导地位。本实验通过建立球囊损伤大鼠颈总动脉内膜模型,复制PCI术后再狭窄的过程,观察大鼠颈总动脉内膜的损伤情况。病理学研究结果表明,球囊损伤血管后,增生的VSMC向内膜下迁移,导致内膜不断增生,且随损伤时间的延长,内膜增生的程度不断增加。这与文献报道一致[11]。
本研究通过Real Time-PCR 和Western blot结果表明,大鼠颈动脉球囊损伤后,随损伤时间的延长,MCPIP表达水平也不断增加。高表达的MCPIP对血管内膜增生引起再狭窄的发生和发展具体发挥一种什么作用目前尚不清楚。MCPIP是一种具有转录活性的与心血管疾病、自身免疫以及炎症相关的多功能蛋白。罗洁等[12]研究在动脉粥样化模型中,大鼠主动脉中MCPIP的表达明显高于正常大鼠;研究还发现,MCPIP作为一个转录因子,可通过调控细胞核内c-fos 基因表达,促进VSMC的增殖[13]。因此,在血管内膜增生引起再狭窄的进程中表达逐渐增加的 MCPIP 有可能通过发挥上述功能促进血管再狭窄发生、发展。对此问题的深入探索将有助于认识PCI术后血管再狭窄的发生机制及治疗控制靶点,也是我们的后续研究工作。
