何首乌对衰老小鼠脑组织凋亡相关基因表达的影响
2019-05-30杨江权邹佳益李文谦何芋岐葛正龙
杨江权,邹佳益,徐 林,李文谦,范 芳,何芋岐,葛正龙
(1.遵义医科大学 基础医学院生物化学与分子生物学教研室,贵州 遵义 563099;2.遵义医科大学 药学院药学实验室,贵州 遵义 563099)
衰老常表现为机体多组织器官退化,功能异常等变化,并且与认知功能、氧化应激、自由基、炎症等息息相关[1-3]。研究表明,增龄会导致机体组织细胞过量凋亡,加速机体衰老;但抑制细胞凋亡能够明显延缓衰老的发生[4]。因此,研究衰老中相关的凋亡基因能够帮助人们深入的了解衰老以及为延缓衰老提供新的策略和思路。
何首乌(PolygonumMultiflorumThunb,PMT)为蓼科植物,主要用于抗衰老及神经保护、降血脂和抗动脉粥样硬化等[5-6]。在相关的研究中指出,何首乌可以通过清除机体自由基和抗氧化作用来延缓衰老相关性疾病的发生[7-8]。近年来,一些研究也表明何首乌能调控某些凋亡基因的表达,如上调抑制凋亡基因Bcl2的表达,下调促凋亡基因Bax的表达,进而免于细胞凋亡的发生等[9],但何首乌对衰老小鼠凋亡基因组表达的影响尚未见报道。因此本研究将通过转录组测序技术探讨何首乌在衰老过程中对凋亡基因组表达的影响,进一步了解何首乌延缓衰老的机制。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂与仪器 何首乌(遵义医科大学附属医院中药房,经遵义医科大学匡菊香副教授鉴定为蓼科植物何首乌的块根),丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)测试盒(南京建成生物工程研究所),D-半乳糖(Sigma,美国),冷冻离心机(MICRO173,美国),RNAiso Plus(Takara,日本),微量核酸蛋白分析仪(Eppendorf,德国),梯度PCR仪(Flex cycler,美国),实时荧光定量PCR仪(EFX96,美国),PrimeScriptTMRT试剂盒(Takara,日本),TB GreenTMPremix Ex TaqTMⅡ试剂盒(Takara,日本)。
1.1.2 实验动物及分组 60只C57BL/6雄性小鼠,20±2 g,购自辽宁长生生物技术公司[生产许可证号:SCXK-(辽)2015-0001]。饲养于普通环境,每笼5只,自由饮食,光12 h交替照明。适应性喂养1周,随机分为对照组(C)和衰老组(MC),MC腹腔注射D-半乳糖(800 mg/kg)建立衰老模型,C腹腔注射等量生理盐水,每天1次,连续45 d,实验末摘除眼球取血检测血清SOD和GSH-PX的酶活性以及MDA的含量来判断衰老小鼠建立成功与否。随后把建立成功的衰老小鼠随机分为何首乌提取液作用高剂量组(MH)和何首乌提取液作用低剂量组(ML),然后留下10只衰老小鼠作衰老对照,每组10只。MH灌胃何首乌提取液1 g/(mL·kg-1),ML灌胃何首乌提取液0.3 g/(mL·kg-1),MC灌胃等量生理盐水,每天1次,连续45 d。实验末腹腔注射4%的水合氯醛,待小鼠麻醉后,摘除眼球取血,4℃过夜,3 500 r/min离心取血清待用;然后断头处死小鼠,取脑组织-80 ℃保存待用。
1.1.3 何首乌提取液的制备 何首乌块根,经仪器打磨成粉末状,过四号筛,称取100 g,然后加入6倍体积75%的乙醇煎煮回流2次,每次1h,通过离心10 min获取上清液,合两次的上清液于旋转蒸发仪真空浓缩致无乙醇味,使最终的药物浓度相当于生药计1 g/mL,-20 ℃冰箱保存待用。
1.1.4 实验方法 每组取血清检测SOD和GSH-PX的酶活性和MDA含量,初步判断衰老模型的建立和何首乌延缓衰老的药效。采取衰老组(MC)和何首乌提取液作用高剂量组(MH)小鼠,每组3只,提取脑组织总的RNA,操作方法严格按照说明书操作,提取的RNA采用微量核酸蛋白测定仪检测OD260/OD280,检测结果在1.8~2.0之间表示提取的RNA的质量好。-80 ℃保存待用。转录组测序:BGISEQ-500测序平台由华大基因完成。
1.2 Q-PCR 选取Cdh1、Ido1、Pou4f1、Foxb1、Lhx3凋亡基因进行PCR验证,引物见表1。用PrimeScriptTMRT reagent Kit将RNA逆转录为cDNA,通过TB GreenTMPremix Ex TaqTMⅡ进行扩增,反应体系为10 μL。以β- actin为内参,通过2-ΔΔCT法计算基因的相对表达水平。
表1差异表达基因Q-PCR引物序列

GeneForward primer (5’ - 3’)Reverse primer (5’ - 3’)β- actinGTGCTATGTTGCTCTAGACTTCGATGCCACAGGATTCCATACCCdh1CAAGGACAGCCTTCTTTTCGTGGACTTCAGCGTCACTTTGIdo1CAGTGCAGTAGAGCGTCAAGACCGCAGACCTTCTGGCAGCTTGGPou4f1TTGAAGGTCAGGGATTCAGGGACAAGTTGTTGGGGCAGATFoxb1CACCACCCCTCTCAACACTTGGGACCGAAGACAACTTTCALhx3ATGGGGCTTGGTAGGAGACTTTTAGAGGCTACGCCTTAGA
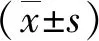
2 结果
2.1 D-半乳糖建立衰老小鼠血清中酶活性影响 通过腹腔注射D-半乳糖建立衰老小鼠模型,从表2结果中看出,MC中的SOD和GSH-PX的活性明显比C中低(P<0.05),MDA明显增加(P<0.05)。因此初步判断衰老小鼠建立成功(见表2)。
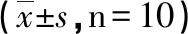

组别SOD(U/mL)MDA(nmol/mL)GSH-Px(U/mL)C103.33±14.298.96±2.25112.8±37.66MC 70.98±8.71∗15.81±2.65∗74.79±29.04∗
*:与对照组比较,P<0.05。
2.2 何首乌对衰老小鼠血清中MDA含量、SOD和GSH-PX酶活性影响 相对于C,MC中的SOD和GSH-PX的酶活性明显降低(P<0.05),MC中的MDA含量明显增加(P<0.05);相对于衰老组,何首乌提取液作用组中的SOD和GSH-PX的酶活性明显提高(P<0.05),何首乌提取液作用组的MDA含量明显降低(P<0.05)。这些结果表明,D-半乳糖能加速小鼠老化,降低小鼠体内的酶活性,而何首乌能有效的提高这些酶活性。因此,初步看出何首乌具有延缓衰老的药效(见表3)。
2.3 凋亡基因的聚类分析 采用R语言中mixOmics和gplots软件包分别作热图和PCA分析744个凋亡基因的聚类情况,见图1(热图)和见图2(PCA)。热图(见图1)中每一个方块代表一个基因表达量值,红色表示上调的基因,绿色表示下调的基因,黑色代表无变化基因;从图中可以直观的看出MH和MC能较好的区分开来,并且可看出MC中下调的基因在何首乌给药后出现了上调,反之亦如此。PCA(见图2)结果显示,MC和MH两组之间也能够较好的区分开,并且MC主要分布在PC1的负轴、PC2的正轴,在给药何首乌后,上述分布开始向PC1的正轴移动,并分布于PC2的两极。通过聚类分析后发现何首乌在衰老的过程中对凋亡基因起着调节作用,提示可能是其延缓衰老的作用之一。
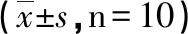
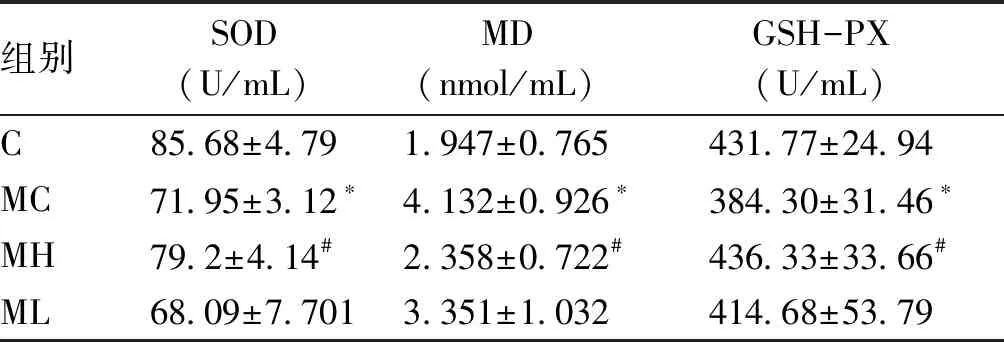
组别SOD(U/mL)MD(nmol/mL)GSH-PX(U/mL)C85.68±4.791.947±0.765431.77±24.94MC71.95±3.12∗4.132±0.926∗384.30±31.46∗MH79.2±4.14#2.358±0.722#436.33±33.66#ML68.09±7.7013.351±1.032414.68±53.79
*:与对照组比较,P<0.05;#:与衰老组比较,P<0.05。
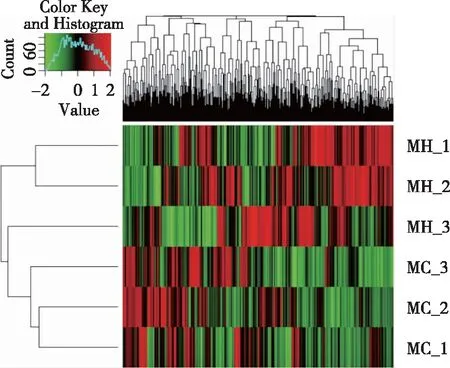
红色代表上调基因,绿色代表下调基因,黑色代表无变化基因。图1 744个凋亡基因聚类分析热图

图2 744个凋亡基因聚类分析得分图
2.4 凋亡基因的差异表达分析 选取的凋亡基因采用作火山图分析,发现了121个基因具有差异表达,其中上调基因78个,下调基因43个。统计分析 Log2(Fold change)≥1或≤-1和P≤0.05后发现上调基因11个,下调基因1个,差异基因的详细分布情况见火山图(Volcano-plot),图3。表4列出12个差异基因的主要功能作用。
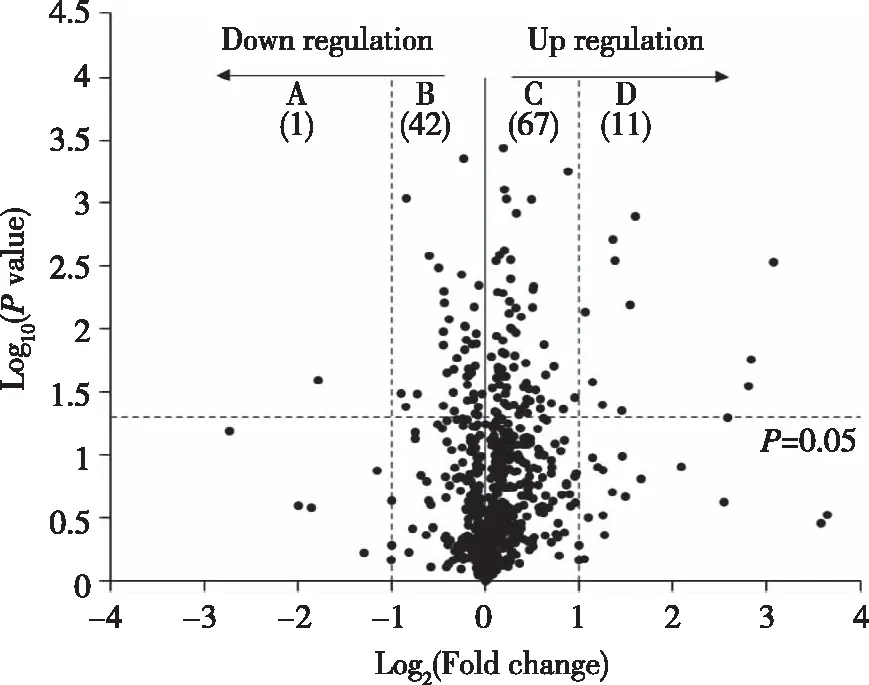
横坐标代表基因在不同样本中表达倍数变化;纵坐标代表基因表达量变化差异的统计学显著性。图3 差异基因火山图
表412个差异基因的主要功能列表
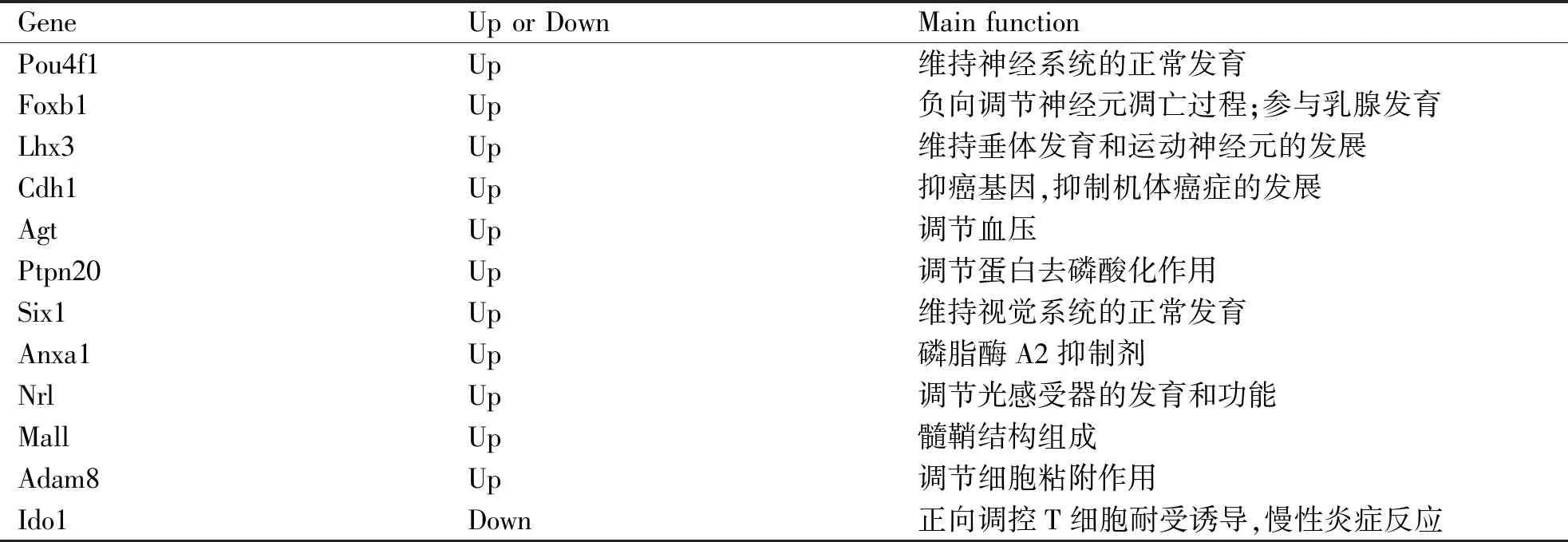
GeneUp or DownMain functionPou4f1Up维持神经系统的正常发育Foxb1Up负向调节神经元凋亡过程;参与乳腺发育Lhx3Up维持垂体发育和运动神经元的发展Cdh1Up抑癌基因,抑制机体癌症的发展AgtUp调节血压Ptpn20Up调节蛋白去磷酸化作用Six1Up维持视觉系统的正常发育Anxa1Up磷脂酶A2抑制剂NrlUp调节光感受器的发育和功能MallUp髓鞘结构组成Adam8Up调节细胞粘附作用Ido1Down正向调控T细胞耐受诱导,慢性炎症反应
2.5 凋亡基因的Q-PCR验证 对Cdh1、Ido1、Pou4f1、Foxb1、Lhx3等5个差异基因进行Q - PCR验证。结果显示,差异基因的相对表达量趋势与RNA - seq检测结果趋势一致(见图4)。
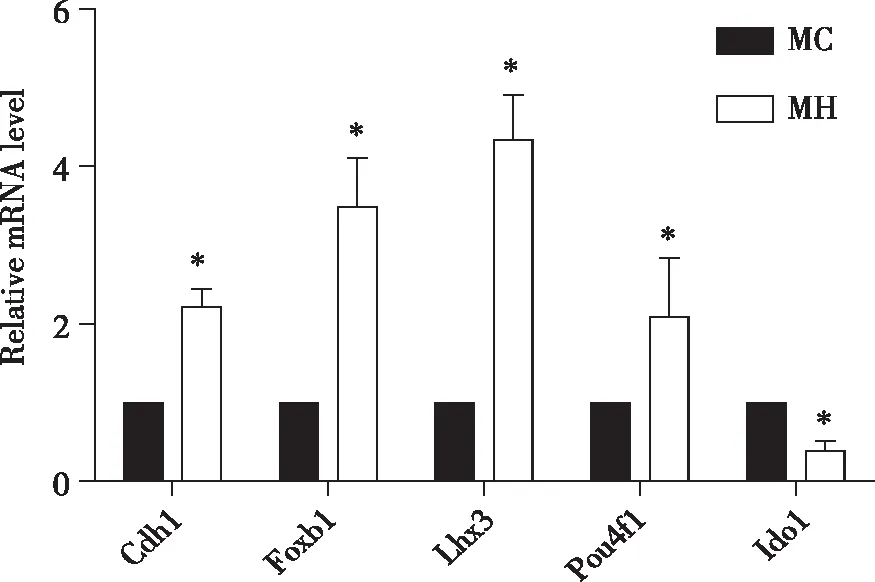
*:P<0.05。图4 5个差异基因的Q-PCR结果
3 讨论
转录组学技术在短短的几年发展时间里,已经应用于各个方面。中医药治疗疾病在我国非常流行,通常情况是多味药相互作用,相互协调,对应于多个靶点发挥药理药效。由于中医药的化学成分复杂,目前只能从机体的整体层面观察病症,而以往的技术也并不能了解中医药的作用机制,因此制约了人们进一步探讨中医药的步伐。转录组学技术是一种能从全面了解机体在外在刺激下的内在变化,能同时针对多靶点的研究技术,因而该技术的发现推动了中医药研究的进程,使得两者不谋而合的结合在一起[10-11]。
丙二醛(MDA)作为脂质过氧化的主要产物之一,是衡量机体自由基的敏感指标,能够客观的反应机体的自由基的水平,并能够反映机体脂质过氧化的程度和损伤程度[12-13]。谷胱甘肽过氧化物酶(GSH-Px)是机体广泛存在的一种重要的催化过氧化氢分解的酶,是机体重要的抗氧化剂和自由基清除剂。GSH-Px能特异的催化谷胱甘肽对过氧化氢的还原反应,可以保护细胞膜和功能的完整性[14-15]。超氧化物歧化酶(SOD)作为机体重要的抗氧化酶,是机体内天然存在的自由基清除因子,能够把有害的自由基转化为过氧化氢,其活力的高低可以间接的反映机体自由基清除能力。本研究中,通过D-半乳糖建立的衰老小鼠模型,血清的MDA含量明显增加,SOD和GSH-Px活性明显下降,但经过何首乌灌胃后,血清的抗氧化酶活性得到了明显的恢复,MDA的含量明显降低。这些结果表明,何首乌具有增强机体抗氧化酶的活性,具有延缓衰老的作用。
在我们的分析结果中,发现了衰老过程中Cdh1、Ido1、Pou4f1、Foxb1、Lhx3等凋亡基因在何首乌作用后的转录组变化显著。其中Cdh1为E-钙粘蛋白,是一种肿瘤抑制基因。Pan L等[16]采用果蝇卵巢生殖干细胞(GSCs)作为模型,表明E-钙粘蛋白下降将促进干细胞的衰老,相应的BMP信号将随着年龄的增加而减弱。Ido1为吲哚胺2,3-双加氧化酶1,该酶是一种免疫调节酶,其活性在多种炎症条件下升高,如感染、自身免疫性疾病和恶性肿瘤等[17],而在衰老过程中也常常产生炎症反应、肿瘤以及一些免疫性疾病等[18-19],因此,Ido1基因的高表达可间接的促进机体的衰老。Pou4f1又名Brn3a,是Pou结构域家族的成员。García-Ayuso D等[20]研究遗传性光感受器变性的P23H-1大鼠中,发现Brn3a的表达将随着大鼠年龄的推移而出现表达下降,因此该基因也和衰老存在不可分离的关系。目前对Foxb1和Lhx3凋亡基因虽然没有直接的文献表明与衰老相关,但该基因在维持神经系统的发育中至关重要。在常见的疾病中,如局灶性脑缺血损伤后Lhx3表达下降,并且Lhx3在运动神经系统发育中突变或缺失会造成神经性疾病,对机体脊椎和骨骼都产生一定的影响[21-22],而神经性疾病作为衰老过程中重要的疾病,因此,Lhx3基因的低表达可能调控神经性疾病的发展而推动机体衰老的进程。
综上所述,本研究首次利用转录组测序技术分析了与衰老相关的凋亡基因变化,并确定了何首乌能够调控Cdh1、Ido1、Pou4f1、Foxb1、Lhx3等基因的表达,因而为后续研究衰老提供了一个新的思路和见解。但是本研究的结果仅处于对凋亡这条通路研究,局限了对衰老的整体研究,因此后续将结合相关的通路,在整体层面上研究衰老。
