基于DTI的早中晚期帕金森病脑白质网络拓扑属性改变研究
2019-05-30邱轶慧聂坤高玉元王婉怡许齐欢张玉虎王丽敏王丽娟
邱轶慧 聂坤 高玉元 王婉怡 许齐欢 张玉虎 王丽敏 王丽娟
帕金森病(Parkinson disease,PD)是常见的神经系统退行性疾病,以运动障碍为突出表现,病理基础为黑质纹状体神经元变性坏死。但PD发病机制不仅限于神经元胞体,基础研究已证明PD神经变性与轴突病变和突触功能障碍相关,且损害白质完整性[1]。弥散张量成像(diffusion tensor imaging,DTI)是目前唯一能在活体人脑组织中显示白质纤维束走行、方向、排列、紧密度等信息的非侵入性手段。近年研究显示PD区域性白质完整性破坏,并提出DTI可作为PD疾病进展的敏感生物标志物[2]。目前基于白质纤维整体脑网络水平探讨PD疾病进展的研究尚少。本研究通过DTI成像技术结合复杂网络理论,观察PD早、中、晚期脑网络拓扑属性特征,为更深入研究PD发生发展的病理生理机制及诊疗新靶点提供支持和帮助。
1 对象和方法
1.1 研究对象招募2014年8月至2018年6月广东省人民医院就诊的PD患者66例(PD组)及31例年龄、性别、受教育程度匹配的健康志愿者(对照组)。所有受试者均无影响MRI图像质量的头部金属异物且配合MRI检查,并签署知情同意书。PD患者入选标准:(1)符合英国PD协会脑库临床诊断标准,且由两位主治医师或以上职称的神经科医师独立诊断;(2)右利手;(3)能够独立或在家属协助下完成量表测评。排除标准:(1)多系统萎缩、进行性核上性麻痹等其他神经系统变性病;(2)有严重焦虑、抑郁等精神疾病:(3)符合由心、肺、肝、肾、血液和内分泌系统等导致的系统性疾病;(4)伴严重认知障碍不配合检查者。对照组入选标准:(1)无中枢神经系统疾病史或头颅外伤史;(2)无严重躯体障碍疾病;(3)右利手,年龄40~80周岁。排除标准:(1)有焦虑、抑郁等严重精神疾病;(2)有认知障碍,简易精神状态量表(MMSE)<24分。
1.2 方法
1.2.1 一般资料收集:收集受试者性别、年龄、文化程度等一般资料。
1.2.2 量表评估:采用统一PD评定量表第3部分(UPDRS-Ⅲ)对患者进行运动功能评分,根据改良Hoehn-Yahr(H&Y)分级将患者分为早(1.0~1.5级)、中(2.0~2.5级)、晚期(3.0~5.0级)三组[3]。认知功能评估采用MMSE,抑郁及焦虑评估分别采用汉密尔顿抑郁量表(Hamilton depression scale,HAMD)和汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)。
1.2.3 MRI检查:采用GE 3.0T MRI扫描仪获取受试者3D T1加权结构像和DTI数据。参数如下:(1)3D T1加权结构像:重复时间8.4 ms,回波时间3.3 ms,矩阵256×256,视野240 mm×240 mm,层厚1 mm,共146层;(2)DTI图像:重复时间15 275 ms,回波时间75 ms,翻转角90°,视野320 mm×320 mm,矩阵128×128,层厚2.5 mm,扫描25个不同的非线性弥散加权梯度方向(b=1000 s/mm2)的图像和未施加弥散梯度方向(b=0)的图像,每个梯度扫描60层,共获得1560个文件。
数据预处理:基于 MATLAB平台,采用PANDA(Pipeline for analyzing brain diffusion images)软件完成数据预处理及脑白质网络构建。预处理包括图像转换、涡流校正和头动校正、计算DTI参数〔如部分各向异性(fractional anisotropy,FA)〕等。
1.2.4 脑白质网络构建和拓扑属性分析:(1)网络节点的定义:使用自动解剖标记(automated anatomical labeling,AAL)模版,将大脑划分成90个区域。将MRI T1结构像配准到DTI b0图像上,转化的T1进一步非线性配准到MNI空间ICBM152模板上。利用其逆变换,再把AAL模板转化到DTI原始空间,以个体各个脑区作为网络中的点。(2)网络边的定义:采用确定性纤维追踪算法对FA图像进行确定性纤维追踪,当FA小于0.2或者追踪转角大于45°时停止追踪。采用白质纤维束数量(fiber number,FN)定义网络的边并进行二值网络分析。定义两脑区间至少有三条白质纤维束(即阈值设定为3)时,脑区间存在边连接。(3)脑白质网络拓扑属性分析:利用GRETNA软件分析脑白质网络拓扑属性,包括全局属性和局部属性。全局属性代表网络整体信息传递能力,包含聚类系数(clustering coefficient,Cp)、最短路径长度(shortest path length,Lp)、全局效率(global efficiency,Eglob)、局部效率(local efficiency,Eloc)以及“小世界”网络属性。“小世界”属性包含γ、λ、σ三个重要参数。γ定义为真实网络的聚类系数与随机网络的聚类系数比值,λ定义为真实网络的最短路径长度与随机网络最短路径长度比值,σ为γ与λ两者的比值。当γ=Creal/Crandom≫1,λ=Lreal/Lrandom≈1或者σ=γ/λ>1时,网络为“小世界”网络。局部属性包括核心节点及节点效率(nodal efficiency)。核心节点是脑网络中的重要区域,可促进脑网络功能整合。本研究采用节点度(degree)定义核心节点。节点度表示某节点至其他与之产生连接的节点数目,用以刻画某节点在网络中的中心程度。当某脑区节点度大于或等于网络所有节点度平均值加标准差,则此节点为核心节点[4]。节点效率定义为某脑区与网络中所有脑区间最短路径长度倒数和的平均值,与信息传输能力呈正比。
1.3 统计学处理运用SPSS 25.0软件进行数据分析,符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,两均数比较采用双侧t检验;非正态分布的计量资料以中位数(四分位数间距)表示,多组间比较采用Kruskal-WallisH检验,两两比较采用Bonferroni检验(矫正α=0.017),两组独立样本间比较采用Mann-WhitneyU检验;计数资料比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料比较PD组与对照组间性别、年龄、受教育年限比较差异均无统计学意义(表1)。PD组分为早期21例、中期30例、晚期15例,各组间 H&Y分级、UPDRS-Ⅲ、MMSE、HAMD及HAMA评分比较差异均有统计学意义(P<0.05),且PD组晚期MMSE评分低于PD组早期,PD组中、晚期HAMD评分及PD组晚期HAMA评分高于PD组早期(均P<0.05)。结果见表2。
2.2 各组脑白质网络全局属性分析PD和对照组间聚类系数和局部效率比较无统计学差异(P>0.05),但PD组最短路径长度高于对照组,全局效率低于对照组(P<0.05);两组脑白质网络均表现出“小世界”属性(γ>0,λ≈1,σ>1),但与对照组相比,PD组γ、λ增加(P<0.05)。结果见表1。早、中、晚期PD脑白质网络全局属性差异均无统计学意义(表3)。
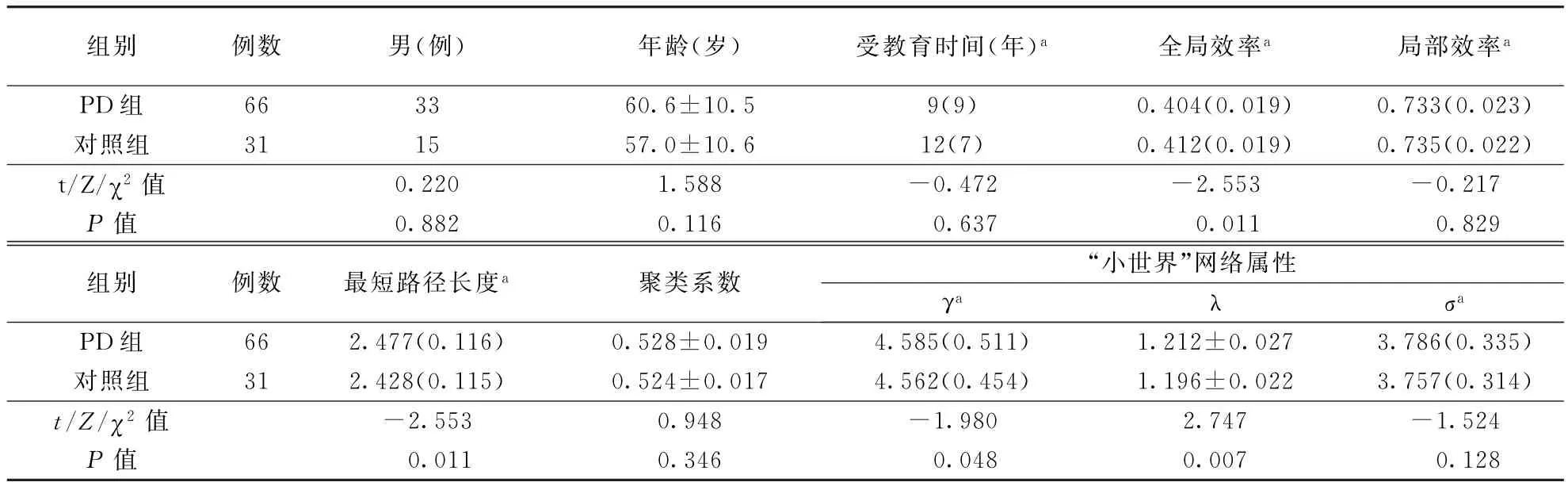
表1 两组一般资料及脑白质网络构建和拓扑属性指标比较

表2 PD患者临床资料比较
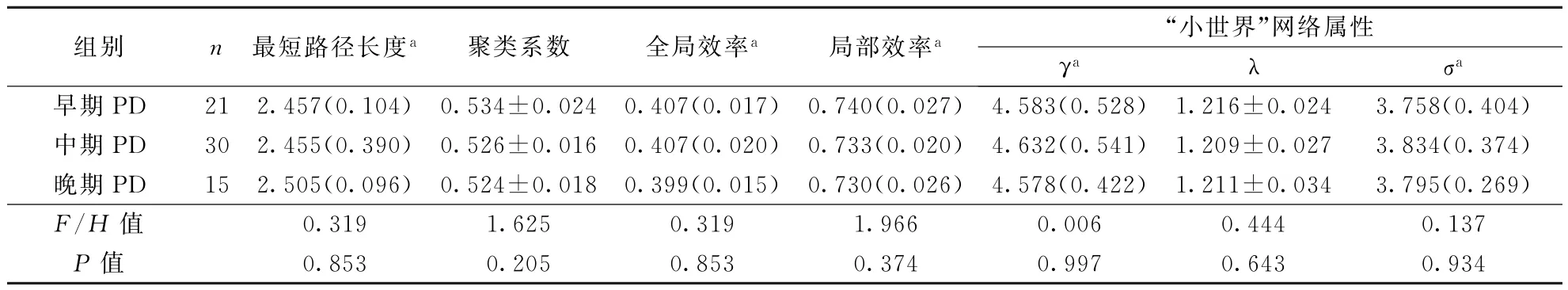
表3 早、中、晚期PD患者全局属性对比分析

图1 PD患者脑白质网络核心节点分布
2.3 各组大脑白质网络核心节点分析通过节点度筛选各组受试者脑白质网络核心节点,结果显示,PD组与对照组共有6个相同核心节点,分别为双侧豆状壳核、双侧岛叶、右侧楔前叶、左侧枕中回;此外,PD组还有3个核心节点分布于双侧中央后回及右侧中央前回(图1)。中、晚期PD较早期PD减少右侧尾状核、左侧楔前叶两个核心节点,但增加双侧中央后回及右侧中央前回3个核心节点,且相对于早、中期PD组,晚期PD组增加左侧中央前回1个核心节点(图2)。
2.4 各组脑白质网络节点效率分析与对照组比较,PD组存在广泛脑区节点效率明显降低,主要集中于颞叶(如嗅皮层、颞极:颞中回)以及皮层下区域(主要为纹状体及边缘系统)等23个脑区;此外,PD组左侧中央沟盖(额叶)、右侧顶上回(顶叶)及左侧舌回(枕叶)节点效率亦降低(表4、5)。
PD组早、中、晚期各亚组间仅左侧中央前回脑区节点效率〔中位数(四分位数间距)分别为0.421(0.035)、0.427(0.033)、0.447(0.019)〕存在统计学差异(H=6.492,P=0.039),两两比较,晚期与早期比较差异有统计学意义(Z=-2.487,P=0.013),余两两比较差异均无统计学意义(Z=-0.718,P=0.473;Z=-1.975,P=0.048)。
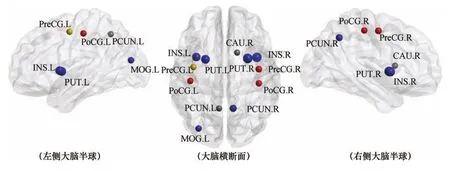
图2 PD患者早、中、晚期脑白质网络核心节点分布比较

表4 PD组与对照组大脑颞、顶、枕叶脑区节点效率比较
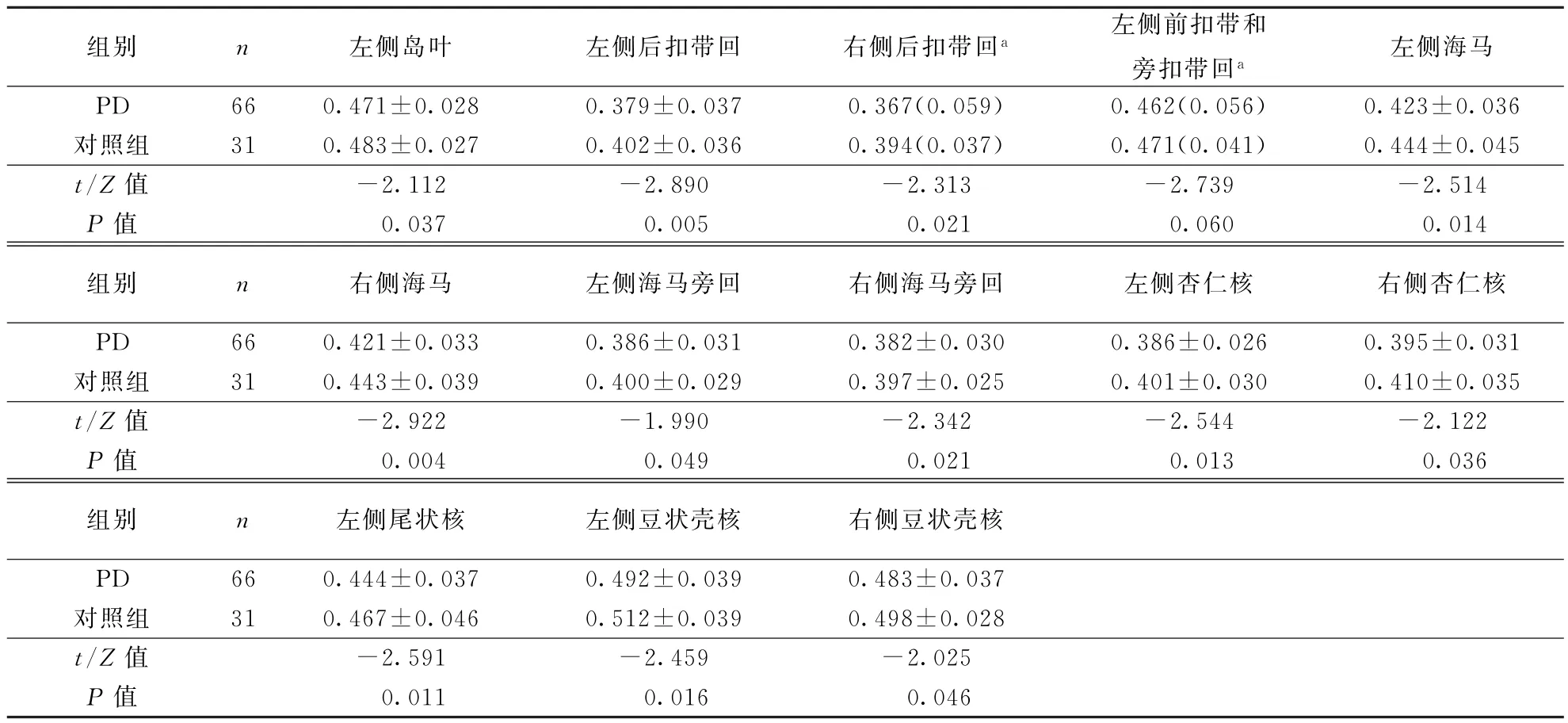
表5 PD组与对照组大脑皮层下脑区节点效率比较
3 讨论
3.1 PD不同分期脑白质网络全局属性分析本研究显示,PD患者脑白质网络整体固有连接破坏,表现为最短路径长度增加、全局效率降低,“小世界”属性保留,但与之匹配的随机网络相比,最短路径长度及聚类系数增加,这与既往研究结果一致[5]。最短路径长度增加反映脑网络中脑区间信息传递所需最短距离延长。全局效率用以衡量并行信息传输和集成处理的总体能力[6],其降低与最短路径长度增加均反映PD脑网络远隔脑区间信息传递效率下降,能量消耗增加,区域间无法进行有效即时的信息传输。其原因可能是白质纤维完整破坏导致白质纤维连接强度降低或断裂,造成脑区间信息传递故障。“小世界”网络反映信息传递局部优化和全局整合最佳平衡状态[7]。PD“小世界”网络改变,可能与神经可塑性相关。远隔脑区间信息传递效率降低导致神经网络适应性变化,引起局部信息处理能力增强。但PD早、中、晚期各亚组间全局属性比较并无统计学差异。因此,推测认为PD疾病初期即存在脑白质网络整体信息传递效率降低,贯穿疾病始终。
3.2 PD不同分期核心节点分析核心节点是脑网络重要区域,与其他脑区相互作用,促进功能整合,在网络抗攻击能力中发挥关键作用[8]。本研究发现,随病情严重程度加重,右侧尾状核、左侧楔前叶两个核心节点缺失,增加位于中央前回及中央后回的核心节点,提示以上脑区可能在PD白质网络功能整合中起关键性作用,其白质纤维受损导致网络完整性破坏,引起PD发生发展。纹状体是机体重要的皮质下运动调控中枢,对肌张力、姿势、精细运动等调节均发挥重要作用,尾状核是其重要结构之一。一项纳入411例PD患者的回顾性研究显示,同侧尾状核头部多巴胺消耗程度与PD严重程度呈正相关[9]。中央前回(即皮层运动区)是纹状体-丘脑-皮层环路(striato-thalamo-cortical,STC)重要皮层投射区。STC是引起PD运动迟缓、肌强直的神经网络基础。黑质纹状体多巴胺能神经元退行性变可引起STC功能改变,导致丘脑运动核团对运动皮层的兴奋减低。功能磁共振研究发现,以皮层运动区为靶点的高频重复经颅磁刺激可提高运动皮层兴奋性,并产生远隔效应作用于尾状核等远隔脑区,引起尾状核活动增加,恢复神经环路正常功能状态,改善PD运动症状[10]。此外,皮层感觉区(中央后回)同样存在PD早、中、晚期核心节点中有统计学差异,其与皮层运动区是小脑-丘脑-皮层运动环路(cerebello-thalamo-cortical,CTC)重要脑区。CTC可代偿STC对运动调节所造成的损害。伴随PD疾病进展,CTC募集增加,以克服STC功能缺陷[11]。可见,尾状核、运动与感觉皮层网络结构改变可能通过影响STC及CTC环路功能整合,导致PD症状发生发展。另外,左侧楔前叶在中晚期PD脑网络核心节点中缺失,结合本研究临床资料分析结果,可认为这种改变可能同病情进展、认知障碍加重有关。研究显示PD痴呆患者左侧楔前叶皮层萎缩[12]。因此,以上脑区白质纤维受损可能可作为PD诊断及监测疾病进展的影像学标识,并有望成为新型神经调控技术治疗PD的靶点。
3.3 PD不同分期脑白质网络节点效率分析本研究显示,PD患者存在广泛皮层及皮层下脑区节点效率降低,主要集中于顶叶、颞枕区、纹状体、边缘系统等,多为默认网络(default mode network,DMN)、中心执行网络(central executive network,CEN)、突显网络(salience network,SN)以及视觉通路的关键脑区。节点效率越低表明脑区间信息传输最短路径长度越长,白质纤维破坏程度越重。研究显示DMN、CEN和SN在抑郁、认知障碍等神经精神疾病发病机制中起重要作用[13]。DMN包括后扣带回、外侧顶下皮质、海马、内侧颞叶等区域,参与人脑对内外环境的监测、情绪加工、自我内省、维持意识觉知、情景记忆提取等。以背外侧前额叶和后顶叶皮质为关键区域的CEN激活则集中于外部注意依赖性的刺激任务。SN由双侧前岛叶、背侧前扣带回和皮质下区域(如杏仁核、纹状体)脑区组成,负责整合各种感觉信息以应对内外环境的变化,使特定的脑区对突显的刺激做出适当反应,参与大脑自下而上的信息处理过程,在DMN和CEN的激活切换发挥关键作用。研究报道前岛叶是SN关键节点[13]。PD纹状体功能障碍可直接影响岛叶功能,从而影响SN功能完整性,削弱其在CEN和DMN之间切换作用,引起PD抑郁、认知障碍等非运动症状[14]。本研究发现PD右侧顶上回及颞枕区节点效率下降。顶叶及颞枕区是视觉信息加工通路上重要脑区。视觉障碍在PD中普遍存在,可能成为PD与帕金森综合征鉴别要点[15]。然而,与核心节点分析结果类似,早、中、晚期PD节点效率差异脑区仅为左侧中央前回,且节点效率增高,推测可能与CTC环路代偿机制有关,但具体机制尚需进一步深入研究。由上述结果推测,与PD非运动症状如认知障碍、抑郁、视觉障碍等相关神经环路中白质纤维变性、断裂在疾病初期已存在,贯穿PD整个病程,可能可作为PD早期预警。皮层运动区网络结构的改变可能是PD疾病进展的特征性影像学表现。
综上所述,PD患者脑白质网络整体信息传递效率降低,与非运动症状相关的神经环路中重要脑区在疾病初期已广泛存在节点效率减低,STC及CTC中关键脑区如尾状核、皮层运动区及皮层感觉区,尤其是皮层运动区白质网络改变可能在PD疾病进展中起决定性作用。这将为更深入研究PD发生发展的病理生理机制及诊疗新靶点提供一定支持和帮助。但本研究为橫断面研究,且仅利用DTI构建脑白质网络,未来的工作将与功能影像结合,并对患者进行随访,以更全面了解PD患者脑结构及功能网络与PD发生发展的关系。
