基于表观遗传的摄取型药物转运体表达调控是肿瘤耐药干预的新途径
2019-05-29余露山
余露山,曾 苏
0 引 言
肿瘤是最常见的恶性疾病之一,其发病率、致死率名列前茅,严重威胁人们的生命健康[1]。一些化学治疗药物,效率不高,重复性差,毒性较大,特别是肿瘤对于化疗药物的多药耐药性成为肿瘤治疗的难点。肾细胞癌(renal cell carcinoma,RCC)是起源于肾实质泌尿小管上皮系统的恶性肿瘤,又称肾腺癌(简称肾癌),占肾恶性肿瘤的90%,占人类恶性肿瘤的2%~3%;70%~85%肾癌为透明性肾细胞癌(clear cell RCC,ccRCC)[2]。目前,在局限于肾及其局部淋巴结的RCC患者中,肾切除术或保留肾单位的肿瘤切除术是主要的治疗方式,而对于转移性RCC,细胞毒抗癌药物如铂类等治疗在RCC中几乎没无益处,即RCC具有高度耐药性,然而其机制尚未明确[3]。因此,研究肿瘤耐药新机制,有助于发现药物作用新靶标和新疗法。
1 药物代谢酶和转运体与肿瘤耐药
药物代谢酶和转运体参与了抗肿瘤药物在体内的吸收、分布、代谢和排泄(absorption,distribution,metabolism and excretion,ADME)过程,对抗肿瘤药物疗效发挥起了重要的作用。目前,对肿瘤耐药的研究多集中在肿瘤药物作用靶点和肿瘤微环境,对肿瘤耐药与药物代谢酶和转运体的关系研究较少;对药物代谢酶和转运体介导的抗肿瘤药物ADME的过程研究较多,而对药物代谢酶和转运体与肿瘤防治的关系研究较少。药物代谢酶可以使抗肿瘤药物激活或失活,药物转运体可以将抗肿瘤药物摄取进入或外排出肿瘤细胞,因此,药物代谢酶和转运体在肿瘤耐药中发挥重要作用[4]。其中,药物转运体变异使抗癌药物摄取减少或外排增加可引起耐药,因此,药物转运体是肿瘤耐药的潜在靶点和生物标志物[5]。表1列举了基于药物代谢酶和转运体产生耐药性的部分抗肿瘤药物,包括靶向药物和细胞毒药物。

表1 基于药物代谢酶和转运体产生耐药性的部分抗肿瘤药物Table 1 Some anti-tumor drugs producing drug resistance based on drug metabolizing enzymes and transporters
SLC22A2基因编码的有机阳离子转运体OCT2(organic cation transporter member 2),定位于人类基因组chr 6q26上,共编码555个氨基酸,其二级结构具有12个跨膜区域[6]。SLC22A2基因近端启动子区含有两个CpG岛(CpG islands,CGI),分别位于转录起始位点(TSS)上游和-320~-66bp和下游+76~+644bp。另外,远端启动子区也含有一个CGI,位于TSS上游-1605~-1402bp。SLC22A2主要分布在肾近曲小管的基底侧[7],是肾中最主要的有机阳离子转运体[8],在肾小管的药物分泌和重吸收过程中发挥重要作用,因此,其功能涉及临床上很多内源性物质和常用药物在体内的吸收、分布、代谢和排泄过程,其底物包括奥沙利铂(oxaliplatin,Oxa)等铂类抗肿瘤药物[9]。
铂类药物主要经OCTs摄取进入细胞发挥细胞毒性作用,同时也经肾小管上皮细胞基底膜上的OCTs和顶膜上的多药及毒性化合物外排转运蛋白MATE-2K分泌至尿液,排出体外。Burger等[10]发现,OCT2对各铂类化合物的转运能力不同,由高到低依次为奥沙利铂、二氯环己二氨合铂、奥马铂、反铂、顺铂,而对卡铂则没有转运能力。还有研究证明OCT2能显著增加奥沙利铂在细胞内的积聚,增强细胞毒性[11-12]。虽然铂类药物也可经其他有机阳离子转运体如OCT1[11]、OCT3[13]摄取进入细胞,但这些转运体在肾小管上皮细胞中的表达较低,亲和力也较弱,因此OCT2的表达水平与活性对铂类抗癌药尤其是奥沙利铂在肾癌细胞中的积聚以及细胞毒性起决定作用。
2 药物表观遗传学与耐药
药物基因组学研究的是基因序列多态性(突变)引起的药物疗效和毒性的变化,虽然药物基因组学是临床个体化用药的重要因素,然而只能解释一部分临床药物治疗的个体差异性[14]。药物表观遗传学是研究基因的核苷酸序列不发生改变的情况下,基因表达可遗传的变化引起药物代谢、响应和毒性改变的机制及其应用。有研究发现,表观遗传学也通过影响编码药物ADME蛋白的基因表达,在临床个体化用药方面发挥重要作用[14-17]。表观遗传学为DNA序列未改变的情况下而引起的基因表达的可遗传性改变[18]。表观遗传机制包括DNA甲基化、染色质变异:组蛋白共价和非共价修饰机制、非编码RNA(non-coding RNA,ncRNA)。DNA甲基化是由DNA甲基化转移酶(DNA methyltransferases,DNMT)介导的化学修饰,主要发生在CGI,通常与基因的转录抑制相关,且DNA甲基化是可逆的,癌症中DNA甲基化的异常已成为研究热点。核小体是由DNA和组蛋白形成的染色质基本结构单位,包含4个亚基H1-H4,组蛋白翻译后的修饰如组蛋白乙酰化、甲基化、磷酸化、泛素化、糖基化等能调节染色质状态及转录机制,其中乙酰化和甲基化是研究热点。组蛋白甲基化指发生在H3和H4组蛋白N端精氨酸或者赖氨酸残基上的甲基化,并不影响组蛋白电荷,其转录效应取决于受影响的残基以及甲基化程度(单、双、三甲基化)。组蛋白乙酰化可以中和赖氨酸残基的正电荷以减弱组蛋白与负电荷的DNA之间的相互作用,使得染色质构象更为松散,通常组蛋白高乙酰化促进基因转录。与DNA甲基化类似,组蛋白乙酰化也是可逆的甚至更加活跃,在体内处于高度动态的状态,由组蛋白乙酰转移酶和组蛋白去乙酰化酶维持相对平衡。ncRNA是指不编码蛋白质,但具有某些功能的RNA。ncRNA包括miRNA、siRNA,及片段大于200bp的lncRNA、circRNA等,其中研究最为广泛和成熟的是miRNA。目前,miR-122、miR-34等miRNA类药物,已批准进入临床试验[19]。可见,药物表观基因组的改变与传统的基因突变的区别在于:表观遗传改变是可逆的,常发生在基因的启动子区;而基因突变则一般是不可逆的,多发生在编码区;表观遗传改变的回复频率高于基因突变的回复频率。进入21世纪以来,表观遗传修饰异常与肿瘤发生发展的关系颇受关注,很多异常修饰出现在肿瘤发生明显恶化之前,可以作为潜在的癌症早期诊断和肿瘤分型的生物标志物以及预测治疗效果和预后的标志物[20]。特别是表观遗传的可逆性,还可以作为药物靶标,研发抗肿瘤药物和新的联合治疗方案[21-23],如图1所示。
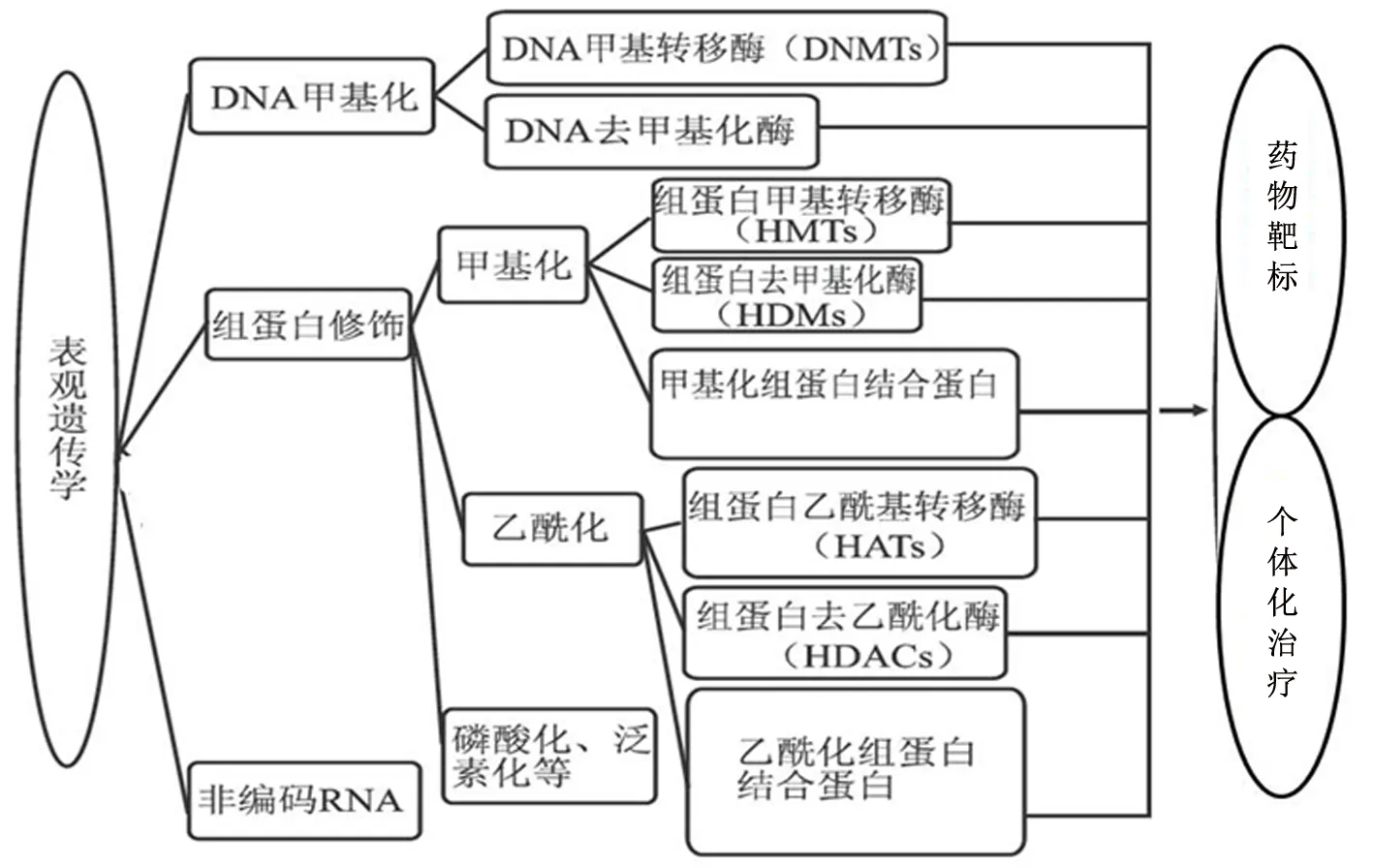
图1 表观遗传学机制与药物靶标和个体化治疗的相关性Figure 1 Correlation between epigenetic mechanisms and drug targets and individualized treatment
3 肾癌耐药的潜在靶标OCT2
Oncomine™数据库中Microarray数据显示,SLC22A2基因在肾癌肿瘤组织中的mRNA表达显著低于癌旁组织。我们检测了46对中国患者配对RCC组织,SLC22A2基因的mRNA和蛋白表达在肾癌患者肿瘤组织中显著低于癌旁组织[24-25]。由于OCT2是铂类药物摄取进入肿瘤细胞的主要转运体,提示OCT2低表达与RCC多药耐药可能有关。SLC22A2基因在肾癌组织中的表观遗传现象仅有少数报道,而机制研究更少[26-27]。我们进一步研究显示,DNA甲基化导致RCC细胞系及患者中SLC22A2基因的转录抑制,其机制是SLC22A2基因近端启动子区CpG岛的高甲基化水平,尤其是近端启动子区E-box位点的高甲基化,抑制了原癌基因c-MYC与E-box位点结合,c-MYC招募能力减弱引起组蛋白甲基转移酶MLL1募集降低,MLL1负责催化SLC22A2基因启动子区的转录激活信号H3K4Me3,高甲基化导致富集在SLC22A2基因启动子区的组蛋白修饰H3K4Me3显著下降,最终抑制起始转录,下调OCT2蛋白表达水平,见图2。根据上述机制,我们在细胞水平和RCC细胞(786-O,Caki-1)裸鼠移植瘤模型,设计了DNMT抑制剂地西他滨(Decitabin,DAC)与OCT2底物类抗癌药物Oxa的序贯联合用药方案,实验发现表观遗传药物DAC可以有效降低RCC细胞中SLC22A2基因的甲基化水平,增加OCT2的表达并提高Oxa在肿瘤组织及细胞的蓄积,联合用药策略能够逆转耐药,杀死肿瘤细胞。
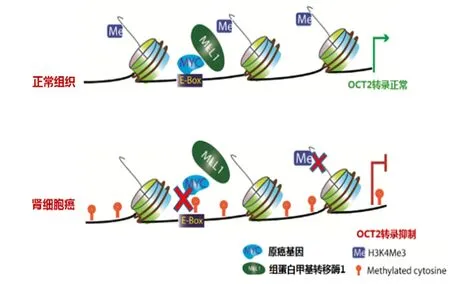
图2 肾细胞癌中SLC22A2表达下降的DNA甲基化调节机制Figure 2 DNA methylation regulation mechanism of down-regulation of SLC22A2 expression in renal cell carcinoma
4 总结与展望
Winter等[28]采用MALDI-TOF MS测定ccRCC转移(n=20)和原发瘤(n=34)患者样本,结果显示OCT2高表达,与肾癌细胞结果和我们的研究结果有差异;并发现肾其他转运体OCT3、CTR1、SLC47A1也参与了奥沙利铂的转运,所以,作者认为需进一步研究OCT2在奥沙利铂逆转肾癌耐药中作用。由于OCT2表达的个体差异,采用同一个肿瘤患者配对样本研究才能获得差异性表达的可比性结果,我们检测了46对ccRCC患者肾癌及其配对癌旁组织中的OCT2,无论是mRNA和蛋白表达,肾癌组织均显著低于其癌旁组织。OCT3和CTR1在肾组织中丰度较低且与奥沙利铂的亲和力也低[11,29]。DAC处理3株肾癌细胞后并不能增加MATE1的表达。奥沙利铂也是MATE2K的底物,负责将药物从肾外排至尿中;与配对的癌旁组织比较,MATE2K在肾癌组织中也是低表达,其机理涉及组蛋白修饰而与DNA甲基化无关[30]。DNA的甲基化在肾癌的诊治中发挥了重要的作用[31]。DAC在打开肾癌细胞上OCT2前门的同时,保持关闭MATE2K这扇后门,使得通过前门进入的奥沙利铂在肾癌细胞中蓄积,从而杀死肿瘤细胞。因此,鉴于OCT2在肾小管上皮细胞对铂类抗肿瘤药物尤其是奥沙利铂的摄取中发挥主导作用,预测OCT2的表达丢失是RCC对奥沙利铂耐药的机制之一,我们研究发现了DNA甲基化对肾细胞癌中OCT2表达下降的重要作用,阐明了其调节OCT2表达的机制,回答了“药物摄取型转运体动态修饰是肿瘤耐药的干预靶点”这一重要科学问题。Sci Transl Med杂志高度认可了我们的研究成果,认为我们的研究“打开了药物进入癌细胞的一扇门”[25],Nat Rev Nephrol杂志也以“肾癌:OCT2去甲基化砸开了奥沙利铂耐药的门”为题高度评价了我们的研究工作[32]。然而,我们的工作仅在细胞异种移植瘤动物模型上获得验证,还需要开展以病人源性移植瘤模型和临床试验研究,以期获得DAC和奥沙利铂联合应用给药方案的临床治疗效果数据。
