养殖中华鳖蜡样芽孢杆菌的分离、鉴定和致病性研究
2019-05-29孟庆珍傅超英刘长军娜王张鸿鹄
孟庆珍 尹 飞 傅超英 陈 凡 刘长军 袁 娜王 力 张鸿鹄 钱 冬
(1. 宁波大学海洋学院, 宁波 315000; 2. 浙江省杭州市水产技术推广总站, 杭州 310000;3. 浙江省象山县海洋与渔业局, 象山 315711)
中华鳖(Pelodiscus sinensis), 俗称甲鱼等, 属爬行纲(Reptilia)、龟鳖目(Testudinata)、鳖科(Tironychidae)、鳖属(Pelodiscus), 我国除西藏、青海、新疆外其他各省均有分布[1]。目前我国中华鳖主要养殖区域为长江中下游地区及南方省份。中华鳖营养丰富、风味独特, 民间认为具有滋补功效, 经济价值较高, 特别是各类龟鳖免疫制品受到广大消费者喜爱。新型优良品种和配套养殖模式极大促进了中华鳖养殖业的迅速发展[2]。我国2015年中华鳖总产量3.413×108kg, 主要分布在浙江、广东、湖北、江苏、江西、广西、安徽等地, 浙江省中华鳖养殖产量占全国总产量50%左右, 是全国最大的中华鳖养殖省。随着人工养殖中华鳖规模和养殖密度不断提高, 养殖病害发生逐渐频繁[3]。迄今为止已报道30多种中华鳖疾病[4], 先后分离报道了嗜水气单胞菌(Aeromonas hydrophila)[5]、迟缓爱德华氏菌(Edwardsiella tarda)[6]、奇异变形杆菌(Proteus mirabilis)[7]、摩氏摩根菌(Morganella morganii)[8]等细菌病原。近年来, 还报道了由芽孢杆菌引起的养殖中华鳖疾病[3,9]。
2016年6—7月, 杭州富阳某养殖场中华鳖大量死亡, 体重500g以上成鳖日死亡率20%以上, 严重时日死亡100只以上, 造成极大的经济损失。典型症状是患病中华鳖游至岸边, 不断上下摇头而亡;解剖后发现腮腺严重充血、肝脾肿大、肠系膜充血。为尽快明确发病原因, 本研究从濒死中华鳖中分离到芽孢杆菌, 经菌体形态、生化性状和16S rDNA和gyrB基因序列分析和系统发育树对菌株进行了鉴定, 研究了分离菌株的致病性。
1 材料与方法
1.1 材料
发病中华鳖来自杭州市某养殖场, 该场单养中华鳖, 养殖总面积0.03 km2, 养殖池平均面积666.67 m2,放养中华鳖约1只/ m2(规格250 g)。健康中华鳖(200±2) g购自浙江宁波张斌桥市场, 室温(27±0.5)℃暂养7d无异常后用于感染实验。4周龄小鼠(18±2) g和乳鼠(3.3±0.1) g由宁波大学实验动物中心提供。
细菌鉴定采用生物梅里埃API 50 CHB快速生化鉴定条, 购自杭州怡丹生物技术有限公司、实验用营养琼脂、LB、10%脱纤维羊血琼脂平板购自北京陆桥技术股份有限公司, 牛奶琼脂平板为实验室自配[10], 芽孢染色液购自杭州滨和微生物试剂有限公司, 瑞氏-姬姆萨染液购自珠海贝索生物技术有限公司、基因组DNA提取试剂盒和p-EASY-T1 Cloning试剂盒购自全式金生物科技有限公司、TaqDNA聚合酶和2×mix购自康为世纪生物科技有公司。
1.2 方法
病样采集调查养殖场中华鳖发病时养殖模式和疾病情况, 了解发病率及死亡率。查看濒死中华鳖发病症状, 解剖观察, 取发病中华鳖血、肝涂片, 用瑞氏-姬姆萨染色, 具体方法见参考文献[11]。
分离菌株回归感染取典型症状的濒死中华鳖, 75%酒精体表消毒, 从血、肝、脾、肺、肾分离细菌, 分别接种于营养琼脂28℃, 培养18h, 挑取纯化优势菌株无菌生理盐水重悬至溶度为4 Mc-Farland。用无菌生理盐水稀释至1.2×108、1.2×107、1.2×106CFU/mL, 肌肉注射感染暂养1周的健康中华鳖, 每只注射0.1 mL, 对照注射相同量的无菌生理盐水, 注射后饲养于140 L水族箱中, 每箱养殖13只, 养殖水深为10—15 cm, 水温(27±0.5)℃; 试验期间, 每天用喷壶喷水3—4次, 以保持中华鳖身表湿润, 每天观察发病、死亡情况。
细菌的分离和纯化根据回归实验结果, 将感染症状与自然发病症状相似的菌株接种于营养琼脂, 28℃培养18h, 菌株编码为T91-1, 用含30%甘油的营养肉汤保存于-80℃冰箱备用。
分离菌株T91-1的形态观察T91-1菌株在营养琼脂平板上28℃培养18h, 观察菌落形态; 并用生理盐水制取菌悬液做芽孢染色; 取新鲜纯培养的直径约1 mm菌落, 制作切片, 染色, H-7500透射电镜观察芽孢的形态, 具体方法见参考文献[12]。
T91-1菌株生理生化鉴定挑取营养琼脂平板28℃培养18h的T91-1菌落, 制成溶度为6×108CFU/mL的菌悬液, 接种到API 50 CHB试剂条, 28℃下培养 24h, 观察颜色变化。同时T91-1接种10%脱纤维羊血琼脂培养基和脱脂牛奶培养基上, 28℃培养18h, 观察溶血和蛋白酶活力。
基因扩增、转化和序列分析T91-1菌株接种至营养琼脂中培养过夜(28℃), 挑取单菌落在200 μL的去离子水中重悬, 100℃水浴10min, 冰浴5min, 12000 r/min离心5min, 取上清备用。16S rDNA PCR扩增引物为: 27F 5′-AGAGTTTGATCC TGGCTCAG-3′/1492R 5′-GGCTACCTTGTTAC GACTT-3′。50 μLPCR反应体系: 27F、1492R引物(10 μmol/L) 各1 μL, 2×mix 25 μL, 双蒸水补足体积,PCR扩增条件: 94℃预变性 2min; 94℃ 1min, 53℃1min, 72℃ 1min, 35 个循环; 72℃延伸 7min;PCR扩增产物1%琼脂糖电泳分离后回收纯化PCR产物, 纯化16S rDNAPCR产物经p-EASY-T1 Cloning试剂盒导入大肠杆菌DH 5α中, 从含氨苄青霉素LB培养基上挑取单一白斑菌落, 提取质粒送华大基因测序。
将所得序列与GenBank中的核酸序列同源性序列比对分析, 选取与菌体T91-1相似性较高的细菌16S rDNA序列, 使用MAGE软件, 采用邻接法(Neighbor-joining)获系统发育树, 自展数据集为1000次。
GyrB基因扩增和序列分析同上制备DNA模板,GyrB基因PCR扩增引物序列和反应条件见参考文献[13, 14]。GyrB基因PCR扩增产物经1%琼脂糖凝胶电泳分离后用试剂盒回收纯化PCR产物, 送华大基因测序。
T91-1对小鼠的毒力将90只健康的小鼠(18±2) g随机分成十组(每组9只)。同上文方法制备T91-1菌悬液, 以1.5×108、1.5×107、1.5×106和1.5×105CFU/mL小鼠腹腔注射和灌胃, 每只感染0.1 mL, 对照组注射和灌胃等量无菌生理盐水; 每天观察发病、死亡情况。同时, 将36只健康的乳鼠随机分成4组(每组9只), 以1.2×108、1.2×107、1.2×106CFU/mL浓度分别对每组乳鼠灌胃, 每只注射 0.1 mL, 对照组灌胃等量的无菌生理盐水, 并观察发病、死亡情况。
组织病理观察自然发病濒死中华鳖的组织样品分别用波恩氏液浸泡1h, 固定的组织用70%乙醇洗至无色, 用70%—100%的乙醇逐级脱水,用石蜡包埋, 切片, HE染色, 在显微镜下观察。
2 结果
2.1 患病症状及解剖观察
患病中华鳖发病初期四肢无力, 厌食, 反应迟钝, 游至岸边, 竖起身体, 不断上下摇头而亡(图版Ⅰ-1); 解剖中华鳖腮腺严重充血(图版 Ⅰ- 3), 脾脏肿大, 呈暗紫色(图版 Ⅰ-5), 肠系膜出血(图版 Ⅰ-7)。瑞氏-姬姆萨染色结果如图, 自然发病濒死的中华鳖血(图版 Ⅰ-9)、肝(图版 Ⅰ-10)涂片中均发现大量的短杆状芽孢杆菌。
2.2 T91-1对中华鳖回归感染
用分离株T91-1对健康中华鳖进行回归感染。1.2×108CFU感染的中华鳖在感染后第3天开始出现死亡, 至感染后第7天各实验组的累计死亡率分别为100%(1.2×108CFU/mL)、100%(1.2×107CFU/mL)、40%(1.2×106CFU/mL)和40%(1.2×105CFU/mL)。用SPSS软件分析, 其LD50为4.91×105CFU/ind.。发病和死亡的中华鳖病症与自然发病中华鳖症状相同, 石蜡切片结果显示, 攻毒后在濒死的中华鳖肝、肾组织中, 可见大量短杆状、革兰氏阳性的芽孢杆菌。生理盐水注射对照组无异常症状或者死亡, 中华鳖体内未分离到芽孢杆菌。
2.3 T91-1菌株形态
分离株T91-1在营养琼脂培养基表面粗糙、干燥、呈低凸起形, 边缘不规则、似圆形、质地松软、无色素、颜色为灰色的毛玻璃状菌落, 菌落直径5—7 mm(图1A), 菌体大小为(1.0—1.2) μm×(3.0—5.0) μm, 圆形芽孢大小1.0—1.5 μm, 中生或近中生(图1B)。透射电子显微镜下芽孢呈卵圆形,可观察到前芽孢和已经释放的芽孢(图1C)。
2.4 T91-1生理生化特性
由表1可见, T91-1为葡萄糖、果糖、甘露醇、淀粉、糖原、核糖、N-乙酰葡萄糖胺、七叶灵、葡萄糖酸钾阳性; 阿拉伯糖等均为阴性; API系统鉴定生化鉴定系统(APIWEB Plus software V3.2.2 Version)分析表明与蜡样芽胞杆菌相似度分别为97.4%, 经伯杰氏细菌手册[15]与蜡样芽胞杆菌ATCC14579基本符合, 鉴定为蜡样芽胞杆菌。
T91-1在10%脱纤维羊血培养基生长良好,28℃18h菌落为浅灰色、不透明、溶蜡状, 同时出现明显的β溶血, 内层为清晰透明的溶血圈, 外层为不完全溶血的半透明溶血圈; 脱脂牛奶平板上, 出现完全透明的蛋白水解圈。
2.5 16S rDNA基因序列和系统发育分析
将T91-1 16S rDNA基因序列(登录号: KY648906)进行BLAST同源性序列比对分析, 与蜡样芽孢杆菌的相似性为99%。在系统发育树中, 分离株T91-1与苏云金芽孢杆菌、蜡样芽孢杆菌、维德曼芽孢杆菌(Bacillus wiedmannii)及东洋芽孢杆菌(Bacillus toyonensis)聚为一类, 表明分离株T91-1为蜡样芽孢杆菌(图2)。
2.6 gyrB基因序列和系统发育分析
为进一步确认T91-1的分类地位, 克隆并测定了T91-1gyrB基因序列, BLAST同源性序列比对分析表明: T91-1的gyrB基因蜡样芽孢杆菌的相似性为99%。系统发育树分析T91-1与蜡样芽孢杆菌聚为一类。综合16S rDNA进一步鉴定表明为蜡样芽孢杆菌(图3)。
2.7 T91-1对小鼠的致病性
为检测蜡样芽孢杆菌分离株T91-1对人类的潜在致病性和毒性, 采用ICR乳鼠进行灌胃攻毒。灌胃24h后, 高浓度组(1.2×108CFU/mL)乳鼠全部死亡;48h后, 中浓度组(1.2×107CFU/mL)乳鼠死6只, 低浓度组(1.2×106CFU/mL)乳鼠死3只; 72h后, 各组灌胃乳鼠全部死亡, 死亡鼠出现皮下、脚掌、脑部等出血(图4)等症状; 口灌盐水组未出现症状和死亡。腹腔注射和口灌的4周龄实验小鼠12—24h出现反应迟钝、厌食等症状, 24h后逐渐恢复正常, 未出现死亡; 对照组未观察到异常症状。

图1 蜡样芽孢杆菌分离株T91-1Fig. 1 B. cereus T91-1
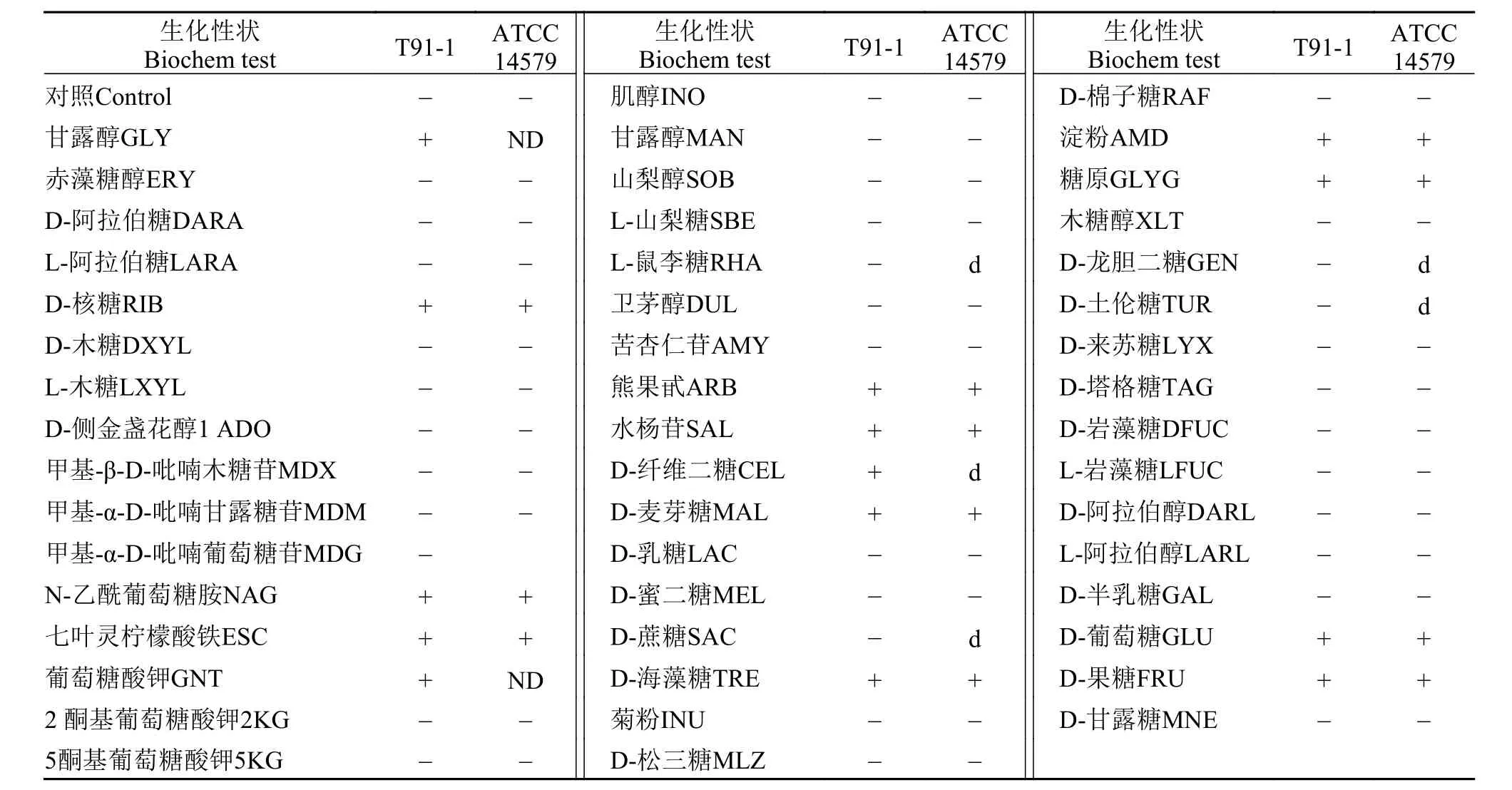
表1 API 50 CHB生化鉴定结果Tab. 1 The result of API 50 CHB

图2 蜡样芽孢杆菌分离株T91-1的16S rDNA序列邻接法构建系统发育树Fig. 2 Phylogenetic tree constructed from 16S rDNA sequence analysis by Neighbor-Joining method
2.8 发病中华鳖的主要器官病理特征
取天然发病中华鳖肾、肝、肺等组织, 固定后经HE染色, 可见发病中华鳖肾、肝、肺出现明显病理变化, 其中肾损伤严重, 近曲小管上皮细胞核肿大, 发生颗粒变性, 肾小管上皮细胞向管腔靠近,严重时相互分离或与基膜剥离, 部分上皮细胞胞核呈溶解状态, 肾小囊囊腔变大, 肾血管球缩小, 肾小球内皮细胞萎缩, 胞核固缩, 部分肾血管球血管破裂, 红细胞渗出, 或肾小球坏死、解体, 肾脏结构出现崩解(图版 Ⅱ); 肝细胞肿大、大量肝细胞颗粒变性, 肝中央静脉和窦状隙周围大量红细胞, 肝细胞界限模糊, 血管壁上皮细胞增生, 胞质不均匀, 细胞核被挤向一边, 染色质淡染, 部分消失(图版 Ⅱ); 肺泡上皮细胞坏死, 血管扩张充血(图版 Ⅱ-7), 并且出现大量铁血黄素沉着(图版Ⅱ-8), 嗜酸性粒细胞浸润(图版 Ⅱ-8);心脏血管扩张充血, 组织松散(图版Ⅱ-10), 心脏组织中可观察到大量嗜酸性粒细胞浸润(图版 Ⅱ-11)。

图3 蜡样芽孢杆菌分离株T91-1的gyrB序列邻接法构建系统发育树Fig. 3 Phylogenetic tree constructed from gyrB sequence analysis by Neighbor-Joining method
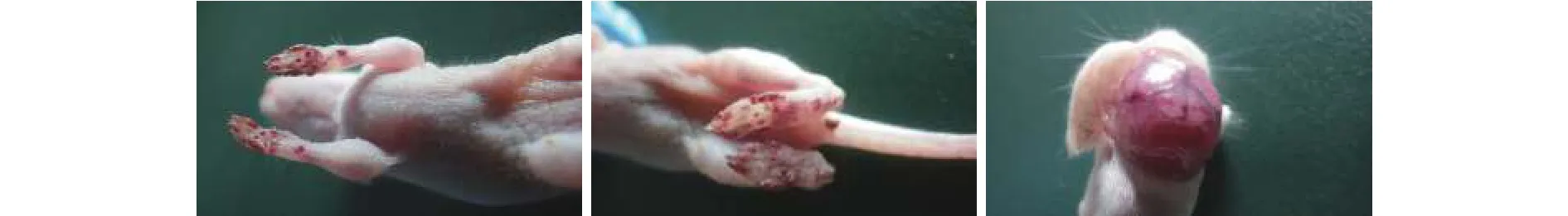
图4 T91-1口灌感染乳鼠的皮下出血症状Fig. 4 Subcutaneous hemorrhagic symptoms of moribund sucking mice oral infected by B. cereus T91-1
3 讨论
2016年6月至7月, 杭州某养殖场中华鳖大面积死亡, 发病中华鳖血液和肝涂片瑞氏-姬姆萨染色后, 发现大量芽孢样杆菌。从濒死中华鳖中分离到的T91-1回归感染健康中华鳖可出现与自然发病中华鳖相似症状,LD50为4.91×105CFU/ind., 人工感染发病中华鳖内脏可分离到大量芽孢杆菌纯菌落, 人工感染鳖肝、肾切片中可见大量芽孢杆菌, 表明T91-1对中华鳖有很强致病性, 是本次引起杭州市中华鳖发病的病原菌。T91-1在营养琼脂和血平板上呈浅灰色、不透明、毛玻璃状菌落和典型β溶血;芽孢染色和菌体超薄切片显示为中生或近中生芽孢。T91-1菌株为葡萄糖、果糖、甘露醇、淀粉、糖原、核糖、N-乙酰葡萄糖胺、七叶灵、葡萄糖酸钾阳性, 经API生化鉴定系统V3.2.2分析表明与蜡样芽胞杆菌相似度分别为97.4%, 与蜡样芽胞杆菌典型菌株ATCC14579性状基本符合[15], 鉴定为蜡样芽胞杆菌。T91-1的16S rDNA序列和gyrB基因序列分析表明与蜡样芽孢杆菌的相似性均为99%; 在系统发育树上, 16S rDNA序列与同为蜡样芽孢杆菌群的蜡样芽孢杆菌、苏云金芽孢杆菌(B. thuringiensis)以及近年来新发现的维德曼芽孢杆菌(B.wiedmannii)及东洋芽孢杆菌(B. toyonensis, 又译作图瓦永芽孢杆菌)聚为一类;gyrB基因系统发育树分析表明T91-1与同为蜡样芽孢杆菌群的蜡样芽孢杆菌、苏云金芽孢杆菌和炭疽芽孢杆菌(B. anthracis)聚为一类。综合上述分析, 确定T91-1为蜡样芽孢杆菌。T91-1血平板上呈典型β溶血, 与苏云金芽孢杆菌、蕈状芽孢杆菌的弱溶血及炭疽芽孢杆菌的不溶血有明显区别[16]。
蜡样芽孢杆菌在自然界分布广泛, 不同菌株的致病性差异性大[17]。蜡样芽孢杆菌也是重要的食源性致病菌, 可造成人类患呕吐综合症、腹泻综合症等疾病, 患者可发生心内膜炎和败血症等症状[18,19],也可引起新生儿患脑膜炎直至致死[20]。近年来, 蜡样芽孢杆菌引起水生生物致病的报道有增加的趋势, 先后报道了刺参(Stichopus japonicus)[21]、中华鳖[9]、南美白对虾(Penaeus vannamei)[22]、锦鲤(Cryprinus carpio)[23]、罗非鱼(Oreochromis niloticus)[24]等水生动物的芽孢杆菌感染[24]。谭爱萍等[9]最早报道了由蜡样芽孢杆菌引起的养殖中华鳖疾病, 发病鳖四肢无力、反应迟钝、身体竖起、摇头而死, 主要发生于5—7月, 可危害幼鳖、成鳖和亲鳖等, 主要危害100 g以上体重鳖, 发病率可达15%—30%, 严重时最高死亡率可达100%。广东分离的蜡样芽孢杆菌JY07和JY09对中华鳖半数致死量为3.39×108CFU/mL。2014年, 陈健舜报道了杭州市由苏云金芽孢杆菌(B.thuringiensis)引起的中华鳖疾病, 分离菌株注射感染健康中华鳖的LD50为1×104.87—105.30CFU/ind.即1×105.87—106.30CFU/mL, 本研究分离的蜡样芽孢杆菌T91-1对健康甲鱼的LD50为4.91×105CFU/ind., 相当于4.91×106CFU/mL, 毒力强度与Chen等[3]报道相似, 而分类鉴定与谭爱萍相同。鉴于蜡样芽孢杆菌群各个种, 系统进化树上十分接近, 为明确分离菌株的分类地位, 本研究对生化性状、16S rDNA和gyrB等进行了综合比较, 最后确定为蜡样芽孢杆菌。同时对发病中华鳖进行了系统的病理分析, 对分离菌株的毒力因子及溶血素BL (hbl)基因进行了分析(待发表资料), 确定了分离菌株的致病性和在本病例中的作用。
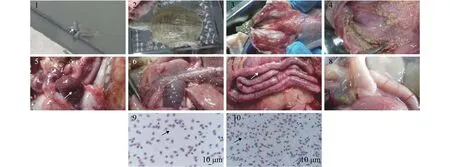
图版Ⅰ 自然发病濒死中华鳖症状PlateⅠ Gross signs of naturally infected Chinese soft-shelled turtles
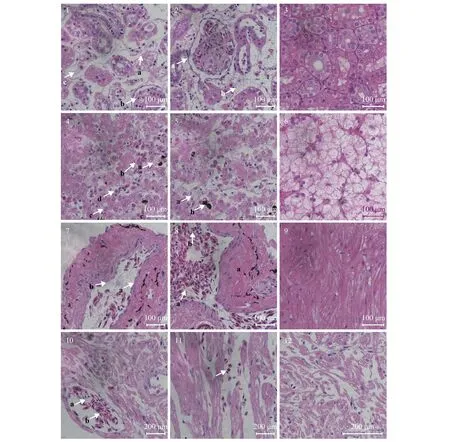
图版Ⅱ 中华鳖组织病理特征PlateⅡ Histopathological characteristics in Chinese soft-shelled turtle
本研究分离的蜡样芽孢杆菌T91-1呈典型的β溶血, 同时含有较高水平的胞外蛋白酶, 但培养上清单独不具有溶血能力。文献报道表明蜡样芽孢杆菌的溶血现象与溶血素BL有关, 该溶血素由L2、L1和B几个不同的溶血组份组成, 通过各组成与红细胞膜单独或协同结合, 造成红细胞破碎[25],该毒素是导致人类食物中毒的重要毒力因子[26]。从T91-1对乳鼠灌胃毒力强于注射感染来看, T91-1对小鼠具有较大的肠毒性, 对人类可能构成潜在的风险。T91-1回归感染健康中华鳖后可使实验鳖排泄物增多, 提示分离菌株对鳖存在较大的肠毒性。需要对分离株非溶血性肠毒素nhe(NHE)[27]和溶血性毒素hbl(HBL)[28—31]开展进一步研究。
值得注意的是, 本次从杭州市中华鳖养殖场分离到的蜡样芽孢杆菌, 该病原可在该场所有发病池分离到, 发病鳖症状相似, 病鳖各脏器、血液及脑部均可分离到单一的芽孢杆菌样纯培养, 同期杭州市其他发病的中华鳖养殖场未分离到优势的芽孢杆菌, 表明该病未在杭州市其他中华鳖养殖场引起流行。分析发病场中华鳖养殖条件, 发现该场养殖密度较高, 水质蓝藻水平极高, 2016年和2017年均发生芽孢杆菌大规模感染。该病原是来源于带毒力基因蜡样芽孢杆菌制剂的不当使用, 还是在养殖环境周边存在较高的蜡样芽孢杆菌背景, 需要进一步跟踪分析。
