草鱼在摄食高能饲料后血清生化指标的动态变化
2019-05-29赵京壮喻丽娟
田 娟 刘 伟 蒋 明 赵京壮 吴 凡 喻丽娟 陆 星 文 华
(1. 中国水产科学研究院长江水产研究所, 农业部淡水生物多样性保护重点实验室, 武汉 430223;2. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070; 3. 长江大学动物科学学院水产系, 荆州 434020)
动物从外界摄取营养物质的第一目的是为了供给生命活动的能量需要, 摄入的部分营养素被用于分解代谢, 以产生能量用于同化作用以及维持生命的其他过程[1]。在现代水产养殖中, 为了满足养殖品种快速生长的需求, 通常会采取在较短时间内给予养殖对象以过高能量的营养策略。蛋白质、碳水化合物和脂质是水产动物三种主要的能量来源, 然而饲料含过高水平的蛋白质、脂肪或碳水化合物均会影响鱼类的摄食和生长, 诱发多种鱼类发生肝脏代谢障碍(俗称“肝胆综合症”、“脂肪肝”等),导致生理状态发生变化影响鱼体的健康[2—5]。
血液是在心脏和血管腔内循环流动的一种极其重要的组织, 在机体里主要起运输营养物质、防御和免疫、维持内环境稳定、参与体液调节等作用, 故血液指标值能反映动物的健康状态[6]。对于鱼类而言, 血液生理生化指标的变动范围较大, 其结果受内源或外源多种因素共同作用的影响, 如年龄、性别、繁殖、食性等内源性因素和饵料、溶氧、温度、养殖方式、疾病等外源性因子等[7,8]。在鱼类营养学研究中, 发现鱼类血液生化指标与机体的摄食、营养状况、饲料组成、饲料源等密切相关[9—15], 但同时发现鱼类血液指标参数并不稳定,难以通过测定血液指标得出准确的实验结论。因此本实验试图测定餐后不同时间点的生化指标, 进行动态监测, 从而更准确地研究饲料组成对血液指标造成的影响。草鱼(Ctenopharyngodon idella)作为我国养殖产量第一的淡水鱼类, 被广泛用于鱼类营养学及营养性疾病学的研究[16—18]。本实验以3组高能纯化饲料及对照组饲料喂养草鱼幼鱼11周, 采取餐后4个时间点的血液样品, 测定8种常见的与糖脂代谢相关的血液指标, 旨在研究高能量饲料对草鱼血清生化指标的影响, 为准确测定鱼类血液指标提供参考。
1 材料与方法
1.1 实验饲料
据报道草鱼幼鱼饲料适宜的蛋白质、脂肪、糖含量分别为30%—35%[19]、6%—7.5%[20]、不超过33%[21], 蛋能比为19.5 mg/kJ[22]。在本实验中, 以酪蛋白和明胶作为蛋白源, 以玉米油和大豆油(质量比1∶1)作为脂肪源, 糊精为糖源, 设计的对照组饲料(CON)中含30%的蛋白质、8%的脂肪、36%的糊精, 以满足草鱼幼鱼在生长和非特异性免疫方面的需求。另外设计了3组高能饲料, 分别是高蛋白组(HP)、高脂肪组(HF)和高碳水化合物组(HC)。3组高能饲料较对照组饲料配方, 含更高的蛋白质、脂肪和碳水化合物, 其总能较对照组提高11%, 具体实验饲料配方和营养成分如表1所示。所有原料经超微粉碎机粉碎后过孔径0.3 mm的网,将粉料充分混匀, 最后加豆油、玉米油和25%的水进行调和, 用模孔直径为2 mm的绞肉机挤压成条状, 置于50℃烘箱中烘干, 然后破碎成长度为3 mm左右的颗粒饲料, 置于-20℃冰柜中冷藏备用。

表1 实验饲料组成和基本分析Tab. 1 Composition and proximate analysis of the experimental diets
1.2 实验鱼与饲养管理
实验用草鱼取自长江水产研究所苗种繁育场。在实验鱼运回后, 用聚维酮碘进行消毒, 然后在循环水养殖系统中暂养2周, 暂养期间以对照组饲料饲喂, 以使其适应实验饲料和实验环境。实验开始前将实验鱼饥饿24h, 选取体质健壮、规格整齐、初始体质量为(55.0±2.5) g的实验鱼320尾, 用80 mg/L水的MS-222麻醉后称重, 养殖于16个封闭式循环水养殖桶中(直径85 cm, 水深70 cm, 水体体积约400 L), 每桶20尾, 将16个桶随机分成4组, 每组设4个重复, 分别饲喂4种实验饲料。根据鱼体生长、摄食和水温等环境状况及时调整投饲量, 确保鱼体抢食并尽量不出现残饵, 每天表观饱食投喂3次(08:30—09:00、12:30—13: 00、17:00—17:30), 投饲率3%—5%。每日记录水温、草鱼摄食行为和死亡数量等, 每天换水1/3。养殖期间室温(12—22)℃,水温(25—28)℃, 溶氧质量浓度大于5 mg/L, pH 6.8—7.3, 氨氮质量浓度小于0.05 mg/L。共计饲养11周。
1.3 样品采集
为避免多次放水捞鱼又补充新水所造成的水温差和多次捕捞操作对试验鱼造成的应激, 影响检测结果, 本试验采样时进行以下操作: 在11周养殖实验结束时, 先将每个养殖桶的试验鱼全部捞出,使用MS-222麻醉后, 从中随机挑选8尾, 平均放入另外4个养殖桶中; 同一处理组的4个养殖桶均进行相同操作; 操作完成后每个养殖桶中养殖8尾鱼, 来自原来同一处理组的4个平行, 即每个平行提供2尾,用于后续4个时间点的取样。将实验鱼禁食48h, 确保水温和鱼体健康状况正常, 从每组的4个养殖桶中随机选取1个桶, 将桶中的8尾实验鱼捞出, 麻醉后置于冰盘上采用尾静脉采血, 此次采样被定义为对照样本(完全饥饿状态)。剩余的养殖桶, 用对应的处理组饲料饱食投喂1次, 然后分别在喂食后的2h、8h和24h三个时间点按上述采样方法各采集血液1次, 将采集的血液样品在4℃静置5h后, 3000 r/min离心15min, 取上清贮存于-80℃冰箱中待检测血清指标。
1.4 测定方法
每一处理组共计取血清8管, 每管取200 μL血清置于比色杯中, 然后按照希森美康全自动生化分析仪(CHEMIX-800)的操作方法进行测定, 所用试剂均购自Sysmex公司。血清甘油三酯(TAG) 、总胆固醇(TCHO) 、高密度脂蛋白胆固醇(HDLC)含量分别采用ADP-HK、COD-POD、CDH-UV法测定, 血清低密度脂蛋白胆固醇(LDLC)含量采用终点法, 葡萄糖(GLU)含量采用己糖激酶法测定, 谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)分别采用门冬氨酸氨基转移酶测试法(MDHUV)、丙氨酸氨基转移酶测试法(LDH-UV)、对硝基苯磷酸(p-NPP)法。
1.5 数据统计与分析
所得实验数据以平均值±标准差(Mean±SD,n=8)表示, 实验结果用SPSS17进行统计与分析, 运用一般线性模型单变量进行双因素分析, 采用Tukey's进行多重比较检验。对采样时间点(T)和不同饲料(D)进行双因素方差分析, 检测了采样时间点(T)和饲料(D)对测定指标的主要影响, 以及它们的交互作用。同一处理组在不同采样时间点的差异用字母“x, y, z”表示, 同一采样时间点不同处理组间的差异用字母“a, b, c, d”表示,P<0.05即认为存在显著性差异, 运用OriginLab 8.0软件进行绘图。
2 结果
2.1 草鱼在摄食高能饲料后血清谷草转氨酶活性的动态变化
如图1所示, 草鱼血清AST活性受到采样时间点和不同饲料的显著影响(P<0.05), 且两者存在交互作用。草鱼AST活性在餐后2h达到峰值, 且在2h时3个高能组AST活性均较对照组显著升高(P<0.05), 而在24h时各实验组AST活性无显著差异(P>0.05)。HC和HF组AST活性随餐后时间延长下降, 且餐后8h和24h较对照和2h差异显著(P<0.05)。HP组在2h时出现最大值, 8h降低到最低值, 24h恢复到初始值。

图1 高能量饲料对草鱼餐后血清谷草转氨酶活性的影响Fig. 1 Effect of high-energy diets on postprandial AST activities in serum of grass carp
2.2 草鱼在摄食高能饲料后血清谷丙转氨酶活性的动态变化
草鱼幼鱼血清谷丙转氨酶的变化如图2所示,采样时间点和不同饲料均显著影响草鱼血清ALT活性(P<0.05), 且两者对其存在交互作用。草鱼ALT活性在餐后24h达到峰值, 且在24h时3个高能组ALT活性较对照组均显著升高(P<0.05)。CON组ALT活性在4个采样时间点无显著差异(P>0.05)。HC和HF组ALT活性随餐后时间延长而升高, 且餐后8h和24h较0和2h差异显著(P<0.05);HP组在24h时出现最大值, 且较其他采样时间点显著升高(P<0.05)。

图2 高能量饲料对草鱼餐后血清谷丙转氨酶活性的影响Fig. 2 Effect of high-energy diets on postprandial ALT activities in serum of grass carp
2.3 草鱼在摄食高能饲料后血清碱性磷酸酶活性的动态变化
如图3所示, 采样时间点和不同饲料均显著影响草鱼血清ALP活性(P<0.05), 且两者对其存在交互作用。4个实验组的草鱼餐后血清ALP在餐后24h达到峰值, 但各组间无显著差异(P>0.05)。在餐后8h, 3个高能组较对照组显著升高(P<0.05)。HC和HP组ALP活性在4个采样时间点无显著差异(P>0.05)。HF实验组在0和2h时无显著差异(P>0.05), 随后开始上升, 在8h时达到峰值, 8h和24h较0和2h显著升高(P<0.05)。CON组0h和24h ALP活性较2h和8h显著升高(P<0.05)。

图3 高能量饲料对草鱼餐后血清碱性磷酸酶活性的影响Fig. 3 Effect of high-energy diets on postprandial ALP activities in serum of grass carp
2.4 草鱼在摄食高能饲料后血清胆固醇含量的动态变化
血清胆固醇含量在各实验组的变化如图4所示, 不同饲料显著影响草鱼血清TCHO含量(P<0.05), 采样时间点对其无显著影响(P>0.05), 但两者对血清TCHO含量存在交互作用。4个处理组的TCHO含量无明显的峰值时间点, CON组和HF血清TCHO含量餐后波动不明显, 4个采样时间点无显著性差异(P>0.05)。HC和HP组变化趋势相同, 0时含量最高, 其他3个时间点较0h显著降低(P<0.05)。在0时, HC组和HP组较CON组和HF组显著升高(P<0.05); 其他3个采样时间点, 4个处理组间无显著差异(P>0.05)。

图4 高能量饲料对草鱼餐后血清胆固醇含量的影响Fig. 4 Effect of high-energy diets on postprandial TCHO contents in serum of grass carp
2.5 草鱼在摄食高能饲料后血清高密度脂蛋白胆固醇含量的动态变化
草鱼幼鱼血清高密度脂蛋白胆固醇的含量变化如图5所示, 采样时间点和不同饲料均显著影响草鱼血清HDLC含量(P<0.05), 且两者对其存在交互作用。血清HDLC含量的变化与CHO相似。CON组和HF组餐后4个时间点无明显变化。HC组和HF组,0时含量显著高于其他3个时间点(P<0.05)。在0h时,HC组和HP组较CON组和HF组显著升高(P<0.05)。

图5 高能量饲料对草鱼餐后血清高密度脂蛋白胆固醇含量的影响Fig. 5 Effect of high-energy diets on postprandial HDLC contents in serum of grass carp
2.6 草鱼在摄食高能饲料后血清低密度脂蛋白胆固醇含量的动态变化

图6 高能量饲料对草鱼餐后血清低密度脂蛋白胆固醇含量的影响Fig. 6 Effect of high-energy diets on postprandial LDLC contents in serum of grass carp
如图6所示, 采样时间点和不同饲料均显著影响草鱼血清LDLC含量(P<0.05), 且两者对其存在交互作用。4个实验组的草鱼餐后血清LDLC含量在餐后24h达到峰值, 24h时HP组较对照组显著降低(P<0.05); 在餐后2h和8h, 4个处理组均较0h显著降低, 且在0h时和8h时3个高能组LDLC含量均较对照组显著升高(P<0.05)。
2.7 草鱼在摄食高能饲料后血清葡萄糖含量的动态变化
如图7所示, 采样时间点和不同饲料均显著影响草鱼血清GLU含量(P<0.05), 且两者对其存在交互作用。草鱼血清GLU含量在餐后2h达到峰值。较对照组, HC组在2h时显著升高, HF组显著降低(P<0.05), HP组无显著差异(P>0.05)。在餐后0h,3个高能组均较对照组显著降低, 而餐后8h和24h均较对照组显著升高(P<0.05)。餐后8h和24h, 4个处理组内的血糖含量趋于稳定, 未出现明显差异(P>0.05)。

图7 高能量饲料对草鱼餐后血清葡萄糖含量的影响Fig. 7 Effect of high-energy diets on postprandial GLU contents in serum of grass carp
2.8 草鱼在摄食高能饲料后血清甘油三酯含量的动态变化
血清甘油三酯含量的变化如图8所示, 采样时间点和不同饲料均显著影响草鱼血清TAG含量(P<0.05), 且两者对其存在交互作用。草鱼血清TAG含量在餐后8h达到峰值。在0h, HP组较对照组显著降低, HC组和HF组显著升高(P<0.05)。在2h和8h时HC和HF组TAG含量均较对照组显著升高(P<0.05), 而HP组无显著差异(P>0.05)。在24h, 4个处理组间无显著差异(P>0.05)。
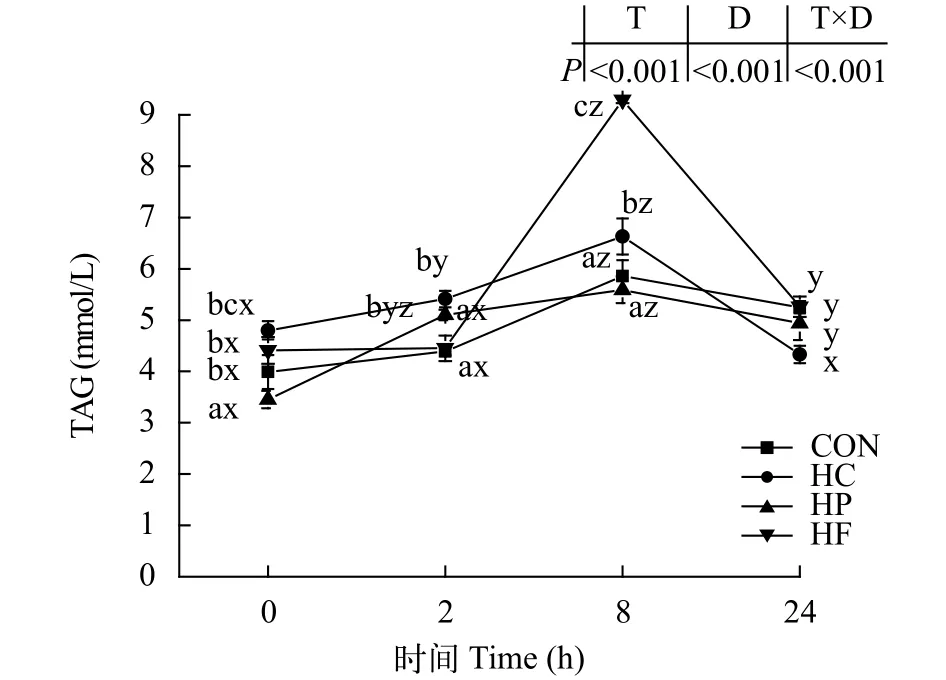
图8 高能量饲料对草鱼餐后血清甘油三酯含量的影响Fig. 8 Effect of high-energy diets on postprandial TAG contents in serum of grass carp
3 讨论
3.1 采样时间点对草鱼血清生化指标的影响
鱼类血液指标被广泛运用于评价鱼体健康和营养状况。在本实验中, 摄食不同饲料的草鱼幼鱼在禁食48h后, 再重新摄食相应饲料, 除血清TCHO外, 血清AST、ALT和ALP活性, 以及血清HDLC、LDLC、GLU和TAG含量均受到采样时间点即餐后时间的显著影响, 且餐后时间与饲料存在交互作用;草鱼血糖和血清AST活性均在餐后2h达到峰值, 血清ALT和ALP活性以及LDLC含量均在餐后24h达到峰值, 血清TAG含量在餐后8h达到峰值, 而血清TCHO和HDLC含量则无明显峰值。在对大菱鲆(Psetta maxima)[24]和虹鳟(Oncorhynchus mykiss)[25]的研究中均发现, 血浆氨基酸含量与采样时间显著相关。奥尼罗非鱼(Oreochromis niloticus×O.aureus)血浆AST和ALT活性同样受到采样时间点的影响[26]。在吉富罗非鱼(GIFT,Oreochromis niloticus)、卵形鲳鲹(Trachinotus ovatus)、军曹鱼(Rachycentron canadum)中均发现, 鱼类血糖在餐后1—3h达到峰值, 且高糖组的血糖含量较低糖组显著升高[12]。在饲喂罗非鱼中、高脂肪水平饲料后, 血糖峰值出现在6h, 血清TAG峰值出现在餐后12h, 而TCHO的峰值受到饲料脂肪水平的影响[27]; 在另一个对罗非鱼的研究中发现, 在注射葡萄糖后血浆TAG水平快速上升, 在3h后达到峰值[12]。这些结果均表明鱼类摄食后, 营养物质在体内进行吸收、消化、代谢后,部分血液生化指标会迅速升高, 达到某个峰值, 然后下降; 峰值的高低与饲料组成有关, 也暗示部分血液指标随采样时间点的不同出现动态变化, 且餐后时间与饲料存在交互作用, 这提示研究者在进行鱼类血液指标检测时, 需要保证不同处理组的采样时间同步性, 即均在餐后同一时间点采样, 否则将因采样时间点的不同出现假阳性差异。
3.2 高能量饲料对草鱼血清生化指标的影响
在已有的对鱼类血液学的研究报道中, 通常检测饥饿24h的鱼体血液生化指标, 因此为了所讨论的结果具有可比性, 此部分仅讨论本研究的24h实验结果。血清AST和ALT活性是反应肝功能的灵敏指标[28]。在本实验中, 3个高能组ALT活性显著高于对照组, 而AST活性在餐后24h, 4个处理组间无显著差异。郭小泽等在草鱼上研究发现摄食高脂饲料(饲料脂肪含量8.2%)后, 血清AST和ALT活性较对照组(饲料脂肪含量3.1%)无显著差异[10]; 而汪开毓等[29]研究发现高脂组(饲料脂肪含量8.1%)草鱼血清中AST、ALT活性极显著高于对照组(饲料脂肪含量4.6%), 罗非鱼中亦得到类似结果[11]; 在罗非鱼幼鱼上亦发现血清中AST和ALT活性随饲料碳水化合物水平的升高而升高(饲料能量随碳水化合物水平的升高而升高)[30,31], 高糖饲料亦显著提高了草鱼这2种转氨酶活性[10]; 但高蛋白饲料不影响星斑川鲽幼鱼(Platichthys stellatus, Pallas 1788)血浆这2种转氨酶活性[32]。这说明对于不同鱼类高水平的脂肪和碳水化合物可能均会导致血清转氨酶活性的升高, 对草鱼肝功能造成一定损伤, 但损伤程度与饲料配方和养殖对象有关。
ALP活性与机体的营养免疫状态有关, 是体内的一种解毒酶。在正常情况下, 血清中ALP活性较低, 当肝脏或骨骼发生病变时, 血清中ALP酶活性会升高[33]。在本实验中, 餐后24h, 4个处理组的草鱼幼鱼血清ALP活性无显著差异。同样在草鱼上的研究发现高脂饲料不影响血清ALP活性, 但高糖饲料显著提高了ALP活性[10]; 缪凌鸿等[34]在研究中发现高碳水化合物水平饲料对异育银鲫(Carassius auratus gibelio)血浆ALP活性无显著影响; 而随着饲料中脂肪含量的增加, 罗非鱼血浆中ALP活性逐渐升高[11]; 高蛋白饲料同样不影响星斑川鲽幼鱼血浆ALP活性[32]。这些结果的差异, 可能与机体的免疫状态有关, 需要通过测免疫指标进一步阐述其机理。
葡萄糖为机体各组织行使生理功能提供能源,鱼类血糖浓度受到饮食、应激、气候、药物等的影响, 并受神经、内分泌激素等调节[7]。同时鱼类对糖的耐受性较差, 在摄食后, 会迅速出现高血糖现象。在本实验中, 餐后2h血糖浓度达到峰值。餐后24h, 3个高能组的血糖含量显著高于对照组。研究者报道高碳水化合物饲料会导致罗非鱼、卵形鲳鲹、军曹鱼、翘嘴红鲌(Erythroculter ilishaeformisBleeker)、南方鲇幼鱼(Silurus meridionalisChen)和厚唇弱棘䱨(Hephaestus fuliginosus)等血糖浓度升高[12,35—37]。高脂饲料亦会导致罗非鱼[38]、黄姑鱼(Nibea albifloraRichardson)[39]血糖浓度升高。这些结果说明鱼类血糖浓度的升高可能是为了快速代谢所摄入的过多糖或脂肪。
鱼类血脂(包括TAG、TCHO、HDLC和LDLC等)水平的变化与机体的新陈代谢、生理状况密切相关, 被广泛地用来评价鱼体的脂肪代谢能力。在本实验中, 餐后24h, 血清TAG、TCHO和HDLC含量4个处理组间均无显著差异, 仅HP组血清LDLC含量较对照组显著降低。郭小泽等[10]发现高糖和高脂饲料均会显著提高血清TAG和TCHO含量; 汪开毓等[29]研究发现高脂组草鱼血清TAG和TCHO的含量均显著高于低脂组。同时在长期摄食高糖或者高脂饲料后, 罗非鱼餐后24h血清TAG和TCHO含量均较对照组显著升高[12,27,31]。前人的研究报告, 总体上得出高糖或高脂饲料会提高鱼体血液中TAG和TCHO含量, 这些结果与本实验在24h的结果存在差异, 但TAG结果与本实验在8h的结果一致。本文认为这可能与鱼类本身的消化吸收能力和代谢速率有关, 草鱼的肠道排空时间为12h[40], 罗非鱼为18h[41], 而大部分肉食性或杂食性鱼类的胃肠排空时间超过24h, 如大西洋鲑(Salmo salarL.)餐后24h肠道仍然存在少量内容物,餐后48h才开始消化完毕[42], 虹鳟为28—29h[43]。这也进一步说明在进行鱼类血液生化指标分析时, 需要考虑水产动物的血液指标受到多种因素的影响,其在发生动态变化, 因此, 为了得出更准确的结论,一方面需要用其他指标对血液生化指标所得出的结论进一步进行验证, 另一方面应考虑不同鱼本身的代谢特性。
4 结论
草鱼血清生化指标受到餐后采样时间点和饲料的显著影响, 为确保实验结果的准确性, 需要保证不同处理组的采样时间同步性, 即均在餐后同一时间点采样, 同时需要用其他指标对血液生化指标所得出的结论进一步进行验证。
