基于选区激光熔融技术制备的多孔钛合金支架的力学性能及成骨能力评价*
2019-05-28孙允龙康红磊林坷升关邯峰刘洁李锋
孙允龙 康红磊 林坷升 关邯峰 刘洁 李锋*
自20 世纪50 年代起,各类骨科植入物的成功应用揭开了骨科疾病终末期治疗的新篇章,以Ti6-Al4-V 为代表的钛合金由于具有高耐腐蚀性及良好的生物相容性成为制备骨科植入物最常用的材料。经过长期的临床随访,人们发现将钛合金植入物应用于承重部位时常出现植入物的无菌性松动和植入物周围骨折。这主要是因为Ti6-Al4-V 的机械性能显著超越骨组织,植入物周围的骨质因应力遮挡效应而发生再吸收[1-2]。解决这个问题的首要方法是降低材料的弹性模量,与研发新材料相比,改变原材料的空间结构是一种简便易行的手段。开放的多孔材料不仅可以获得较低的相对密度,有利于植入物的轻量化,而且可以增加植入物的表面积,有利于血管生成和骨组织长入,促进宿主骨与植入物间的生物融合进程[3]。天然骨是一种复杂的多孔结构,它由外层致密紧实的骨皮质(孔隙率较低,5%~10%)和内层疏松多孔的骨松质(孔隙率较高,50%~90%)构成,了解这种复合多孔材料的机械性能对于新植入物的开发是必要的,理想的骨科植入物也应由类似的复合多孔材料组成[4]。现如今,人们已经可以通过增材制造(additive manufacturing,AM)技术制备复杂的多孔结构。相关研究也表明,AM 技术制备的多孔钛合金支架拥有令人满意的力学性能及骨整合能力,但此类研究的对象往往围绕均一多孔结构展开,主要研究不同孔径及不同孔隙率的多孔钛合金支架在力学性能及骨整合能力间的差异[5]。针对复合多孔结构的力学性能及骨整合能力的研究仍处于起步阶段。因此,本文通过将复合多孔结构、均一多孔结构及传统锻件进行对比,分别对其力学性能及成骨能力展开评价,为未来的植入物设计提供参考。
1 材料与方法
1.1 均一、复合多孔钛合金支架的设计及制备
在CAD 软件中构建直径为10 mm,高度为4 mm 的圆柱体模型,并以菱形正二面体为基本结构单元,赋予圆柱体两种不同的多孔结构。均一多孔组(简称均一组):结构单元尺寸为2 mm,梁柱直径为400 m 的均一多孔结构;复合多孔组(简称复合组):在均一组的基础上再复合结构单元尺寸为4 mm,梁柱直径为800 m 的均一多孔结构。每组多孔结构的孔径由微孔的内接球直径确定(见图1A)。利用选区激光熔融(selective laser melting,SLM)技术制备上述两组多孔钛合金支架,所用钛合金粉末(Ti6-Al4-V)平均粒径为70 m,激光功率为140 W,扫描速度为300 mm/s,扫描间距为60 m,层厚为35 m。选用同规格的锻造Ti6-Al4-V 试样作为对照组。
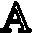
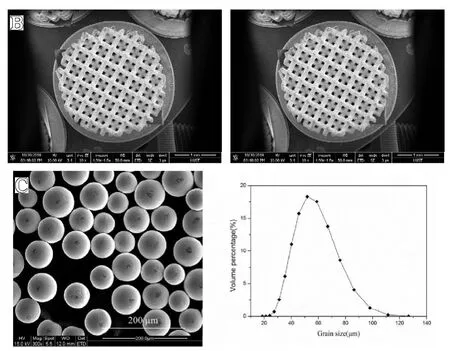
图1 多孔钛合金支架的设计思路:A.均一、复合多孔结构设计思路;B.电镜照片;C.Ti6-Al4-V 粉末的微观结构及粉末的粒径分布图
1.2 力学性能测试
利用万能试验机(AGS-X,岛津,日本)评价上述两种多孔Ti6-Al4-V 合金支架的弹性模量及抗压强度。针对直径10 mm、高4 mm 的圆柱形试样以1 mm/min 的速度进行压缩试验,多孔钛合金支架的弹性模量由应力-应变曲线的线性区域确定。测量每组中的3 个样本以获得机械参数的平均值。
1.3 体外细胞相容性评价
1.3.1 体外细胞培养
利用兔来源的骨髓间充质干细胞(rabbit-derived bonemarrow mesenchymalstemcells RBMSCs,Cyagen,美国)测试两组支架的细胞黏附及促细胞增殖能力,实验共重复3 次,每组材料每次实验中使用3 个样品。将RBMSCs 培养在有含有10%FBS(Hyclone,美国)和双抗(链霉素100 g/mL,青霉素100U/mL;Hyclone,美国)的-MEM(GIBCO,美国)培养基中,在37℃,5%CO2的环境中每2d 更换生长培养基。
1.3.2 细胞黏附实验及增殖实验
两组支架每组取3 个样品放入24 孔板中,按1×105个细胞/孔接种RBMSCs,在37℃,5%CO2的生长培养基中分别培养1 h、2 h、3 h。在评估之前,将样品转移至新的24孔板中,用细胞计数试剂盒(CCK-8)(博士德,中国)评估活细胞数,使用ELX800 吸光度酶标仪(Bio-Tek,美国)在450 nm 处测量吸光度(OD);每组取3 个样品放入24 孔板中,按1×104个细胞/孔接种RBMSCs,在37℃,5%CO2的生长培养基中分别培养1 d、3 d、5 d、7 d,用同样的方法测量吸光度[6]。
1.3.3 扫描电子显微镜观察细胞形态
将支架置于24 孔板中并按每孔1×104个细胞接种RBMSCs,然后在37℃,5%CO2的环境中培养6 h。小心地除去生长培养基后,将支架用磷酸盐缓冲溶液(PBS)洗涤3 次,加入2.5%戊二醛溶液,4℃环境中避光过夜,然后在梯度浓度乙醇溶液中脱水(30%、50%、75%、90%和100%),每个梯度持续15 min,低温干燥后喷金。
1.3.4 成骨分化评估
将支架置于 24 孔板中并按1×104个细胞/孔接种RBMSCs,在37℃,5%CO2环境中培养7 d。细胞接种3 d后,弃去生长培养基并更换成骨诱导培养基(HUXMA-90021,Cyagen,美国),每2 d 更换培养基。碱性磷酸酶(ALP)是成骨细胞分化的标志。成骨诱导7 d 后使用ALP 活性检测试剂盒(P0321,碧云天,中国)检测每组的ALP 活性。
1.4 体内植入实验
所有的实验均严格按照动物实验要求进行,且得到华中科技大学同济医学院附属同济医院伦理委员会的批准。
1.4.1 植入物制备
两组多孔钛合金支架分别制成直径4 mm,长度40 mm的圆柱体植入物,选取同规格的锻造Ti6-Al4-V 植入物作为对照组。高温高压消毒后备用(见图2A)。
1.4.2 实验动物
健康新西兰大白兔24 只,由华中科技大学同济医学院附属同济医院动物中心提供,非孕、哺乳期,平均体重(2.8±0.3)kg。实验动物分组:均一组(n=8,双侧股骨髁植入均一多孔植入物);复合组(n=8,双侧股骨髁植入复合多孔植入物);对照组(n=8,双侧股骨髁植入锻造Ti6-Al4-V 植入物)。所有实验动物在手术前至少适应2 周。
1.4.3 动物手术
戊巴比妥钠(3%,1 mL/kg)经耳缘静脉注射用于麻醉的初始化和维持。将新西兰大白兔膝关节处毛发剃除,然后用乙醇(75%)消毒。经髌骨内侧入路暴露股骨髁间窝,用磨钻在生理盐水冷却下沿着股骨长轴磨穿髁间窝处骨皮质,将植入物插入其指定位置后缝合组织及皮肤。术后3 d 碘伏消毒切口并应用青霉素预防感染(见图2B)[7]。
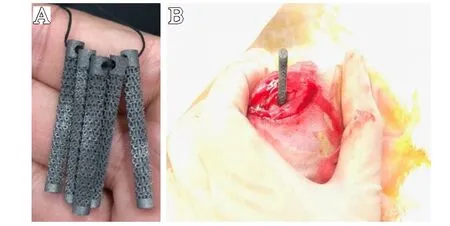
图2 A.植入物外观(以均一组为例);B.手术示意图
1.4.4 Micro-CT 检查
术后2 周复查X 线片明确植入物位置并于术后3 个月时通过空气栓塞处死动物,将双侧股骨取下固定于福尔马林溶液中。高分辨率Micro-CT(Scanco Viva CT 40,瑞士)用于分析骨长入情况。按照30 m 的分辨率对股骨远端进行扫描并进行重建。在相同的阈值下分析骨体积分数(bone volume/tissue volume,BV/TV)[8]。
1.5 统计学方法
采用SPSS 19.0 软件进行统计学分析。数据表示为平均值±标准差。利用独立样本t 检验及单因素方差分析进行数据比较,当P<0.05 时为差异具有统计学意义。
2 结果
2.1 多孔钛合金支架的外观及力学性能
利用扫描电镜(SEM)观察Ti6-Al4-V 支架的空间结构并进行能谱分析,图1B 显示SLM 成形后的Ti6-Al4-V 支架外观符合设计预期。能谱分析显示SLM 制备的Ti6-Al4-V支架具有明显的Ti、Al 和V 峰,未见其他元素峰,表明在制造过程中没有发生污染。Ti、Al、V 元素的重量百分比与标准Ti6-Al4-V 合金相接近(见图3)。机械性能评价,均一组多孔钛合金支架与复合组相比较,屈服强度从115.2 MPa降低到75.9 MPa(P<0.05),平均弹性模量从3.5 GPa 降低到2.1 GPa(P<0.05),具体数据如表1 所示。总的来说,本研究制备的两组多孔钛合金支架的弹性模量都与人体骨组织接近。
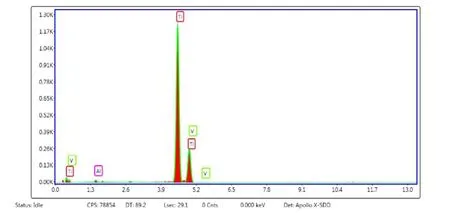
图3 多孔Ti6-Al4-V 支架能谱分析
2.2 体外细胞黏附、增殖情况、形态学和成骨分化评估
每个观察时间点多孔钛合金支架的细胞黏附情况如图所示(图4A),随着时间的推移,均一组与复合组间细胞黏附数量并无显著差异,表明细胞迁移能力在短时间内不受孔径的影响。随着时间的推移,细胞数量增加(见图4B),统计学分析表明,多孔钛合金支架的细胞活性在第1 d 和第3 d没有显著差异,自第5 d 起,复合组多孔钛合金支架的细胞数量多于均一组(P<0.05)。因此,可以推断SLM 制备的多孔Ti6-Al4-V 合金支架具有良好的细胞相容性。利用电镜观察培养6 h 后支架上RBMSCs 的形态,细胞主要位于梁柱的间隙。细胞形态变平并扩散良好,具有许多丝状伪足延伸(见图4C)。第7 d,各组均检测到ALP 活性,复合组多孔钛合金支架优于均一组。14 d 时,两组支架的ALP 活性差异无统计学意义(见图4D)。
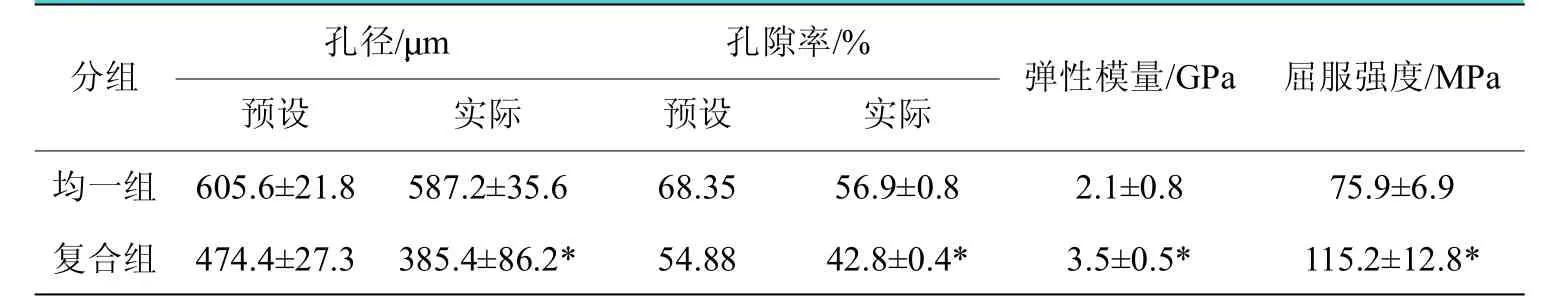
表1 多孔Ti6-Al4-V 支架的力学性能
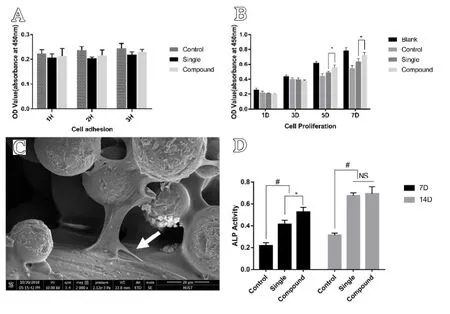
图4 体外细胞黏附、增殖情况,形态学和成骨分化评估:A.细胞黏附情况;B.细胞增殖情况;C.SEM观测多孔钛合金支架中RBMSCs形态;D.ALP 活性情况。*表示均一组与复合组相比,差异具有统计学意义(P<0.05);#表示对照组与其他两组相比,差异具有统计学意义(P<0.01)
2.3 体内植入实验结果
术后所有的动物都恢复良好,整个实验过程中未发生植入物移位和切口感染。植入物周围未观察到不良反应。三维重建图像提示多孔钛合金支架周围有新生骨组织形成,且与宿主骨紧密结合(见图5A、图5B、图5C)。均一组与复合组骨体积分数间比较,差异无统计学意义(P>0.05),但均优于对照组(P<0.01)(见图5D)。
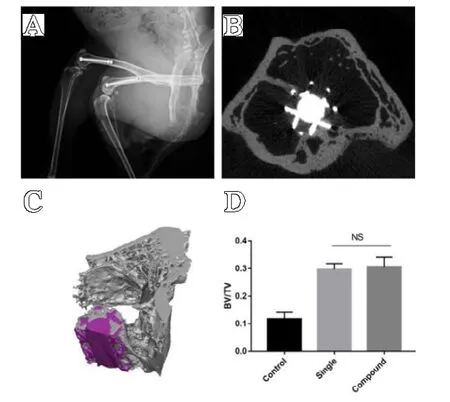

图5 体内植入实验结果:A.术后2 周复查情况;B.术后3 个月Micro-CT 扫描图像,可见宿主骨与植入物间紧密结合;C.三维重建效果,可见植入物周围有新生骨形成;D.两种钛合金支架骨体积分数比较,两组间比较差异无统计学意义;E-G.分别为对照组、均一组、复合组骨长入情况。#表示对照组与其他两组相比,差异具有统计学意义(P<0.01)
3 讨论
近年来,骨组织工程的发展强调需要进行空间结构的设计,以便于骨组织与多孔钛合金支架进行骨整合[9]。相关研究认为单元类型、孔径和孔隙率等关键参数对多孔钛合金支架的力学性能起到决定性作用[10]。为了优化植入物和组织工程支架的设计,必须针对不同孔隙结构的多孔钛合金支架的机械和生物效能进行研究。随着增材制造技术的不断发展,传统制造过程中支架参数无法精确掌握的技术难题得以攻克,科研人员可以通过计算机辅助设计(CAD)技术进行支架的模型构建,并利用SLM 技术得到工艺参数高度可控的多孔钛合金支架[11]。Kaplan 等[3]通过研究证明,孔隙率和孔隙直径不仅影响支架的机械性能,还可影响骨长入,多孔支架的孔隙率大于40%,孔径大于300 m 可实现令人满意的血管形成和骨长入。在这里,笔者设计的两种多孔钛合金支架均满足上述要求。通过力学实验测试,两种钛合金支架的机械性能与天然骨相接近,且远低于锻造钛合金件(115 GPa),这有助于减轻应力遮挡效应[12]。本研究通过布尔运算将两种均一孔隙结构合成一种新的复合孔隙结构,且两种均一孔隙结构均是基于同一种结构单元生成的,彼此间在结构单元尺寸上呈现倍数关系,这使得在新生成的复合孔隙结构中构成不同孔径的粗细梁柱间的自然过渡,避免应力集中现象。体外的细胞实验证明两种钛合金支架的生物相容性良好,且细胞增殖实验提示5 d 起复合孔隙组细胞数量多于均一孔隙组,造成这种现象是因为相比于均一孔隙组,复合孔隙组拥有更小的孔径,这使得复合孔隙组钛合金支架具有较低的渗透性。低渗透性使细胞悬液在通过钛合金支架时遇到更大的阻力,使细胞有更多机会黏附在支架上[13]。ALP活性被评估为成骨细胞分化的早期标志物[14],在成骨诱导的7 d,复合孔隙组材料的ALP 活性显著高于均一孔隙组,但在14 d 时两组孔隙材料间并无差异,Wieding J 等[15]指出细胞分化是由于机械生物刺激引起的,复合孔隙组的孔隙率及孔隙直径均低于均一孔隙组,这表明有较多的细胞黏附于支架表面,这将使细胞接受更多的生物刺激并分化成成骨细胞。但随着时间的推移,增殖的细胞会使孔隙封闭,内部细胞因得不到充足的营养物质而影响分化,这可能是导致成骨诱导14 d 时两组支架的ALP 活性无明显差异的原因。作为一种理想骨科植入物的空间结构,骨与植入物间的结合强度对于稳定性及植入物的长期使用至关重要。通过将上述两种结构制备的植入体植入新西兰兔股骨内,借助CT 均可观察到多孔结构内的内向骨长入,新生骨按照多孔钛合金支架的几何结构进行分布,这与文献报道的结果相一致[6]。两组结构的骨体积分数间未见明显差异,推测可能与较大的时间跨度有关,在后期的实验中将缩小时间跨度,以期得到骨体积分数的动态变化情况。综上,笔者在先前的研究基础上通过将两种均一孔隙复合的方式生成了新的孔隙结构,新的复合孔隙多孔结构同样具有令人满意的力学性能和骨整合能力,为新型骨科植入物的设计提供参考。
