酸性电解水对肉源性荧光假单胞菌的致死效应
2019-05-28蔡林林胡海静衣晓坤王虎虎徐幸莲彭斌
蔡林林,胡海静,衣晓坤,王虎虎,徐幸莲,彭斌
(1南京农业大学江苏省肉类生产与加工质量安全控制协同创新中心,南京 210095;2山东省烟台市东方海洋科技股份有限公司,山东烟台 246000;3新疆农业大学动物医学学院,乌鲁木齐 830052)
0 引言
【研究意义】随着经济的发展和人民生活水平的日益提高,食品安全问题也越来越受重视,而微生物引起的腐败变质是影响食品安全的最主要因素。荧光假单胞菌(Pseudomonas fluorescens)是属于假单胞菌属(Pseudomonas)的嗜冷微生物,它具有极强的腐败潜能[1-2],可在低温环境下生长繁殖。冷藏的高蛋白类和脂类丰富的食品一旦污染荧光假单胞菌,荧光假单胞菌便会大量繁殖,逐渐演变为优势菌群,导致食品腐败[3-4]。同时,随着制冷设备的普及,冷藏食品在人类的饮食构成中占据了极大的比例,嗜冷的荧光假单胞菌对于人类而言便是一种潜在的威胁。目前已在猪肉[5]、牛肉[6]和鸡肉[7]等冷藏肉制品中检测到了大量的假单胞菌污染,严重影响产品货架期。因此做好肉源性荧光假单胞菌的防范与控制对保障食品卫生与安全具有重要意义。【前人研究进展】目前对加工车间及肉制品胴体表面等采用的消毒防控手段主要通过次氯酸钠等化学消毒剂来进行,尤其是在中国,多数采用100—200 mg·L-1高浓度次氯酸钠清洗5—10 min[8]。有研究报道高浓度次氯酸钠可有效降低多种肉源性致病菌和包括假单胞菌在内的腐败菌的活菌数[9-12],但是在经次氯酸钠消毒过后,其洁净区和胴体等仍然有大量假单胞菌检出[13-14]。此外,最近研究发现次氯酸钠存在毒副作用,其与食品中的有机质反应可产生有害的含氯消毒副产物[15],已不能满足环保和高效杀菌的需要。酸性电解水是指含电解质的水溶液(生产实践中常为氯化钠)在电场作用下,消耗微量电能电解而成的具有杀菌功效的功能水,具有储藏稳定性好、杀菌范围广、制取方便、价格低廉等应用优势,室温暴露时的不稳定、短寿和低浓度的活性氯会在高效的杀菌处理后很快还原为普通水,因而绿色安全,近年来已广泛应用于食品消毒、医疗卫生和农业保鲜等领域[16]。目前酸性电解水杀菌效果的研究主要还是集中于对食品和加工接触表面的食源性致病菌大肠杆菌[17-18]、单增李斯特菌、沙门氏菌[19-20]、金黄色葡萄球菌[21-22]、副溶血性弧菌[23]以及菌落总数的作用效果[24-25]。【本研究切入点】虽有较多酸性电解水杀菌的研究报道,但是酸性电解水对肉源性腐败菌假单胞菌的杀菌效果及假单胞菌的耐受响应尚不清楚。【拟解决的关键问题】本试验以典型腐败菌肉源性荧光假单胞菌为作用对象,从细胞水平上研究酸性电解水对肉源性荧光假单胞菌的抑制作用,为酸性电解水在食品中的应用及新型杀菌剂的研发提供一定的理论支持,为腐败菌的控制措施提供新的思路。
1 材料与方法
试验于2018年3—6月在南京农业大学国家肉品质量安全控制工程技术研究中心和生命科学实验中心进行。
1.1 材料与试剂
荧光假单胞菌由笔者实验室分离自腐败鸡肉,且在前期研究中发现该菌在不锈钢表面的粘附性较高,具有较强的交叉污染能力[26];胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)购于青岛海博责任有限公司;LIVE/DEAD®BacLightTM细菌活性检测试剂盒、Baclight Bacterial Membrane Potential Kit细菌膜电位检测试剂盒、Pierce BCA Protein Assay Kit蛋白检测试剂盒和Intracellular pH Calibration Buffer Kit 胞内 pH校准缓冲液试剂盒购于赛默飞世尔科技公司;BacTiter-GloTMMicrobial Cell Viability Assay ATP检测试剂盒购于普洛麦格生物技术(北京)有限公司;BCECF-AM荧光探针购于东仁化学科技(上海)有限公司;4-羟乙基哌嗪乙磺酸(HEPES)购于北京Coolaber试剂公司。
1.2 仪器与设备
酸性氧化电位水生成器(新宇光,山西);Scan 1200自动影像分析菌落计数仪(Interscience,法国);生物安全柜(Baker,美国);高压灭菌锅(Hirayama,日本);生化培养箱(博讯,上海);BS223S电子天平(赛多利斯,北京);高速冷冻离心机(Beckman,美国);S-3000N扫描电子显微镜(Hitachi,日本);M2e多功能酶标仪(IKA,德国);流式细胞仪(BD,美国);pH计(梅特勒-托利多,上海);便携式有效氯检测仪(Hach,美国)等。
1.3 方法
1.3.1 菌悬液制备 将冻存于-80℃的肉源性荧光假单胞菌采用划线法在TSA平板上活化,随后挑取单菌落接种于6 mL TSB中28℃培养24 h。活化好的肉源性荧光假单胞菌以 0.9%的生理盐水稀释至 104CFU/mL,取1.5 mL接种于150 mL TSB培养基中,置于20℃下培养5 d。培养后的菌液经离心(6 000×g、15 min、4℃)去除上清液,清洗两次后重新悬浮制成约108CFU/mL的菌悬液。
1.3.2 酸性电解水制备 在酸性氧化电位水生成器中加入不同浓度的 NaCl溶液,结合电流调节,制成不同浓度的酸性电解水,随后立即采用便携式有效氯检测仪测定有效氯浓度(ACC),氧化还原电位值(ORP)采用 pH计在转换电极后利用电位测定功能进行测定。所制备电解水的理化特性见表1。

表1 酸性电解水的理化特性Table 1 Physicochemical properties of acidic electrolyzed water
1.3.3 细菌存活数量 将0.5 mL上述制备的菌悬液加入4.5 mL酸性电解水中,充分混匀,分别处理5、10、15、20、25和30 min后,迅速吸取0.5 mL加入到4.5 mL中和剂(含0.8%硫代硫酸钠的PBS缓冲液)中作用 1 min。混合均匀后采用灭菌生理盐水进行梯度稀释。本试验吸取0.5 mL菌液加入4.5 mL 0.9%生理盐水代替酸性电解水作为对照。取100 μL的稀释液涂布于TSA平板上,28℃条件下培养24 h后计数。每组试验重复5次。
1.3.4 菌体微观结构 取1.3.3处理后的菌液,离心(3 000×g、15 min、4℃)去除上清液,使用2.5%的戊二醛固定液悬浮细菌并4℃静置12 h,随后30%、50%、70%、80%和90%梯度酒精脱水。最后使用100%酒精悬浮菌体。对处理好的样品进行喷金,用扫描电子显微镜进行观察、拍照。
1.3.5 细胞膜完整性 取上述菌液1 mL,调整菌浓度为107CFU/mL,将3 µL SYTO9和PI的混合染料加入到菌液中,充分混匀。室温避光孵育15 min,使用流式细胞仪检测荧光强度,其中绿色荧光染料SYTO9的激发波长为480 nm,发射波长为500 nm。红色荧光染料PI的激发波长为490 nm,发射波长为635 nm。每组试验重复3次。
1.3.6 细胞膜电位 取上述菌液1 mL,向菌液中加入 10 µL 30 mmol·L-1的荧光染料 DiOC2(3),充分混匀,室温避光孵育15 min后,立即用流式细胞仪测定荧光强度。每组试验重复3次。
1.3.7 胞内ATP 取上述菌液100 μL加入到黑色酶标板中,随后加入100 μL检测工作液,充分混匀,25℃避光孵育 5 min,使用多功能酶标仪检测化学发光强度。不含有菌悬液的生理盐水为背景空白组,各试验组的化学发光强度均减去背景空白组化学发光强度。每组试验重复3次。
1.3.8 胞内pH 取上述菌液使用HEPES缓冲溶液洗涤菌体两次,菌悬液中加入1 mmol·L-1BCECF-AM荧光染料使其终浓度为3 mmol·L-1,37℃避光孵育30 min,最后用 HEPES缓冲溶液清洗并悬浮菌体。试验设置标准曲线组:分别使用pH为4.0、5.0、6.0、7.0和8.0的标定液,将8 μL尼日利亚菌素和缬胺霉素混合液添加到8 mL的pH标定液中,混匀。菌液离心去上清,以标定液悬浮菌体,37℃避光孵育10 min。将样品及标准曲线组添加于黑色酶标板中,使用多功能酶标仪检测样品的荧光强度,设定激发波长为490 nm,发射波长526 nm,绘制标准曲线并计算样品的胞内pH。每组试验重复3次。
1.3.9 胞外聚合物 取1.3.3处理5 min菌液,生理盐水清洗3次(5 000×g、10 min、4℃),第一次上清液作为松散胞外聚合物(L-EPS),收集沉淀。生理盐水重悬沉淀至浓度为5 mg·mL-1(菌体湿重/生理盐水体积),加入等体积2% EDTA-Na2溶液,混匀后4℃静置3 h,离心取上清(14 000×g、20 min、4℃),0.22 μm滤膜过滤,分子截流量透析袋透析(3 500 Da、4℃、24 h)所得即为紧密胞外聚合物(B-EPS)。L-EPS和B-EPS中蛋白含量测定采用BCA试剂盒,总糖含量测定采用苯酚-硫酸法。以蛋白或总糖浓度(μg·mL-1)/菌体湿重(mg·mL-1)得到最终浓度(μg·mg-1)。每组试验重复3次。
1.3.10 胞外聚合物对酸性电解水理化特性影响 胞外聚合物提取同1.3.7,取B-EPS 0.5 mL加入到4.5 mL电解水中,处理5 min后分别测定酸性电解水有效氯浓度(ACC)、氧化还原电位(ORP)和pH。每组试验重复3次。
1.4 数据分析
结果以平均值±标准差的形式表示,采用 Excel软件进行作图分析,SPSS 13.0软件对数据进行统计分析,对酸性电解水致死效果、膜完整性、膜电位、胞内ATP和胞内pH数据采用Duncan's ANOVA进行多重比较分析,对胞外聚合物含量变化和胞外聚合物对酸性电解水理化特性影响数据进行t检验比较分析。
2 结果
2.1 酸性电解水对肉源性荧光假单胞菌的致死效果
酸性电解水对肉源性荧光假单胞菌具有显著的杀菌效果(P<0.05),20和40 mg·L-1的酸性电解水在5 min达到相同的致死效果,曲线重叠,而在60 mg·L-1的酸性电解水处理5 min后,肉源性荧光假单胞菌活菌数已在检出限之下(图1)。

图1 酸性电解水对肉源性荧光假单胞菌的致死效果Fig. 1 Bactericidal effect of acidic electrolyzed water on meat-borne P. fluorescens
2.2 菌落形态分析
由图2-A可以看出,正常的肉源性荧光假单胞菌保持原有形态,呈杆状,细胞完整,菌体表面饱满光滑、无褶皱。而经酸性电解水处理后(图2-B、C、D),菌体结构遭到破坏,大量细胞表面粗糙,凹凸不平,÷出现褶皱甚至变形,细菌细胞的受损程度随着处理浓度的增加而增大。
2.3 细胞膜完整性的变化
由图3可见,经酸性电解水处理后,肉源性荧光假单胞菌的膜完整性显著降低(P<0.05),经20 mg·L-1的酸性电解水处理的肉源性荧光假单胞菌细胞膜完整的比例仅有2.26%,经40和60 mg·L-1的酸性电解水处理的肉源性荧光假单胞菌细胞膜完整的比例则显著降低至1.87%和1.20%。
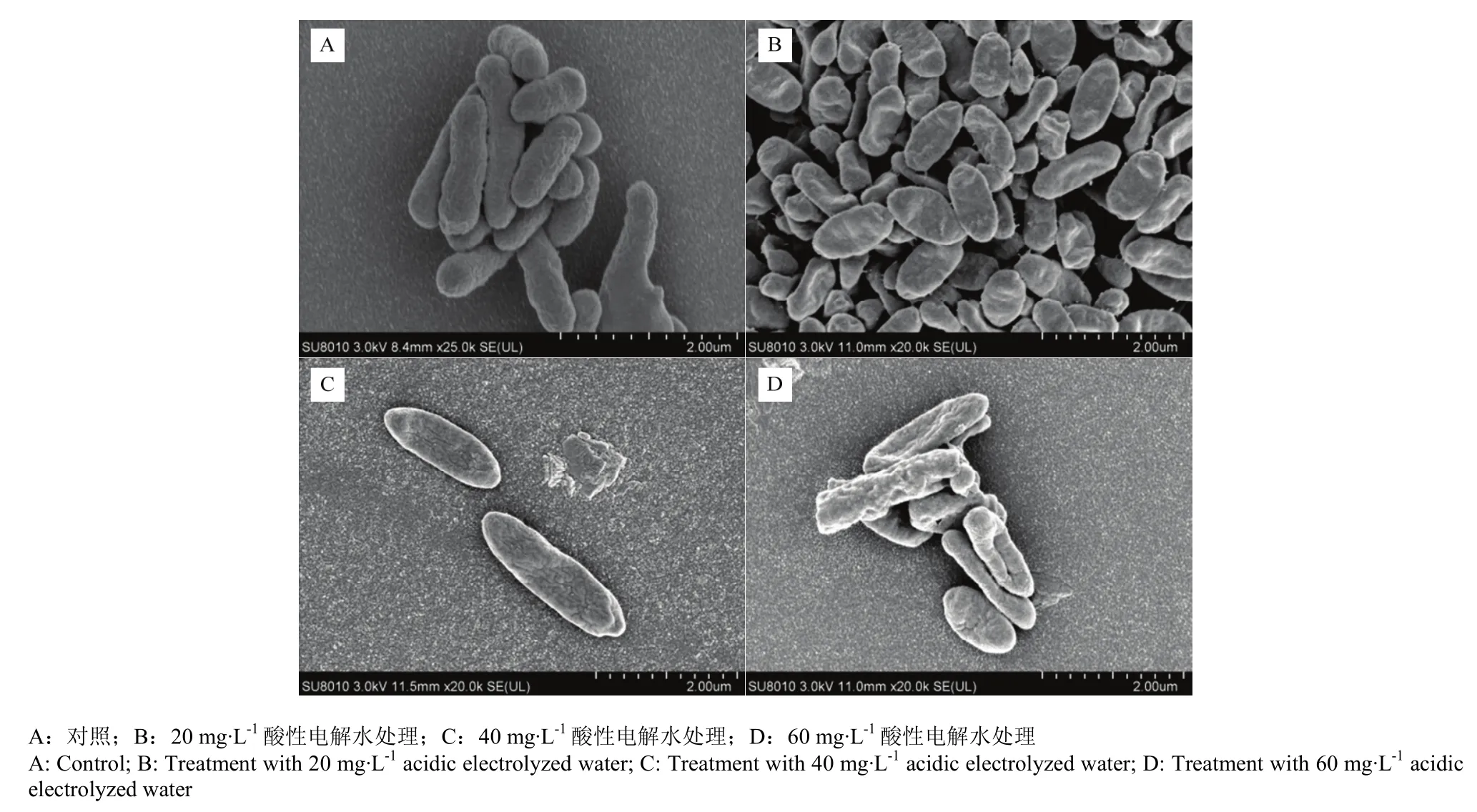
图2 肉源性荧光假单胞菌SEM图Fig. 2 SEM observation of meat-borne P. fluorescens

图3 酸性电解水对肉源性荧光假单胞菌膜完整性的影响Fig. 3 Effect of acidic electrolyzed water on the membrane integrity of meat-borne P. fluorescens
2.4 细胞膜电位的变化
由图 4可见,经酸性电解水处理后,红色荧光/绿色荧光强度呈现下降趋势,说明酸性电解水对细胞膜产生了损害,膜电位消散。相比于对照,20 mg·L-1酸性电解水处理下红/绿荧光比值降低了40%,而随着处理浓度的增加,红/绿荧光比值显著降低,40 mg·L-1和60 mg·L-1酸性电解水红/绿荧光比值均降低到对照的50%以内,酸性电解水浓度越增加,膜电位降低越显著。
2.5 胞内ATP的变化
由图5可见,酸性电解水可显著降低肉源性荧光假单胞菌胞内ATP含量(P<0.05)。5 min内化学发光值急剧下降,40和60 mg·L-1电解水处理对荧光假单胞菌胞内pH的降低无显著影响,无明显改变,验证了酸性电解水对肉源性荧光假单胞菌细胞膜的破坏作用。

图4 酸性电解水对肉源性荧光假单胞菌膜电位的影响Fig. 4 Effect of acidic electrolyzed water on the membrane potential of meat-borne P. fluorescens

图5 酸性电解水对肉源性荧光假单胞菌胞内ATP的影响Fig. 5 Effect of acidic electrolyzed water on the intracellular ATP of meat-borne P. fluorescens
2.6 胞内pH的变化
由图6可见,酸性电解水可显著降低肉源性荧光假单胞菌胞内pH,高浓度酸性电解水的处理导致了胞内pH更显著的降低(P<0.05)。肉源性荧光假单胞菌初始胞内pH为7.5,经20、40和60 mg·L-1酸性电解水处理后,胞内pH分别降低了0.97、1.60和1.67。40和60 mg·L-1电解水处理对肉源性荧光假单胞菌胞内pH的降低无显著影响。

图6 酸性电解水对肉源性荧光假单胞菌胞内pH的影响Fig. 6 Effect of acidic electrolyzed water on the intracellular pH of meat-borne P. fluorescens
2.7 胞外聚合物含量的变化
酸性电解水处理下 EPS主要成分变化如表 2所示。由表中可以看出,酸性电解水处理显著降低了L-EPS和B-EPS中蛋白和总糖含量(P<0.05)。相比对照,L-EPS中蛋白、总糖含量分别降低了71.08%和62.29%,而 B-EPS中蛋白、总糖含量则分别降低了99.32%和40.62%。同时,L-EPS和 B-EPS中蛋白总糖的比值分别降低了23.46%和99.00%。
2.8 胞外聚合物对酸性电解水理化特性影响
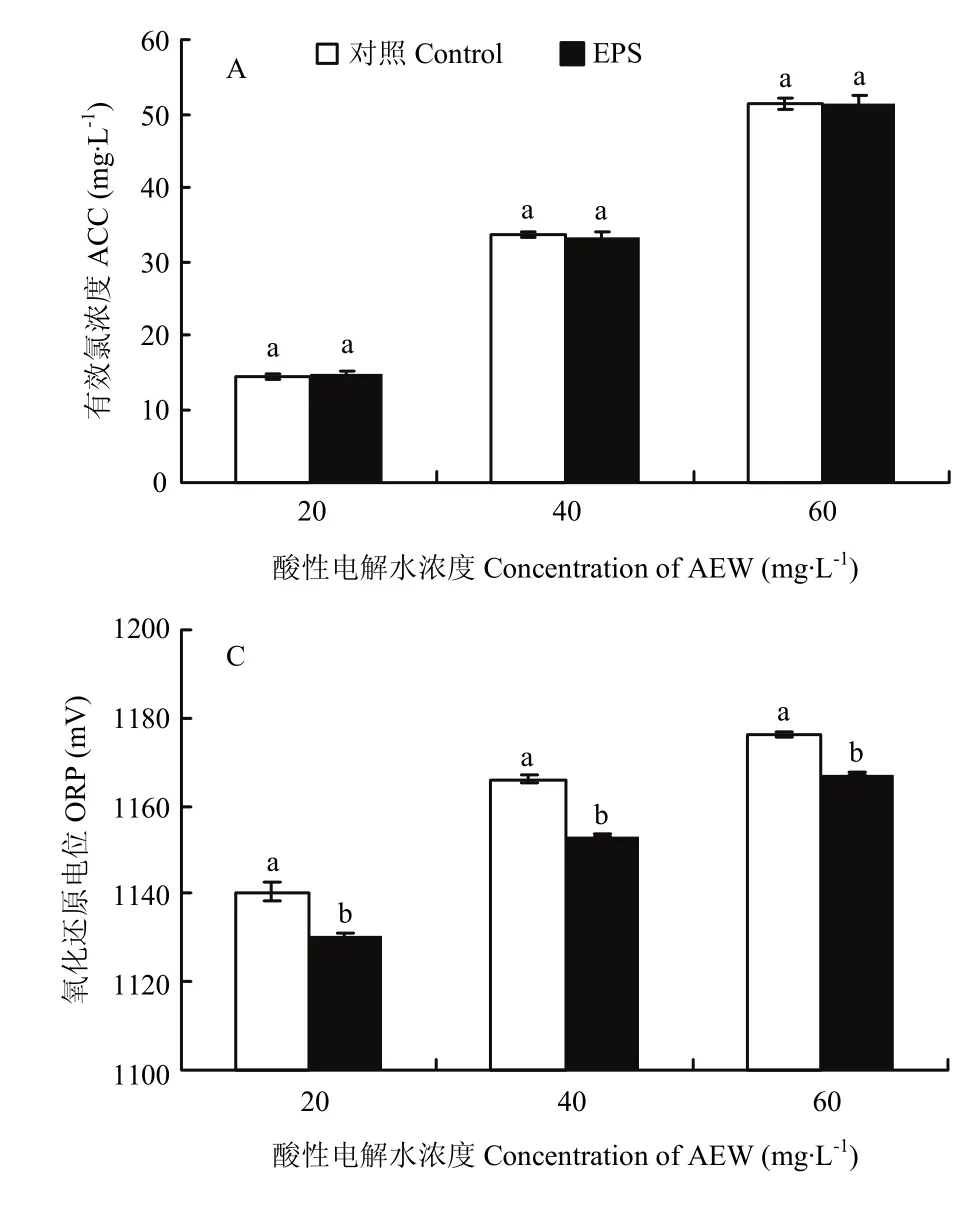
由图7可见,在胞外聚合物的添加下,各浓度酸性电解水ACC基本不变,没有显著影响(P>0.05)。20和40 mg·L-1的酸性电解水相比于对照没有显著差异(P>0.05),而胞外聚合物添加到60 mg·L-1酸性电解水后 pH显著上升。胞外聚合物的添加显著降低各浓度电解水的ORP(P<0.05)。

表2 酸性电解水对肉源性荧光假单胞菌胞外聚合物中蛋白和总糖含量影响Table 2 Effect of acidic electrolyzed water on the protein and carbohydrate content of EPS from meat-borne P. fluorescens
3 讨论
酸性电解水对肉源性荧光假单胞菌具有极强的杀菌效果,3种浓度在5 min内的细菌杀灭对数值均>5,而浓度的增加显著增强杀菌效果,表明酸性电解水是一种有效的杀菌剂。细胞膜的完整性是菌体正常生长代谢的一个主要因素,是细胞内外物质交换的主要屏障和介质,细胞膜不完整的细胞通常不能维持或产生稳定的膜电位,并且胞内结构也暴露于外部环境之下,因此对于外部胁迫表现更为脆弱,通常也可以判断为细胞死亡[27]。研究发现5 min处理下的细胞膜完整性急剧降低,且酸性电解水浓度越高,完整性越低。相似的结果也有报道[28-29],研究发现存在大量的胞内物质泄露的现象,例如离子、蛋白、核酸等,表明细胞膜可能是酸性电解水的作用位点之一。有效氯是酸性电解水中的有效杀菌成分,其中HClO和ClO-发挥不同的作用。HClO由于其电中性及合适的分子大小可以先行透过细胞膜进入到细胞内部进行作用,抑制糖代谢进程,而离子态的ClO-无法直接通过细胞膜,会首先作用于细胞膜上的功能蛋白等成分,进而导致细胞膜运输等功能的退化失效[16],从而影响细胞膜完整性和通透性。细胞膜完整性所对应的细胞死亡程度低于平板计数结果,极少数细胞处于存活但不可计的状态是可能原因。

图 7 肉源性荧光假单胞菌胞外聚合物对酸性电解水有效氯浓度(A)、氧化还原电位(B)和pH(C)的影响Fig. 7 Effect of EPS of meat-borne P. fluorescens on the available chlorine concentration (A), oxidation- reduction potential (B) and pH (C) of acidic electrolyzed water
未经酸性电解水处理的细胞膜两侧外正、内负的状态称为膜的极化状态,此时 Na+与 K+泵关闭。Na+是酸性电解水的主要成分之一,经酸性电解水作用后,Na+泵打开,胞内Na+浓度升高,肉源性荧光假单胞菌的膜电位降低,即表示细胞去极化。除了离子的透膜移动,环境 pH的变化也会引起膜电位的改变[30-31]。酸性电解水处理下细胞从中性环境到酸性环境的改变也会使细胞膜呈现去极化状态。膜电位对大量细胞分裂蛋白的定位具有很重要的作用,而去极化则会导致细胞壁自溶酶的释放进而引起细胞自溶[32]。同时,细胞膜完整性的下降导致了胞内ATP的释放,而Na+和H+等离子的跨膜主动运输也对胞内 ATP产生了大量消耗,从而引起了胞内ATP含量的降低,相似的结果前期[31,33]等也有报道。酸性电解水有效成分的进入可能降低胞内ATP合成速度的降低或加速ATP合成酶的水解,同样也会导致胞内 ATP含量的降低。胞内pH对胞内DNA转录、酶活和蛋白合成等起着很重要的控制作用[34]。由于培养条件和菌种的不同,胞内pH往往在 5.6—9.0。酸化的胞内环境可以极大的提高杀菌剂的效果而导致细胞死亡[31]。研究发现胞内pH的降低与酸性电解水的浓度成正比。酸性电解水较低的pH带来的大量H+流入是胞内pH降低的可能原因,胞内 pH的降低会干扰正常的胞内代谢进程,也会导致细胞对有效氯更为敏感。当面临酸性或碱性外在胁迫时细菌有多种机制来维持质子稳态,例如 H+-ATPase的合成,但是当这些机制或质子泵外排能力被质子进入能力超过时,胞内 pH最终将酸化到某个程度而导致胞内关键进程的瓦解,加速细胞的死亡。
EPS广泛存在于细胞表面,表面吸附性强,可以形成保护层抵御杀菌剂和有毒物质的危害,其渗透阻碍性是细胞对杀菌剂的基础抗性机制之一,因此杀菌剂能否穿透或破坏EPS从而接触到活菌菌体对其杀菌效果具有很重要的影响[35]。EPS中的成分及其含量受菌种和培养环境的影响,相比于前期的一些研究,本研究中肉源性荧光假单胞菌产生的蛋白和总糖含量较高[36-37]。研究发现酸性电解水处理下EPS产生了一定的消耗,其中蛋白含量的降低远高于总糖,表明EPS确实起到了一定的阻碍作用,相比于总糖,蛋白对酸性电解水杀菌效果的降低可能起到更大的作用。需氧微生物生活的环境中ORP通常为200—800 mV[38],酸性电解水的ORP超过1 000 mV,其可改变微生物细胞的电子流,影响物质运输、信息传递,引起细胞表面巯基混合物氧化,干扰胞内细胞代谢通路,从而影响其正常代谢和ATP合成,最终使其死亡。本研究发现EPS可以显著降低酸性电解水的ORP,从而可能对酸性电解水的杀菌效果起削弱作用。EPS未能显著降低酸性电解水的ACC和提高其pH,可能与其较低的添加量有关。
4 结论
酸性电解水可有效控制肉源性荧光假单胞菌,影响其细胞形态,降低细胞膜的完整性、胞内pH和胞内ATP的含量,引起细胞膜去极化。同时,胞外多聚物对酸性电解水具有一定的阻碍作用,削弱其致死效果。
