羊毛/铁配合物非均相芬顿反应光催化剂的制备及其应用性能
2019-05-27崔桂新董永春
崔桂新, 董永春, 王 鹏
(1. 天津工业大学 纺织科学与工程学院, 天津 300387; 2. 中纺院(浙江)技术研究院有限公司,浙江 绍兴 312071; 3. 天津工业大学 先进纺织复合材料重点实验室, 天津 300387)
我国是世界上最大的毛制品生产国和消费国,同时也是废弃羊毛资源大国。一般而言,废弃羊毛主要来源于3个方面:1)不能或难于纺织加工的羊毛,如粗毛、死毛和异质毛等;2)毛纺加工中产生的废弃物和下脚料等;3)废旧纺织品如穿旧的服装、旧地毯和装饰品等。据不完全统计,我国每年家庭废弃和在生产环节产生的边角料等羊毛纺织品合计超过数十万吨[1],但只有少量得到循环再利用,其他都作为垃圾进行了填埋,既给企业带来了沉重负担,又对环境造成很大危害[2],因此,废旧羊毛制品的综合利用成为目前纺织工业可持续发展的重要课题之一。
当前关于废弃羊毛的回收再利用技术主要包括物理技术和化学技术,其中物理回收技术通常是首先将废旧羊毛纺织品通过剥色、开松和梳理等处理得到再生毛纤维,然后再制成毛毡、非织造布和复合材料等[3-5];化学回收技术一般是通过氧化还原反应等将羊毛溶解制得羊毛角蛋白溶液或粉末,然后提纯利用或用于再生纺丝[6-8]。这些回收技术大都存在加工工艺复杂,或需要特殊设备,易导致二次污染等问题。
本文选择直径和鳞片结构不同的3种羊毛模拟不同来源的废弃羊毛,将其分别与Fe3+进行配位反应制备羊毛/铁配合物,考察羊毛纤维直径和鳞片结构对配位反应的影响。然后将其作为非均相芬顿(Fenton)反应光催化剂应用于有机染料降解反应中,重点研究羊毛直径和鳞片结构特性对其催化性能的影响,这不仅为废弃羊毛制品的利用提供新技术,而且可通过以废治废达到资源利用和保护环境的目的。
1 实验部分
1.1 材料与试剂
三氯化铁、过氧化氢(质量分数为30%)、丙酮、盐酸(质量分数为36.5%)和氢氧化钠,均为分析纯,购于天津市科密欧化学试剂有限公司。活性红195为偶氮型染料,其化学结构见文献[9],天津三环化学有限公司。本文选择3种不同直径和鳞片厚度的羊毛分别命名为wool-1、wool-2和wool-3,均为市购。
1.2 实验仪器
S-4800型扫描电子显微镜(日本Hitachi公司);VISTA-MPX型电感耦合等离子体发射光谱仪(美国Varian公司);V-1200型分光光度计(上海美谱达仪器有限公司);SHY-2型旋转水浴恒温振荡器(上海君竺仪器制造有限公司);UV-A型紫外光辐照计和FZ-A型可见光辐照计(北京师范大学光电仪器厂);光化学反应器(专利号:03275610.0),实验室自制。
1.3 实验方法
首先将羊毛分别经蒸馏水和丙酮超声处理,以去除其表面杂质。根据GB/T 14593—2008《山羊绒、绵羊毛及其混合纤维定量分析方法:扫描电镜法》对羊毛进行采样,然后在环境相对湿度低于70%、温度为(20±5 ℃)的条件下,借助扫描电镜观察其形貌,选取约120根纤维,测定并计算其平均直径。此外,根据GB/T 14593—2008测定羊毛的平均鳞片厚度。其中扫描电镜的工作条件为:加速电压5~20 kV,束流小于5.0×1010A。3种不同直径和鳞片厚度的羊毛测试结果如表1所示。
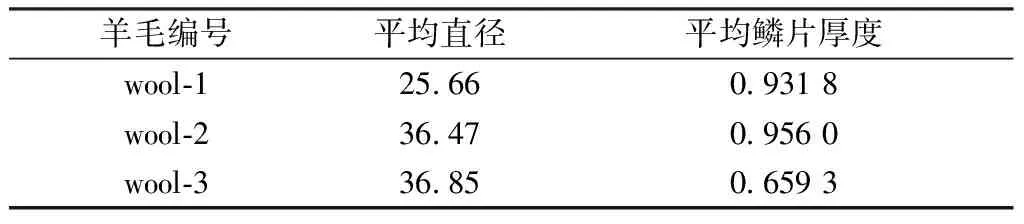
表1 3种羊毛的平均直径和鳞片厚度Tab.1 Average diameter and scale thickness of three wool fibers μm
1.3.1 羊毛/铁配合物制备方法
分别将3种1.0 g羊毛置于100 mL不同浓度的FeCl3水溶液中,在一定温度以及持续搅拌条件下使二者发生配位反应,待反应完成后将其取出并充分水洗。随后在50 ℃真空干燥得到羊毛/铁配合物(wool-Fe)。最后根据文献[9]所述方法计算wool-Fe中的Fe3+配合量(QFe)。
1.3.2 wool-Fe的催化活性测定方法
将3种0.50 g的wool-Fe分别置于100 mL含有浓度为0.05 mmol/L的活性红195和3.0 mmol/L的H2O2混合水溶液中,并调节其pH值。然后将此溶液置于光化学反应器中,在室温和不同辐射光条件下进行染料氧化降解反应。同时根据文献[9]所述方法计算反应过程中染料的脱色率D(%)。
2 结果与讨论
2.1 羊毛/铁配合物的影响因素分析
2.1.1 Fe3+初始浓度的影响
Fe3+初始浓度(CFe,0)对wool-Fe表面QFe的影响如图1所示。

图1 3种羊毛与Fe3+配位反应过程及CFe,0对QFe值的影响Fig.1 Coordination reaction of three wool fibers with Fe3+ and effect of CFe,0 QFe value.(a) wool-1; (b) wool-2; (c) wool-3; (d) Effect of CFe,0 on QFe value
图1(a)~(c)显示,随着反应时间的延长,3种wool-Fe的QFe值显著提高,这意味着在反应过程中更多的Fe3+与羊毛之间发生反应而被固定于羊毛纤维表面。这是因为羊毛是通过二硫键将多种α-氨基酸剩基交联构成天然高分子化合物[10],其中的二硫键、氨基和羧基作为配位基团可与Fe3+、Cu2+等过渡金属离子发生配位反应而形成羊毛金属配合物[11-13]。需要说明的是,相同条件下随着CFe,0值的增大,QFe值逐渐升高,这说明提高反应体系中Fe3+的初始浓度可促进其与羊毛之间配位反应的发生。这主要是因为体系中Fe3+的增多可促进其向羊毛表面扩散,使Fe3+与纤维表面的配位基团接触概率增加,从而使得更多的Fe3+与羊毛发生配位反应。此外,发生配位反应后wool-1和wool-2的QFe值在 60 min 时不再显著变化,意味着其与Fe3+的配位反应在80 min左右即平衡,而wool-3的配位反应达到平衡的时间长达120 min左右。更重要的是,图1(d)显示wool-3-Fe在平衡时的QFe值(QFe-e)明显高于其他2种配合物,这主要与wool-3具有更薄的鳞片层有关。其原因可解释为鳞片由致密的角质细胞构成,对小分子化合物向纤维内部渗透具有抑制作用[14],且鳞片层越厚,这种抑制作用越强,阻碍Fe3+与纤维分子结构中氨基等配位基团的反应,使得Fe3+与羊毛发生配位反应更易达到平衡,因此,Fe3+更易于向具有更薄鳞片层的wool-3内部渗透和反应,较难达到反应平衡,导致更多的Fe3+被固定于纤维表面。
2.1.2 反应温度对配位的影响
分别将1.0 g的3种不同直径和鳞片结构的羊毛浸入不同温度的Fe3+水溶液中进行配位反应,当反应平衡时测定所得3种wool-Fe的QFe值,其结果如图2所示。

图2 反应温度对配合物QFe值的影响Fig.2 Effect of reaction temperature on QFevalue of complexes
从图2可以发现,3种Fe-wool的QFe值随着反应温度的提高几乎呈线性增加,说明升高反应温度有利于配位反应的进行。在配位反应中温度升高会加速Fe3+在水溶液中的不规则运动,使其与羊毛接触机会增加,有利于Fe3+与纤维分子结构中的氨基、羧基以及二硫键等配位基团进行反应。另外,温度升高会使羊毛表面鳞片层发生显著溶胀,从而导致纤维内部更多的配位基团暴露,同时也增加了Fe3+向其内部的移动速率,促进二者之间的反应,使得wool-Fe的QFe值逐渐增大。需要注意的是,在相同温度时,wool-3-Fe表面的QFe值明显高于其他2种配合物。这表明鳞片层较薄的羊毛与Fe3+的配位反应能力更高。此外,尽管wool-1的直径明显细于wool-2,且具有相似的鳞片层厚度,但其相应配合物的QFe值并没有明显提高,这说明羊毛直径对羊毛和Fe3+之间的配位反应性能影响不大。
2.2 羊毛与Fe3+的配位反应模式
一般而言,Fe3+与羊毛之间的配位反应可表现为羊毛对Fe3+的吸附过程。为考察二者之间的配位模式,运用Lagergren准二级吸附动力学方程[15]处理图1(a)~(c)中数据,得到Fe3+配位过程中的动力学参数,结果如表2所示。

表2 不同羊毛与Fe3+配位反应的准二级动力学参数Tab.2 Pseudo second-order adsorption kinetic model parameters for coordination of different wool with Fe3+
从表2可以看出,在不同CFe,0的条件下,准二级吸附动力学方程的R2均高于0.93,这表明Fe3+与 3种羊毛的配位反应过程均可使用准二级动力学方程进行描述,且羊毛对Fe3+的吸附为化学吸附。值得说明的是,在相同CFe,0条件下,wool-1和wool-2具有相近的Qe值,但都显著低于wool-3的Qe值,这证明鳞片厚度仍然是决定羊毛与Fe3+配位反应的主要因素。另外,wool-3的一级反应动力学常数k值也远低于其他2种羊毛,说明其与Fe3+配位反应速度较慢,达到平衡时间会更长,这与上述结论是一致的。
2.3 3种羊毛铁配合物光催化性能的比较
2.3.1 催化作用的判定
将0.50 g的3种羊毛及其铁配合物(QFe值约为0.67 mmol/g)分别浸入100 mL含浓度为 0.05 mmol/L的活性红195和3.0 mmol/L的H2O2混合水溶液中,使染料发生氧化降解反应,反应过程中染料脱色率(D)随时间的变化规律如图3所示。
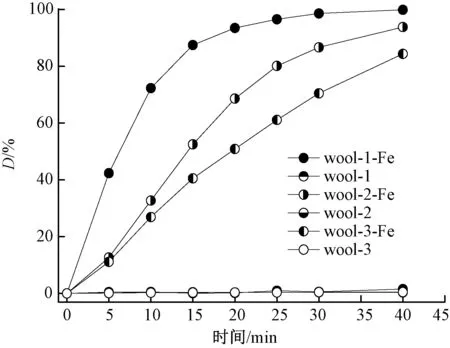
图3 不同wool-Fe存在时染料的脱色率变化Fig.3 Changes in decoloration ratio of dye in presence of different wool-Fe complexes
由图3可知,未经配位反应的3种羊毛 40 min 时染料的脱色率不足3%。这主要归因于羊毛对活性红195的有限吸附作用。而wool-Fe的脱色率均随着氧化反应的进行明显提高,在40 min时其脱色率均超过80%,说明3种wool-Fe均可显著催化染料发生氧化反应。这是因为光辐射条件下wool-Fe能够使吸附于表面的H2O2通过非均相类芬顿(Fenton)反应[12]分解,从而产生大量氢氧自由基(·OH),这些·OH能够攻击水溶液中的染料分子,并能够使吸附于羊毛表面的染料分子发生氧化降解反应,最终转化为水和二氧化碳[12]。另外,光辐射条件下吸附在wool-Fe表面的染料分子被激发而释放电子,而其表面的Fe3+能够接受激发态染料分子释放出的电子,从而转化为Fe2+,加快了Fe3+与Fe2+的循环效应,进一步推动体系中H2O2分解生成更多的·OH,加快染料氧化降解。这个过程可使用反应式(1)~(4)描述[12]。
(1)
(2)
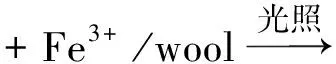
(3)
·OH+染料+(染料)→中间产物→
H2O+CO2
(4)
从图3还可知,在相同反应时间条件下,wool-1-Fe的脱色率最高,说明在染料氧化降解反应过程中,wool-1-Fe比其他2种配合物显示出更加优异的光催化作用,这主要与其具有更细的纤维直径,比表面积较大有关。
2.3.2 配合物QFe值的影响
分别将具有不同QFe值的3种wool-Fe浸入含有H2O2的活性红195水溶液中,进行氧化降解反应,测定反应40 min时染料的脱色率D40,结果如图4 所示。

图4 QFe值与D40值之间的关系Fig.4 Relationship between QFe and D40 values
由图4可知,D40值均随着QFe值的增加而显著升高。当QFe值达到0.5 mol/g时,D40值的增加变得不明显。这表明wool-Fe表面Fe3+的增加能够明显促进其催化作用。这主要归因于Fe3+含量的升高会使得催化剂表面活性位点增加,从而使更多H2O2分子被吸附分解,并产生更多的·OH,导致更多染料降解。值得说明的是,QFe值相同时,直径更细的 wool-1-Fe 表现出更强的催化作用,但当QFe值超过0.5 mol/g后,三者的催化性能较为接近,直径之间的差别对其催化性能的影响变得不显著。
2.3.3 反应体系pH值影响
分别将3种wool-Fe(QFe=0.70 mmol/g)置于具有不同pH值的100 mL浓度为0.05 mmol/L的活性红195和3.0 mmol/L的H2O2混合水溶液中进行氧化降解反应,测定反应40 min时的D40,结果如图5 所示。可知,3种wool-Fe的D40值随pH值的升高而逐渐下降。这说明3种wool-Fe在偏酸性条件下有利于其发挥更加优异的催化作用,而碱性介质会导致其催化性能显著下降。其主要原因是在碱性环境中不利于类Fenton反应的发生,体系中所产生的·OH数量减少[12];另外,碱性环境会导致H2O2分子过快分解,也不利于·OH的产生;而且当pH值升高至碱性时,配合物表面的Fe3+易与水溶液中的OH-生成不溶性沉淀FeOH,导致催化剂失活。值得注意的是,碱性条件下wool-1-Fe、wool-2-Fe和wool-3-Fe的D40值分别为60.98%、33.83%和50.9%,这意味着使用纤维直径越细或鳞片层更薄的羊毛所制备的配合物,具有更好的pH值适应性。

图5 体系pH值对D40值的影响Fig.5 Effect of pH on D40 values
2.3.4 辐射光的影响
分别将3种wool-Fe(QFe=0.70 mmol/g)置于100 mL含有浓度为0.05 mmol/L的活性红195和3.0 mmol/L的H2O2混合水溶液中,通过变换反应器中光源以改变氧化反应体系的光辐射强度,比较在不同辐射光强度条件下三者的催化性能,结果如图6所示。

注:A为可见光(400~1 000 nm)光强度为9.165 mW/cm2,紫外光(365 nm)光强度为0.465 mW/cm2;B为可见光(400~1 000 nm) 光强度为2.785 mW/cm2,紫外光(365 nm)光强度为0.605 mW/cm2。图6 不同辐射光条件下的D40值变化Fig.6 Changes in D40 values under different irradiation
从图6可以发现,3种wool-Fe在暗态时D40值均低于20%,说明三者的催化作用很弱。当体系中引入辐射光时,D40值明显提高并随紫外光强度的提高而进一步升高,这说明wool-Fe的催化性能主要依赖于辐射光。其主要原因是wool-Fe对紫外光以及可见光有较好的吸收性[12],这能够加速类Fenton反应的发生,使得H2O2快速分解并推动纤维表面的Fe3+/Fe2+的转化以产生更多的·OH。除此之外,光辐射也有利于吸附于wool-Fe表面的染料分子被激发而释放电子,从而加快Fe3+与Fe2+的循环转化效应。需要说明的是,3种wool-Fe的催化作用变化趋势并未发生显著变化。
3 结 论
1)具有不同直径和鳞片结构的羊毛都可与水溶液中的Fe3+发生配位反应并形成羊毛/铁配合物。体系中Fe3+浓度的增加以及反应温度的提高均有利于其与羊毛配位反应的进行,获得具有更高铁离子配合量的羊毛/铁配合物。相较于直径,羊毛的鳞片层对其与Fe3+反应影响更显著,具有较薄鳞片层的羊毛更易于与Fe3+反应,制备含有更高铁离子配合量的羊毛/铁配合物。
2)羊毛与Fe3+的配位反应模式符合Lagergren准二级动力学方程,表现为羊毛对Fe3+的化学吸附作用。在相同条件下具有较薄鳞片层的羊毛与Fe3+配位反应速度较慢,达到平衡时间会更长。
3)3种羊毛/铁配合物对染料的氧化降解反应都表现出显著的光催化作用,并且铁离子配合量和辐射光强度的提高均能够增加其光催化性能,促进染料的氧化分解,但碱性环境会导致其光催化性能明显下降。羊毛直径比鳞片层对其与Fe3+所形成配合物的光催化性能影响作用更大,使用直径较细的羊毛所制备的配合物表现出更强的催化作用以及pH值适应性,因此,不同来源的废弃羊毛都可用来制备羊毛/铁配合物光催化剂,用于染料废水的深度净化处理,通过以废治废达到资源利用和保护环境的目的。
