核因子κB信号通路与变应性鼻炎的关系
2019-05-27张小兵
李 丽,张小兵
(1.兰州大学第一临床医学院,兰州 730030;2.兰州大学第一医院耳鼻咽喉头颈外科,兰州 730030)
变应性鼻炎(allergic rhinitis,AR)是发生在鼻腔黏膜的变态反应。目前,AR已成为全球性健康问题,我国患病人数多达4亿,发病率仍呈逐年升高趋势[1]。AR的发病与携带易感基因、免疫失衡、炎性介质释放等因素有关。AR的主要临床特征为鼻痒、打喷嚏、大量清水涕等。2015年《变应性鼻炎诊断和治疗指南》建议,鼻用糖皮质激素是AR的一线用药,但由于AR的病程长和易反复发作等特点,现有治疗方案仅能短期缓解患者临床症状,激素耐药问题也日益突出,成为困扰临床医师和患者的难题[2]。近年来,国内外大量研究表明,核因子κB(nuclear factor κB,NF-κB)信号通路与细胞因子、炎性因子、趋化因子的合成以及调控相关免疫细胞的发育及其正常功能的行使密切相关,以NF-κB为靶点的药物研究为治疗变应性炎症提供了新思路[3-6]。目前,AR与NF-κB信号通路的关系及作用机制的研究已取得一定进展,已研发出相关小分子靶向药物。现就NF-κB信号通路与AR黏膜高分泌、免疫细胞发育相关基因和T细胞分化的关系以及靶向抑制NF-κB的策略和临床意义予以综述,以探究其在AR中的临床应用前景。
1 NF-κB信号通路的概述
NF-κB是核转录因子蛋白家族成员,由两组5个结构类似的蛋白成员组成,第1组是NF-κB发挥活性作用的形式,包括p65相关因子(related,Rel)A、RelB和c-Rel;第2组包括NF-κB1(p105/p50)和NF-κB2(p100/p52)[7]。静息状态下,NF-κB抑制蛋白(inhibitor-NF-κB protein,IκB蛋白)可使NF-κB二聚体以无活性形式滞留在细胞质中。当细胞受到外界刺激后,可使IκB激酶激活,IκB激酶磷酸化IκB蛋白,继而泛素化并降解,使NF-κB暴露核定位的位点,从而释放NF-κB二聚体,随后NF-κB二聚体进入细胞核,并与DNA的特异性位点结合,调节靶基因的表达[8]。NF-κB激活后,可导致白细胞介素(interleukin,IL)1β、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等炎性细胞因子的表达,而IL-1β、TNF-α的基因产物又可直接激活NF-κB信号通路,扩大炎症反应,即信号通路激活中的级联瀑布效应[9]。
2 NF-κB信号通路在AR发病机制中的作用
2.1与AR鼻黏膜高分泌的关系 鼻黏膜高分泌性是AR的主要特征之一,正常情况下黏液的产生与代谢保持动态平衡,但在病理状态下,黏液的异常分泌可降低呼吸道黏膜功能和变应原的清除,从而加剧AR的慢性炎症过程。AR的黏液高分泌与白三烯、TNF-α、前列腺素、IL-4、IL-9和IL-13等炎性因子和细胞因子密切相关,而NF-κB信号通路广泛参与炎性介质和前炎性介质(TNF-α、IL-1β)以及一些炎症相关酶类(基质金属蛋白酶、环加氧酶和一氧化氮合酶)等基因的调控[10]。水通道蛋白(aquaporin,AQP)家族与气道液体分泌密切相关,其中AQP5大量分布于鼻黏膜上皮细胞。Song和Verkman[11]用毛果芸香碱刺激AQP5缺失小鼠和野生型小鼠发现,AQP5可能是气道液体分泌的重要因素,同时也是气道液体分泌的限速屏障。NF-κB可下调AQP5的表达,王伟伟[12]通过建立AR大鼠模型发现,AQP5、磷酸化环腺苷酸反应元件结合蛋白(cAMP-responsive element-binding protein,CREB)的表达与NF-κB的p65表达呈负相关,AQP5的表达与磷酸化CREB呈正相关,磷酸化CREB的表达与TNF-α、IL-1β、IL-6等炎症基因呈负相关,由此推测,NF-κB信号通路可能通过炎性细胞因子抑制CREB磷酸化途径或通过NF-κB的p65与磷酸化CREB在133位点(Ser133)竞争性结合细胞核内转录辅助因子结合位点,下调AQP5表达。Wang和Zheng[13]的研究证明,NF-κB的活化可能通过上调TNF-α和IL-6两种炎性因子的表达导致AR小鼠模型中黏蛋白5AC的高分泌。Towne等[14]的研究发现,TNF-α能够激活TNF-α受体1从而抑制AQP5的表达,而NF-κB信号通路参与TNF-α受体1的激活。Wang和Zheng[15]发现,NF-κB能够通过IL-1β下调AQP5的表达,导致大鼠AR的发生。综上所述,NF-κB信号通路可直接调控参与AR黏液高分泌的炎性细胞因子基因表达,并可通过上调炎性因子导致黏蛋白5AC高分泌和AQP5的表达减少,引起鼻腔分泌物清除或重吸收障碍,从而导致AR高分泌性。
2.2NF-κB活化与机体免疫应答的关系 AR属于Ⅰ型变态反应,发病过程涉及肥大细胞、嗜酸粒细胞、中性粒细胞、巨噬细胞、T淋巴细胞等多种免疫细胞。NF-κB信号通路不仅在自然杀伤细胞、树突状细胞、单核细胞、粒细胞系等免疫细胞的发育和功能行使中发挥作用,还通过调节细胞因子和趋化因子的基因转录表达在免疫应答中发挥关键作用[16]。气道细胞由NF-κB调控的炎症靶分子主要包括以下几种。①淋巴细胞:包括嗜酸粒细胞趋化因子1、调节激活正常T细胞表达和分泌的细胞因子、γ干扰素(interferon γ,IFN-γ)、IL-2、IL-4、IL-5、IL-13;②嗜酸粒细胞:TNF-α、IL-8、细胞间黏附分子1、白细胞功能相关抗原1;③中性粒细胞:IL-8、IL-1Ra、粒细胞-巨噬细胞集落刺激因子;④巨噬细胞:单核细胞趋化蛋白1、IL-8、生长相关性癌基因α;⑤上皮细胞:胸腺基质淋巴细胞生成素、细胞间黏附分子1、血管细胞黏附分子1、IL-8、IL-6、粒细胞-巨噬细胞集落刺激因子、生长相关性癌基因α、调节和激活正常T细胞表达和分泌、单核细胞趋化蛋白1、黏蛋白5AC等[17]。有研究表明,在以上炎性细胞相关基因调控元件中存在不同数量的κB基序,与NF-κB结合后,以多位点协同作用上调细胞因子的表达。此外,NF-κB参与重要免疫受体表达的调节,如可在主要组织相容性复合体Ⅰ类分子和T细胞受体基因的调控区发现κB基序,并在细胞介导的免疫应答中起关键作用[18]。NF-κB在初级(骨髓和胸腺)和次级(淋巴结、派氏集合淋巴结、黏膜相关淋巴组织和脾脏)淋巴组织的发育以及功能行使中发挥重要作用[16]。综上所述,NF-κB信号通路的活化贯穿机体的整个免疫应答过程。


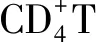

2.3.4NF-κB信号通路在Treg细胞分化中的作用 Treg细胞通过分泌IL-10、转化生长因子β等抑制由效应T细胞引起的免疫应答介导机体的抗炎反应,Treg细胞功能低下可能导致变应性疾病的发生[20]。Treg细胞在胸腺中经过自然选择过程后,依据发育来源分为天然Treg细胞和胸腺Treg细胞,其中胸腺Treg细胞的发育需经过T细胞受体依赖的和非T细胞受体依赖两个步骤,而IκB激酶作为T细胞受体信号传递中的重要介质,其数量减少或缺乏可导致胸腺Treg细胞数量下降,提示NF-κB可能在胸腺Treg细胞发育中起作用[24]。此外,Treg细胞发挥免疫调节作用依赖于叉状头/翅膀状螺旋转录因子3的高水平稳定表达,现已发现叉状头/翅膀状螺旋转录因子3基因座中存在CNS1、CNS2和CNS3三个高度保守的非编码序列,其中NF-κB亚基c-Rel与CNS3结合,在胸腺和外周叉状头/翅膀状螺旋转录因子3的表达和Treg细胞分化中起主要作用[32-33]。总之,NF-κB在特异性T细胞亚群的发育与活化过程中具有不同的作用,在免疫细胞功能失衡和免疫反应失调中与其他信号通路的交互作用仍是新的研究领域,有望研究出针对失衡细胞类型或细胞功能的靶向治疗方法。
3 靶向抑制NF-κB的策略
NF-κB的激活包括IκB激酶激活、IκB磷酸化和泛素化、IκB解体、NF-κB向核内迁移、NF-κB亚基与DNA结合等过程,故可针对以上环节抑制NF-κB过量激活[34]。NF-κB小分子靶向抑制剂的研究是目前的重点,现已发现:①NF-κB靶向抑制剂诱饵寡脱氧核苷酸是一组双链DNA片段,具有与DNA上转录因子结合位点相同的序列,这种竞争性占位效应阻碍了基因启动区NF-κB结合位点与NF-κB的结合,显著降低了下游基因的表达[35]。Wee等[9]的AR小鼠模型证实,诱饵寡脱氧核苷酸可下调血清总IgE、IgG1和卵清蛋白特异性IgE的水平,对鼻黏膜中IL-5、TNF-α和细胞间黏附分子1的表达也有抑制作用,此外,诱饵寡脱氧核苷酸还可明显下调脾脏中Th2型细胞因子IL-4和IL-5的表达。②Towne等[14]发现,NF-κB特异性抑制药二硫代氨基甲酸吡咯烷能够通过抑制AR大鼠TNF-α和IL-6的表达从而抑制鼻腔黏蛋白5AC的分泌。另有动物实验也证实二硫代氨基甲酸吡咯烷有广泛的抗氧化应激和抗炎作用[36-37]。③NF-κB必需调节剂是NF-κB介导的信号转导中的关键调节因子,可通过传递细胞外或细胞内信号阻止IκB激酶复合物促炎反应活性的激活,控制NF-κB调节的基因,为选择性调节NF-κB功能药物的开发提供新的靶向[38]。④Shimizu等[39]发现,NF-κB的特异性抑制剂脱氢甲基环氧醌霉素可通过抑制NF-κB组分与DNA的结合来抑制哮喘小鼠模型中支气管上皮细胞嗜酸粒细胞趋化因子1的表达以及嗜酸性气道炎症,包括Th2型细胞因子的产生和后续的气道重塑过程,但其对AR的相关炎性因子的抑制作用还需进一步探究。⑤Sidthipong等[40]设计并合成了一种脱氢甲基环氧醌霉素的类似物——(S)-β-水杨酰氨基-α-外-亚甲基-γ-丁内酯,可在体外抑制NF-κB的p65亚基与DNA结合,从而抑制脂多糖诱导的NF-κB活化、诱导型一氧化氮合酶表达和炎性细胞因子的分泌,在水溶液中较脱氢甲基环氧醌霉素具有更高的稳定性,有望成为新的抗炎药物候选者。
4 问题与展望
随着精准医学概念的提出,分子生物学、信号转导机制、信号通路交互作用已成为研究热点。对NF-κB信号通路与AR发病间关系及其机制的探究有利于进一步寻找具有靶细胞特异性的NF-κB活化阻断剂,对AR治疗具有潜在意义。目前仍面临的主要问题有:①AR是基因调节下多细胞、多通路参与的慢性炎症性疾病,其发病机制及信号通路间的交互作用深入而复杂,抑制NF-κB信号通路后是否会影响其他通路的正常功能仍需探究;②NF-κB是最常见、最丰富的转录因子,可作为关键性核转录因子参与多条炎症反应信号通路,调节炎症反应和免疫反应,因此,如何在不影响正常功能发挥的前提下抑制其调节失衡是需要攻克的难点;③大多数相关研究均使用细胞培养和动物模型完成,未来仍需进行研究来确定其在人类疾病中的临床重要性。期待进一步的研究能对两者间的关系做出全面阐述。
