FOXO3相关信号途径影响细胞自噬的研究进展
2019-05-27黄坚毅黄燕宁陈红常
黄坚毅,王 进,黄燕宁,陈红常
(1.崇左市人民医院神经内科,广西 崇左 532200;2.广西医科大学第一附属医院神经内科,南宁530000;3.广西医科大学,南宁530000)
细胞自噬是一种进化上保守的代谢途径,涉及生物体的生理过程及多种病理状态。自噬是一种自我吞噬的过程,并不是细胞自杀,而是一种自我保护机制,但过度的自我保护也会导致细胞凋亡。在生物体内,自噬对细胞内环境的维持及物质能量代谢的调节有重要作用,其通过调节各种机制使细胞适应体内外环境的变化。自噬对人类健康不可或缺,其还参与调节机体的生长、发育、衰老以及多种疾病如癌症、神经退行性变、微生物感染等。自噬的形成过程与细胞内的物质循环密切相关,自噬由复杂的级联信号网络系统调控,但具体的调控机制目前尚不清楚。根据物质转运到溶酶体内的途径,自噬通常分为巨自噬、微自噬以及分子伴侣介导的自噬3种。巨自噬和微自噬可分为选择性和非选择性,分子伴侣介导的自噬仅有选择性,选择性自噬由特定分子介导,存在一个受体配体识别过程。自噬的发生发展包括自噬体的诱导、自噬囊泡形成、自噬体形成、自噬体与溶酶体融合、自噬溶酶体降解及代谢产物循环。自噬体的诱导及形成主要受自噬相关基因(autophagy-related gene,Atg)的调控。自噬的调控过程主要与自噬前体结构形成的调控过程、磷脂酰肌醇-3-激酶(phosphatidylinositol-3 kinase,PI3K)信号通路途径、Atg9循环与泛素样蛋白结合途径等相关[1-2]。研究发现[3-4],叉形头转录因子O亚型3(forkhead box O 3,FOXO3)也参与自噬的调节。此外,营养因子与能量缺乏是AMP活化的蛋白激酶(AMP-activated protein kinase,AMPK)-FOXO3通路的主要激活因子;而PI3K-SGK/蛋白激酶B(protein kinase B,PKB/Akt)-FOXO3通路可因胰岛素转导信号而被激活。因受组织分布特异的影响,这些自噬调控相关通路和相关调控因子在各组织器官分布各异。FOXO3作为自噬调控的相关因子之一,也参与了机体的正常生物调节过程,并与多种疾病的发生发展相关。因此,对FOXO3和FOXO3参与的自噬调控通路进行研究,将有助于进一步了解FOXO3参与的自噬调控的生理病理过程,尤其是FOXO3参与的自噬调控通路介导的疾病的发生、发展过程,将为相关疾病的防治提供新的思路。
1 FOXO3的位置与生物学功能
FOXO3是FOXO转录家族的一员,定位于染色体6q21[5]。Broer等[6]的荟萃分析认为FOXO3基因与长寿相关。FOXO3广泛分布于多个器官中,包括肌肉、中枢神经、周围神经、胃、眼、心、肺等,在细胞增殖、分化、凋亡以及肿瘤的发病中均有重要作用。FOXO蛋白家族是动物细胞内的一类转录因子,可进入细胞内与DNA结合。FOXO家族各成员均具有不同的DNA结合域,参与多种转录和信号转导通路,其转录活性受磷酸化、乙酰化等的调控,转录后的修饰位点主要位于FOXO的C端DNA结合结构域[7]。C端作为核定位信号,含有一个Akt磷酸化位置和14-3-3蛋白结合基序。生理状态下,14-3-3蛋白与FOXO3结合后抑制了FOXO3向细胞核内的转位。因此,C端对于FOXO3蛋白与DNA结合形成的复合物的稳定性有重要作用[8]。FOXO3的翻译后修饰可能是通过改变FOXO3的DNA结合特性而调控下游因子,从而发挥作用[7]。此外,FOXO3含有进化上保守的翼状螺旋叉头FH结构域,包括DNA结合结构域和3个额外的保守区域(CR1、CR2以及CR3结构域)。FH结构域内含有110个氨基酸基序,其是特异性的DNA结合位点,CR3结构域促进DNA结合结构域与DNA结合[9]。可见FH结构域对调控靶基因的转录和翻译起到非常重要的作用。FOXO3的活化增加了核心自噬相关蛋白,包括UNC-51样激酶1(UNC-51-like kinase 1,Ulk1)、Beclin-1、Atg9A、Atg4B以及BCL2/腺病毒E1B 19 kDa蛋白相互作用蛋白3(BCL2/adenovirus E1B 19 kDa protein-interacting protein 3,BNIP3)等基因和蛋白水平的丰度[10],进而直接参与到自噬反应的调控中。
2 自 噬
自噬是指细胞通过溶酶体途径参与蛋白质和细胞器的降解代谢。自噬广泛存在于真核生物中。1962年最早在人肝细胞中观察到自噬形成过程,但直到1993年自噬与Atg的相关性才在酵母菌中发现[11-12]。截至目前,确定参与酵母自噬过程的Atg已超过30个,而且大多能在哺乳动物中能找到同源体[13]。自噬的产生需要多种蛋白质复合物和途径的参与,包括哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex-1,mTORC1)、ULK1/Atg1复合物、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、共轭途径等,其调控过程极为复杂。这些复合物和途径的活性高度依赖于自噬蛋白翻译后修饰的调控作用[14]。自噬蛋白的翻译后修饰是生物调节过程的一个重要的调控机制。大部分ATG含有可修饰的丝氨酸、苏氨酸、赖氨酸或半胱氨酸残基,其有利于生物体获得营养物质,剥夺生长因子,并对修饰条件产生影响[15-16]。近年来,低氧诱导因子1、FOXO3等转录因子通过参与翻译后修饰调控自噬过程受到人们的关注[17]。细胞发生自噬时,如能有效识别这些翻译后修饰则可对特定的细胞和组织自噬进行特异性调节。因此,了解ATG中哪些氨基酸残基被修饰,并进一步认识参与ATG修饰的转录因子,有望为某些疾病的治疗提供新的靶点。
3 FOXO3相关通路与自噬
转录因子FOXO3广泛参与细胞自噬和细胞凋亡,调控细胞周期,参与抗氧化应激反应。FOXO3很早就被证实参与自噬调节[18-19]。FOXO3可通过上调Atg或自噬调控基因而激活自噬,这些基因包括LC3、Atg12、γ氨基丁酸受体相关蛋白1基因、酵母Atg8以及BNIP3等[20-21]。有学者认为,FOXO3的转录活性受AMPK的调节[22],AMPK激活后可使FOXO3磷酸化,导致S期激酶相关蛋白2下调,并提高细胞核中精氨酸甲基转移酶1蛋白的水平。而精氨酸甲基转移酶1蛋白又作为转录因子EB的必要共激活因子,调节自噬和溶酶体基因的表达[4]。此外,AKT可使FOXO3的氨基酸残基Thr32、Ser253和Ser315磷酸化,使FOXO从细胞核中排出增加,在这个过程中FOXO3参与了细胞凋亡和自噬的诱导反应[4]。在这个过程中,PI3K还可通过调控Akt对FOXO3进行调节。调控自噬的过程中,FOXO3除受磷酸化修饰外,还受到乙酰化的调节。在骨骼肌中,FOXO3乙酰化后使自噬体相关基因激活,包括LC3、PI3K/囊泡蛋白分选相关蛋白34、γ氨基丁酸受体相关蛋白1、Atg12、Atg4、BECN1、ULK1和BNIP3等[3]。由此可见,FOXO3对自噬的调控过程涉及多条信号通路,并受磷酸化和乙酰化调节,调节过程多与AMPK、PI3K/Akt等信号转导通路相关[3-4]。FOXO3参与的自噬调控通路有PI3K-血清和糖皮质激素诱导的蛋白激酶(serum and glucocorticoid-inducible kinase,SGK)/Akt-FOXO3和 肝激酶B1(liver kinase B1,LKB1)-AMPK-FOXO3(图1),在调节过程中,FOXO3的活性受磷酸化和乙酰化等修饰的影响。
3.1胰岛素/胰岛素样生长因子介导的FOXO3转录因子参与的自噬调控通路
3.1.1PI3K-SGK/Akt-FOXO3通路与自噬 谷氨酸盐激活代谢型谷氨酸受体广泛分布在中枢神经系统中,参与整个中枢神经系统的突触传递和神经元兴奋性的调节。代谢型谷氨酸受体经过一系列反应后激活PI3K,经PI3K-SGK/Akt-FOXO3通路抑制细胞自噬。此外,谷氨酸盐还可激活酪蛋白激酶1(casein kinase 1,CK1),CK1激活后可使FOXO3磷酸化,促进细胞自噬。Akt是一类蛋白激酶A/蛋白激酶 G/蛋白激酶C家族的丝氨酸/苏氨酸激酶,在细胞生长、存活、凋亡及糖代谢等中起关键作用。Akt有Akt1、Akt2、Akt3三种异构体,其中Akt1在各个组织广泛表达,Akt2主要在肌肉和脂肪细胞表达,Akt3主要在睾丸和脑中表达[23]。Akt-FOXO3参与了多种疾病的病理过程:能量充裕时,Akt可磷酸化FoxO3的Thr32/Ser315/Ser253位点,进而阻止FoxO3进入细胞核内,抑制其介导的自噬基因的转录,从而下调自噬水平[24]。由此可见,Akt-FOXO3在自噬调控中主要起负性调节作用。但也有研究认为,PI3K-Akt-FOXO3可以促进自噬流的水平,主要机制是FOXO3被磷酸化激活后,促进谷氨酰胺合成酶的合成,以谷氨酰胺合成酶依赖性方式阻止mTOR易位至溶酶体膜而导致mTOR抑制,从而促进自噬的发生[25]。但对于此通路目前尚未完全清楚。综上,FOXO3被磷酸化后,作用于不同的效应分子可产生不同的生物效应。
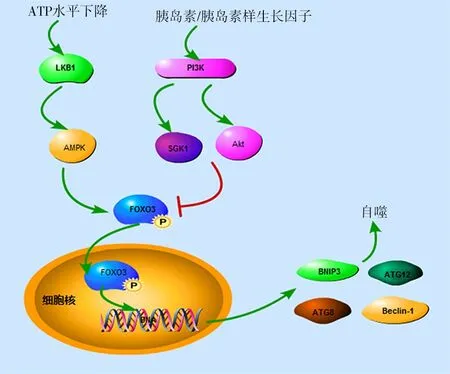

图1 常见的FOXO3参与的自噬调控通路
3.1.2Akt-FOXO3与自噬 自噬是进化上具有高度保守性的过程,在正常细胞中,自噬作为一种自我保护机制,可以及时清除细胞内的异常物质,从而抑制肿瘤的发生。同时,肿瘤细胞的自噬是肿瘤耐药性产生的基础。干扰素调节因子4结合蛋白可通过Akt-FOXO3信号通路抑制自噬,从而介导肿瘤的发生[26]。抑制自噬可导致异常物质的堆积,从而破坏细胞的物质循环,进而诱导肿瘤细胞死亡;过度自噬可促进肿瘤细胞的自噬性死亡(Ⅱ型细胞程序性死亡)。因此,通过抑制自噬而起到抗癌或抑癌作用的药物有望为现有治疗手段提供有力的补充。一项研究提示,阻力运动训练可防止大鼠肌肉萎缩,并增强肌肉力量[27]。部分机制为:抑制Akt-FOXO3通路后,可促进细胞自噬,而免受凋亡。该研究为老年人和长期卧床患者肌肉萎缩的康复锻炼提供了理论支持。细胞在饥饿及能量缺乏的情况下,分解代谢大于合成代谢,自噬被诱导激活,细胞内物质被降解,从而导致细胞死亡。糖尿病患者糖利用障碍,心肌细胞萎缩,而胰岛素可对抗这一病理过程,其通过Akt-FOXO3通路,抑制自噬相关基因的表达,抑制过度自噬导致的细胞死亡[28]。血管周围脂肪组织分泌的脂联素是抑制动脉粥样硬化发展的重要抗炎因子之一。Li等[29]的研究指出,脂联素通过抑制Akt-FOXO3信号通路促进巨噬细胞自噬,抑制动脉粥样硬化斑块形成。动脉粥样硬化斑块形成是脑血栓形成、冠心病等心血管疾病的重要病理变化,在我国人口老龄化日益加速的情况下,Akt-FOXO3信号通路介导的自噬将为心脑血管疾病的治疗提供新的思路。
3.1.3SGK1-FOXO3通路与自噬 SGK1是一种丝氨酸/苏氨酸蛋白激酶,广泛存在于中枢神经、周围神经、皮肤、肾脏、肺、肠、肾上腺、肝脏、眼等器官中,参与机体的神经兴奋性、炎症、细胞凋亡、免疫应答、凝血等多种活动[30-31]。肾缺血再灌注损伤与钙超载、活性氧类增多及氧化应激有关,当血流再通时,大量自由基释放,可造成炎症的瀑布级联反应。动物研究发现,缺血预处理对肾缺血再灌注损伤有着很强的保护作用,其相关机制为SGK1的过表达有效提高了磷酸化FOXO3a/FOXO3和低氧诱导因子1α的水平,提高了自噬通量[32],从而起到细胞保护作用。因此,SGK1有可能会成为肾脏缺血再灌注损伤的治疗靶点。
拉福拉病是一种以癫痫发作、神经退行性变以及葡聚糖小体聚集为特征的常染色体隐性遗传病,其发病机制与SGK1-FOXO3通路介导的自噬障碍有关[33]。对SGK1-FOXO3相关自噬的研究有助于进一步揭示神经变性疾病的发病机制。此外也有研究显示,SGK1-FOXO3通路也可能参与了肥胖的发生机制[34]。前列腺癌是一种恶性肿瘤,对于发现早者,可行前列腺切除术,且疗效较好,但该方法只适用于年轻、能耐受手术者,但对于肿瘤分化差、分期晚的患者,目前主要采用放化疗及内分泌治疗,但总体效果欠佳,肿瘤基因治疗的效果较好,但目前前列腺癌缺乏特异的基因治疗,靶向治疗是当前研究的热点。近年来的一项研究表明,抑制SGK1可显著抑制前列腺癌的生长、迁移、侵袭以及转移,其机制与SGK1调控mTOR-FOXO3a信号通路诱导自噬依赖的细胞凋亡有关[35]。SGK1有望成为前列腺癌靶向治疗的靶点。
3.2营养因子及能量缺乏激活相关的FOXO3转录因子参与的自噬调控通路
3.2.1LKB1-AMPK-FOXO3通路与自噬 LKB1是人体内重要的蛋白激酶,AMPK是LKB1的直接作用底物。丝氨酸/苏氨酸激酶LKB1是一种肿瘤抑制因子,主要通过直接磷酸化14种AMPK家族成员而调节多种生物学途径,包括细胞周期、细胞极性、能量代谢[36]。AMPK广泛分布在人体内各组织中,是能量代谢的关键分子,是运动、缺氧及营养缺乏等细胞能量不足条件下的关键酶,对于细胞的稳定起着不可或缺的作用,与肥胖、糖尿病以及代谢综合征等密切相关。在机体缺氧或缺少葡萄糖时,代谢产生的腺苷一磷酸、腺苷二磷酸可激活LKB1,活化的LKB1可直接激活AMPK,AMPK再磷酸化激活FOXO3,活化的FOXO3可进入细胞核内,调控自噬。LKB1-AMPK-FOXO3通路激活时,对肿瘤的抑制、肥胖的发生、缺血性脑细胞的保护等病理生理过程有重要作用,也可为肿瘤、肥胖、脑卒中的治疗提供新的思路。
3.2.2AMPK-FOXO3通路与自噬 当ATP水平下降,AMPK-FOXO3通路激活可促进自噬[36]。研究表明,AMPK介导的自噬在大鼠缺血预处理的脑细胞中有保护作用,AMPK可作为预防和治疗卒中的靶点[37-38]。Chi等[22]的研究表明,在缺氧诱导的自噬中,AMPK促进了FOXO3的活化,提示AMPK-FOXO3信号通路在心肌细胞缺氧诱导的自噬过程中发挥重要的调节作用。已有研究表明,花青素通过激活AMPK-FOXO3a,诱导U2OS细胞自噬,并通过AMPK-细胞周期蛋白依赖性激酶抑制蛋白1 途径保护细胞免受花青素诱导的细胞凋亡,表明花青素可通过自噬调节因子发挥抗癌作用[39]。AMPK-FOXO3信号通路的激活可以缓解急性肝功能衰竭[40],但此通路的激活并不都是有益的,AMPK-FOXO3信号通路的激活可促进动脉粥样硬化的形成[41]。动物研究亦表明,AMPK-FOXO3信号通路激活时出现了大鼠骨骼肌的失用性萎缩[42]。综上,在不同组织中AMPK-FOXO3通路发挥的作用并非完全一致,可能受其他自噬相关因子的调节,同时亦不排除与选取的动物模型有关。
4 问题与展望
自噬是维持细胞稳态的过程,与细胞生长、增殖及凋亡密切相关。人类许多疾病如神经退行性变、肿瘤、糖尿病、衰老等也与自噬密切相关。FOXO家族,特别是FOXO3转录因子,经磷酸化及乙酰化等相关修饰后,能作为信号途径参与细胞的生物过程,包括细胞自噬调节。FOXO3受上游相关通路激活并修饰后,可与其下游自噬相关因子相互作用,从而调控自噬过程。在不同条件及不同信号通路作用下,FOXO3介导的细胞自噬结果不同,其有可能起到保护细胞的作用,也可能会促进细胞凋亡[38,43]。目前,FOXO3相关信号通路参与的自噬调控过程并不十分明了,还有许多细节值得探究。
