何首乌饮对衰老生精细胞p53、Bcl-2和Bax mRNA表达的影响*
2019-05-25单博颖薛亚然牛嗣云
单博颖,薛亚然,梁 思,张 研,齐 峰,牛嗣云△
(1.河北大学医学院,河北保定 071000;2.河北大学附属医院;3.保定市第一医院)
细胞凋亡在睾丸细胞的分化、精子的成熟及存活中发挥重要作用[1]。研究显示,生精细胞异常凋亡会引发男性不育症等[2]。中药复方在治疗男性不育症和延缓衰老方面发挥着重要作用。本课题组前期研究发现[3],何首乌饮能降低睾丸组织细胞凋亡率,并且能通过提高睾丸间质细胞睾酮合成酶的活性促进睾酮分泌,改善自然衰老大鼠精子的质量。为进一步明确何首乌饮减少大鼠生精细胞凋亡的调控机制,本研究观察了何首乌饮对衰老生精细胞凋亡相关基因p53、Bcl-2和Bax mRNA表达水平的影响。
1 材料与方法
1.1 实验动物及药物制备 实验动物为清洁级雄性Wistar大鼠,购自河北医科大学动物实验中心(动物许可证号1510063)。
何首乌饮方药的组成:取何首乌、肉苁蓉、怀牛膝、淫羊霍、丹参、茯苓,按质量比为3:2:3:2:5:3混合。选用北京康仁堂药业有限公司生产的中药颗粒配成何首乌饮中药颗粒剂。饮片与颗粒的当量比,制何首乌1:10,肉苁蓉1:10,怀牛膝1:5,炙淫羊藿1:20,丹参1:10,茯苓1:5。
何首乌饮给药剂量:生药4.8g/100g作为给药量。根据北京康仁堂药业有限公司生产的配方颗粒的饮片与颗粒当量比换算,大鼠给药量为0.56g/100g(将0.56g颗粒溶于0.8ml生理盐水中灌胃,含药量0.7g/ml)。
1.2 主要试剂与仪器 DMEM/F12培养基,美国Gibcos公司;特级胎牛血清,以色列Biological Industries公司;胶原酶IV,美国Sigma公司;Trizol Reagent,美国Ambion公司;PrimeScript RT reagent Κit with Gdna Eraser、TB GreenTM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus),日本TaΚaRa公司。安捷伦Mx 3000P荧光定量PCR仪,美国AgiLent techno-Logies公司;全波长酶标仪,美国BioTek Epoch公司;二氧化碳培养箱,美国Thermo Scientific公司。
1.3 实验方法
1.3.1 含药血清的制备:Wistar大鼠15只,体重320~360g,何首乌饮灌胃给药,每天2次,连续7天。第7天给药1小时后,以6%水合氯醛麻醉大鼠,自内眦取血,分离血清,过滤后无菌分装,-80℃冷冻保存。
1.3.2 采用生精细胞和支持细胞共培养的方法培养生精细胞[4]:
⑴支持细胞:雄性大鼠出生后第15~20天取出双侧睾丸[5],使用IV型胶原酶和胰蛋白酶消化使曲精小管断裂,然后培养在含10% FBS的DMEM/F12培养液中,置于34℃、5%二氧化碳培养箱中培养4小时,待细胞混悬液中的间质细胞基本贴壁后转移上清液至另一新的培养瓶中,于34℃、5%二氧化碳培养箱中继续培养至3天。采用苏丹IV染色进行鉴定。
⑵精原干细胞:雄性大鼠出生后第7~9天取出双侧睾丸[6],采用两步酶消化法从睾丸组织中初步分离精原干细胞,差异贴壁法进一步纯化后,培养在含15% FBS的DMEM/F12培养液中,置于34℃、5%二氧化碳培养箱中培养3小时,待大部分间质细胞及成纤维细胞贴壁后,转移上清液至另一离心管中计数,以5×105~7×105个/ml接种于支持细胞中。上述支持细胞培养第5天时,胰酶消化细胞,收集消化下来的细胞,调整细密度为2×105~3×105个/ml接种在六孔板中,48小时后接种精原干细胞,接种后继续培养7天。采用碱性磷酸酶染色和HE染色进行鉴定。
1.3.3 衰老细胞模型的建立:采用自由基氧化损伤法[7]建立生精细胞衰老模型。将培养7天的生精细胞中直接加入终浓度为50μmol/L的H2O2和100μmol/L的FeSO4,继续培养8小时,更换新鲜培养液,继续培养3天,以建立衰老模型。采用β-半乳糖甘酶染色进行鉴定。
1.3.4 细胞分组:生精细胞分为3组:①正常组(NG组),培养7天的生精细胞,继续培养80小时。②衰老组(AG组),按照1.3.3的方法建立衰老模型。③何首乌饮组(SWYG组),按照1.3.3的方法建立生精细胞衰老模型后,加入终浓度为10%的何首乌饮含药血清,继续培养3天。
1.3.5 实时荧光定量PCR法检测生精细胞Bcl-2、Bax和p53 mRNA的表达:由Invitrogen公司设计合成Bcl-2、Bax和p53基因的引物序列(附表)。用Trizol法提取生精细胞的总RNA,酶标仪检测浓度。使用反转录试剂盒将mRNA反转录得cDNA,按照试剂盒操作进行PCR反应,条件为:95℃ 30s;95℃ 5s,60℃ 31s,扩增40个循环。运用2-△△Ct方法分析实验结果。
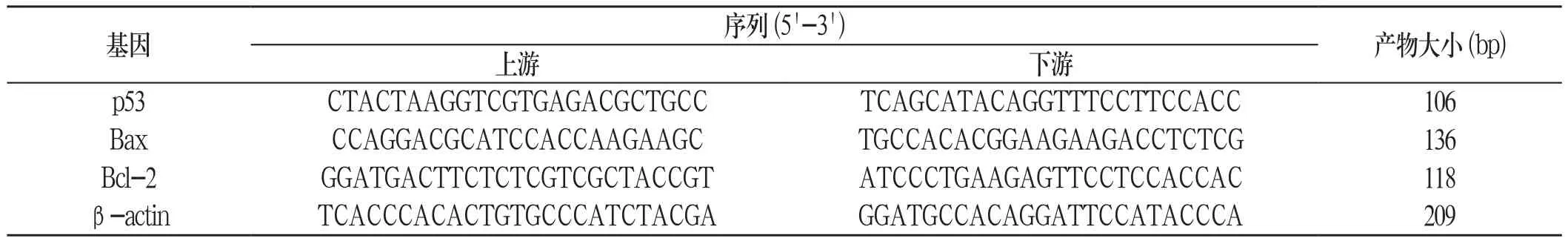
附表 各基因引物序列及产物大小
1.4 统计分析 采用SPSS 19.0软件分析实验数据,P<0.05为差异有统计学意义。首先进行正态性检验,符合正态分布的计量数据用(±s)表示,使用单因素方差分析比较组间差异,若方差齐,两两比较采用最小显著差法(least significant difference,LSD),如果方差不齐则采用Dunnett’s T3检验进行两两比较。计数资料用百分率(%)表示,采用卡方检验。
2 结果
2.1 支持细胞和生精细胞的鉴定 支持细胞培养5天连接成片,密集生长(图1A)。精原干细胞与支持细胞共培养2天后,精原干细胞附着于支持细胞表面,精原干细胞呈圆形或卵圆形(图1B);共培养7天后,精原干细胞分裂增殖,可见各级生精细胞(图1C)。
苏丹IV染色结果,支持细胞胞质中可见染成橘红色的脂滴,支持细胞纯度可达90%以上(图1D)。HE染色可见成簇存在且着色为紫红色的圆形细胞为各级生精细胞,淡紫色且呈不规则形状的是支持细胞(图1E)。碱性磷酸酶染色,可见精原细胞膜及细胞质内灰黑色颗粒,精子细胞弱阳性或不着色(图1F),支持细胞不着色。
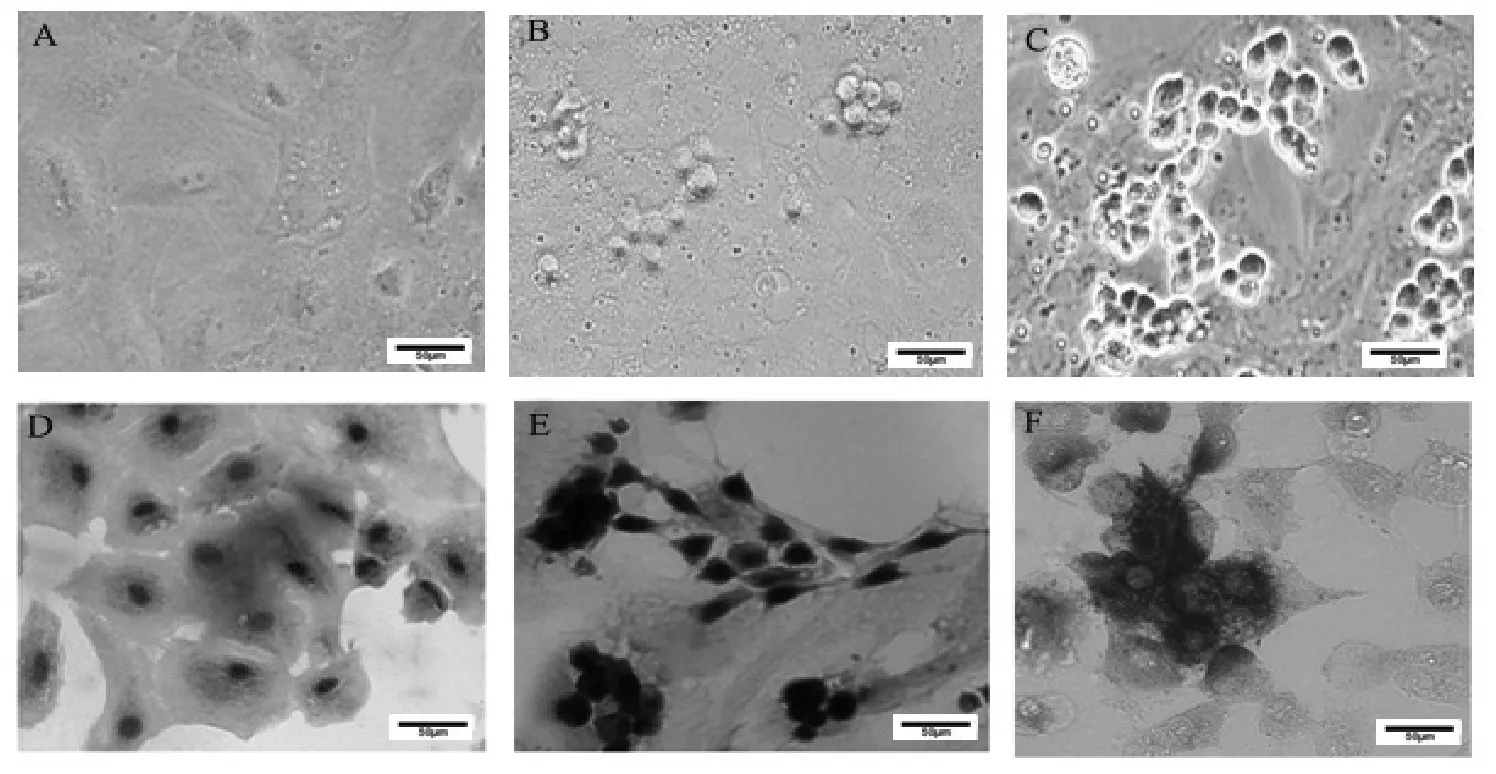
图1 支持细胞和生精细胞的培养与鉴定(标尺=50 µm)
2.2 生精细胞衰老模型的鉴定 β-半乳糖苷酶染色阳性产物呈蓝色,定位于细胞质(图2A-B)。结果显示衰老 组生精细胞阳性细胞率明显高于正常组(P<0.05,图2C),衰老组β-半乳糖苷酶阳性细胞率可达80%以上。
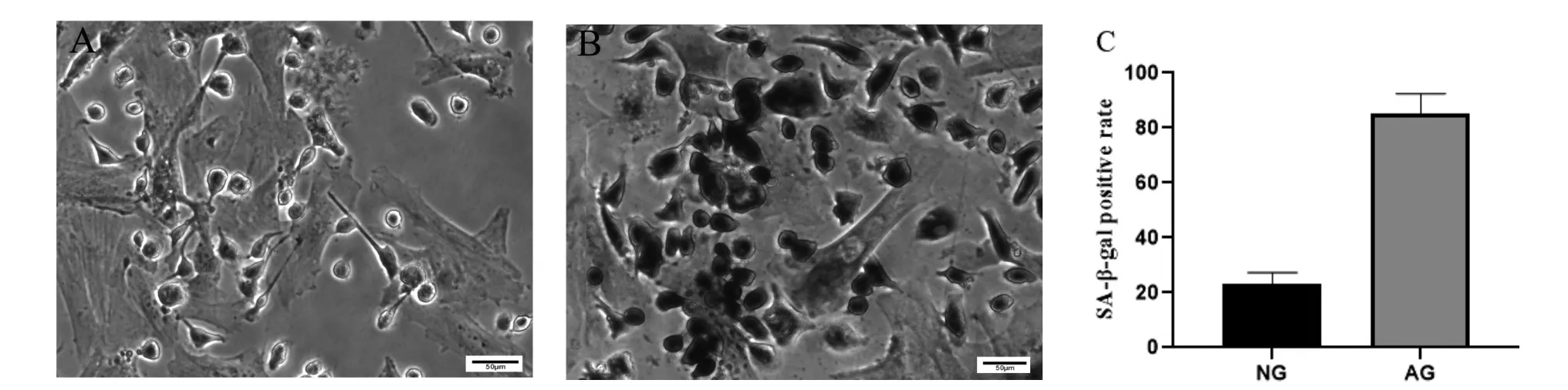
图2 生精细胞β-半乳糖苷酶染色结果(标尺=50µm)
2.3 何首乌饮对衰老生精细胞p53、Bcl-2、Bax mRNA表达的影响 AG组生精细胞p53和Bax mRNA的表达明显高于NG组(P<0.05),Bcl-2 mRNA的表达明显低于NG组(P<0.05)。何首乌饮干预后,生精细胞中p53和Bax mRNA的表达明显低于AG组(P<0.05),Bcl-2 mRNA的表达明显高于AG组(P<0.05)。Bax/Bcl-2比值AG组明显高于NG组(P<0.05),何首乌饮干预后,该比值明星低于AG组(P<0.05)。见图3-4:
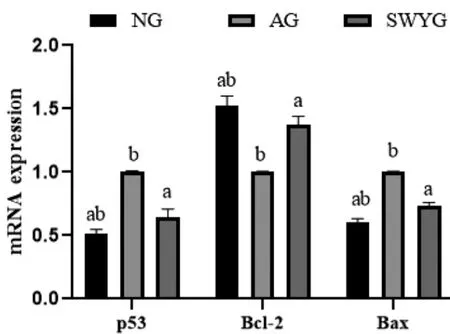
图3 各组生精细胞p53、Bcl-2和Bax mRNA的表达情况
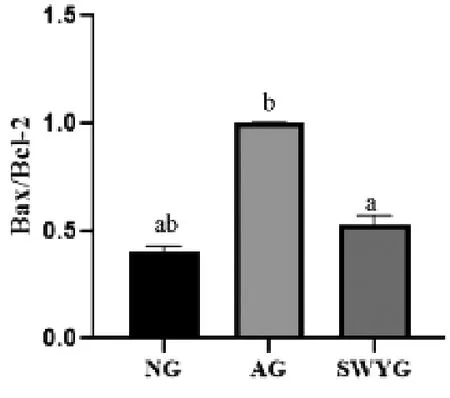
图4 各组生精细胞Bax/Bcl-2比值
3 讨论
中医药通过提高机体的抗氧化能力、提高免疫力、降血脂等多方面发挥抗衰老的作用,具有很好的临床疗效[8]。何首乌饮是由何首乌丸加味而成。何首乌丸是刘河间《宣明论》中的传统临床验方,以何首乌为主药,配以肉苁蓉和怀牛膝,在此基础上增加了淫羊藿、丹参、茯苓。前期研究证明,何首乌饮可以通过调控线粒体凋亡途径中关键基因的表达,抑制睾丸生精细胞凋亡,改善生精功能,延缓睾丸组织退化[9]。
细胞过度凋亡是睾丸生殖功能降低的重要原因之一[10]。研究表明,p53是细胞生长周期中的负调控因子,与细胞周期的调控、DNA修复、细胞分化、细胞凋亡等重要的生物学功能有关[11]。p53基因在正常细胞中低表达,当细胞受到应激刺激时,可诱导细胞中p53高表达。p53的编码产物可以调节Bax的表达,Bax可介导p53依赖的细胞凋亡;同时,p53可能通过下调Bcl-2的表达间接导致细胞凋亡[12]。Bax是一种促凋亡基因,能够拮抗Bcl-2的抑制凋亡的作用。Bcl-2和Bax是一对正负凋亡调节基因,二者形成同源二聚体或异二聚体来促进细胞凋亡[13]。因此,Bax/Bcl-2比值对于决定细胞接受刺激信号后存活起着关键作用。如Bcl-2过量表达有利于细胞存活,如Bax过量表达,则细胞会发生凋亡。
何首乌饮属于中药复方,虽然所包含的化学成分并不十分清楚,但已有的研究表明,何首乌中的二苯乙烯苷、淫羊藿中的淫羊藿苷、丹参中的丹参酮IIA均可通过调控线粒体通路关键基因发挥抑制细胞凋亡的作用[14-16]。本研究结果提示,何首乌饮能够抑制生精细胞p53和Bax mRNA的表达水平,提高Bcl-2 mRNA表达水平,从而延缓生精细胞衰老,抑制生精细胞凋亡,但还需其它实验方法对本研究结果进行验证。
