基于钝齿棒杆菌argGH启动子改造的L-瓜氨酸高效合成
2019-05-25张微微陈紫薇张晓娟窦文芳张晓梅许正宏
张微微, 陈紫薇, 张晓娟, 窦文芳, 张晓梅, 耿 燕, 许正宏*,2
(1.江南大学 药学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
L-瓜氨酸是一种重要的非必需氨基酸,是尿素循环过程中的重要中间体[1],广泛应用于医药及化妆品领域[2]。目前,L-瓜氨酸的主要生产方法有化学合成法[3]、酶法[4]和微生物发酵法[5]。其中,微生物发酵法利用可再生糖质原料生产瓜氨酸,具有成本低、产率高以及环境污染小等优势,近年来引起了广泛的关注。
在谷氨酸棒杆菌中,L-瓜氨酸的合成是以α-酮戊二酸为前体,经谷氨酸脱氢酶(gdh编码)催化生成L-谷氨酸,L-谷氨酸进一步在argCJBDFR编码酶的作用下合成L-瓜氨酸,然而L-瓜氨酸易被argGH编码酶分解为L-精氨酸,造成L-瓜氨酸在微生物体内无法大量积累,见图1。在该途径中,L-瓜氨酸合成和分解途径的调控基因argCJBDFR和argGH为两个转录单元,受到不同启动子的调控[6]。Hao N 等[7]在 C.glutamicum ATCC 13032 ΔargG ΔargR中过表达argJ基因,增强了鸟氨酸乙酰转移酶的活性,成功使L-瓜氨酸产量提高到了8.51 g/L;赵芹芹等[8]在C.crenatum SYPA 5-5中敲除了argG基因,L-瓜氨酸的产量达到15.2 g/L;Ikeda M等[5]利用反向代谢工程方法,通过在C.glutamicum ATCC13032中敲除argR,并引入A26V和M31V突变获得L-瓜氨酸生产菌株。总体而言,大多数研究主要通过敲除分解途径编码基因或外源质粒过表达合成途径关键基因两种策略提高L-瓜氨酸的产量,然而上述方法存在容易形成营养缺陷型菌株,外源质粒表达不稳定等缺陷。
实验室前期保存的菌株C.crenatum H-7具有高产L-精氨酸的特性,该菌株与C.glutamicum具有高度同源性[9]。作者以C.crenatum H-7为研究对象,通过启动子替换手段,弱化L-瓜氨酸分解成L-精氨酸的关键基因argGH的表达,最终获得了一株能够高效积累L-瓜氨酸的重组菌株。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒 本研究所用的菌株与载体见表1。

图1 谷氨酸棒杆菌中L-瓜氨酸的合成途径Fig.1 Metabolic pathway of L-citrulline in Corynebacterium glutamicum

表1 文中涉及的菌株和质粒Table 1 Strains and plasmids used in this study
1.1.2 培养基及培养条件
1)LB培养基(组分g/L):蛋白胨 10,酵母粉 5,NaCl 10;
2)LBG培养基(组分g/L):蛋白胨 10,酵母粉 5,NaCl 10,葡萄糖 5;
3) LBHIS 培养基(组分 g/L):酵母膏 2.5,蛋白胨 5,NaCl 5,脑心浸液 18.5,山梨醇 91;
4)感受态制备(组分g/L):蛋白胨10,酵母粉5,NaCl 10,甘氨酸 30,吐温 80;
5)种子培养基(组分 g/L):葡萄糖 30,酵母粉10,(NH4)2SO420,KH2PO41,MgSO4·7H2O 0.5, 尿素1.5;pH 7.0;115 ℃灭菌 10 min;
6)发酵培养基(组分g/L):葡萄糖130,酵母粉10, (NH4)2SO450,KH2PO41.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.02,MnSO4·H2O 0.02,生物素 8×10-5,L-组氨酸 5×10-4,CaCO330;pH7.0;115 ℃灭菌 10min。
大肠杆菌于37℃培养,必要时添加50 mg/mL的卡那霉素;钝齿棒杆菌于30℃培养,必要时添加50 mg/mL的卡那霉素。
1.1.3 引物 本研究所用的引物见表2。

表2 文中所用到的引物Table 2 Primers used in this study
1.2 携带启动子片段的重组质粒构建
以C.crenatum H-7基因组为模板,分别以PargC-F、PargC-R 和 PargG-F、PargG-R 为上下游引物扩增argC和argG上游长度约160 bp和180 bp的目标启动子片段,启动子片段P-dapAB6、P-leuAM2A和P-leuAM3A(长度均为130 bp)由上海生工进行合成。利用限制性内切酶BamHI和Hind III对启动子探针质粒pDXW-11[10]进行酶切,利用T4 DNA ligase连接启动子片段和酶切后的质粒pDXW-11,形成携带不同启动子的重组质粒。
1.3 启动子替换重组质粒pK18mobsacBPdapAB6:argGH的构建
启动子替换质粒pK18mobsacB-PdapAB6:argGH的构建流程见图2。首先,以C.crenatum H-7的基因组为模板,分别扩增argG基因上游长度约600 bp和argG基因开放阅读框长度约700 bp的基因片段,弱启动子片段P-dapAB6(130 bp)通过基因合成得到,利用重叠延伸PCR,获得长度约1 430 bp的启动子替换片段argG-LPR;然后利用限制性内切酶EcoRI和Xba I对目的片段和质粒pK18mobsacB[11]进行双酶切,形成具有粘性末端的线性片段;最后,利用T4 DNA ligase连接argG-LPR和线性化的pK18mobsacB质粒,形成启动子替换重组质粒 pK18mobsacB-PdapAB6:argGH。

图2 重组质粒pK18mobsacB-PdapAB6:argGH的构建流程Fig.2 Construction of plasmid pK18mobsacB-PdapAB6:argGH
1.4 重组质粒的电转化
C.crenatum感受态细胞的制备和电转化参考文献[12]方法。将重组质粒pK18mobsacB-PdapAB6:argGH电转化C.crenatum感受态细胞,然后在含卡那霉素抗性的LBHIS平板和含10%蔗糖的LB平板上进行两次筛选,通过PCR验证获得重组菌株C.crenatum H-7-PdapAB6:argGH。
1.5 L-瓜氨酸发酵条件及参数测定
1.5.1 种子培养条件 将保存于-20℃冰箱中的甘油管菌种接种于新鲜固体种子斜面,30℃静置培养24 h;将活化后的菌种接入种子培养基 (装液量为30 mL/250 mL三角瓶),120 r/min、30℃往复式摇床振荡培养10 h。
1.5.2 摇瓶发酵培养条件 以6%的接种体积分数将种子培养液接入发酵培养基(装液量为20 mL/250 mL三角瓶),120 r/min、30℃往复式振荡培养96 h。
1.5.3 菌体浓度的测定 将发酵液稀释一定倍数,在562 nm处测定吸光值。
1.5.4 葡萄糖质量浓度的测定 将样品稀释一定倍数,利用SBA-40D生物传感分析仪进行测定。
1.5.5 (NH4)2SO4质量浓度的测定 将样品稀释一定倍数,测定方法参考Lee H[13]。
1.5.6 L-瓜氨酸质量浓度的测定 将发酵液上清液稀释一定倍数,以异硫氰酸苯酯(PITC)作为衍生化试剂进行氨基酸柱前衍生,利用HPLC进行氨基酸质量浓度的测定。
1.6 启动子活性分析
将含有不同启动子片段的重组质粒转化E.coli JM109,以氯霉素乙酰转移酶CAT的酶活来表示启动子活性。取培养约16 h的含启动子探针质粒的重组菌发酵液进行离心收集细胞,用预冷的100 mmol/L Tris-HCl(pH 7.8)洗涤三次,悬浮。 超声波破碎细胞,离心,取上清液用于氯霉素乙酰转移酶CAT酶活测定,以携带空质粒的E.coli JM109为对照。采用考马斯亮蓝法测定总蛋白质质量浓度[14],CAT酶活测定参照文献[15]的方法。
1.7 实时荧光定量PCR实验
选择培养至对数生长中后期的原始菌株H-7以及重组菌株H-7-PdapAB6:argGH种子培养液,参照RNA提取试剂盒说明书提取样品中的总RNA,选择A260/280比值约为2.0的产物进行逆转录。按cDNA第一链合成试剂盒说明书进行逆转录。RT-PCR实验按PrimerScriptTM RT reagent Kit(Takara)试剂盒说明书进行操作,反应条件为95℃3 min,随后3步反应进行40个循环:95℃ 30 s,65℃ 30 s,72℃ 30 s。选用 16SrRNA作为内参基因,所有反应设定3个重复。
1.8 酶活测定
1.8.1 谷氨酸脱氢酶 (GDH)酶活力测定 谷氨酸脱氢酶酶活力单位定义为每分钟氧化 1 μmol NADPH所需要的酶量,方法参照Meers J L[16]。
1.8.2 精胺琥珀酸合成酶 (ASS)酶活力测定 精胺琥珀酸合成酶酶活力单位定义为每分钟产生1 μmol Pi所需要的酶量,方法参照Katewa S D[17]。
1.8.3 精胺琥珀酸裂解酶酶(ASL)酶活力测定 精胺琥珀酸裂解酶酶活力单位定义为每分钟产生1 μmol L-精氨酸所需要的酶量,方法参照Lee H[13]。
2 结果与分析
2.1 启动子活性分析
钝齿棒杆菌以谷氨酸为前体,在argCJBDFR编码酶的作用下合成L-瓜氨酸,而L-瓜氨酸能在argGH编码酶的催化下继续分解。整个过程中,argCJBDFR和argGH分别受到不同启动子的调控。以C.crenatum H-7染色体DNA为模板,用表2中引物进行PCR扩增得到启动子片段P-argC和P-argG。在利用谷氨酸棒杆菌生产缬氨酸[18]和腐胺[19]的报道中,成功利用弱启动子P-dapAB6、P-leuAM2C和P-leuAM3A对代谢流进行了调控,作者同时选用这3个弱启动子进行了研究。将启动子片段插入到启动子探针质粒pDXW-11上,构建了携带启动子片段的重组质粒pDXW-11-P-argC、pDXW-11-P-argG、pDXW-11-P-dapAB6、pDXW-11-P-leuAM2C和pDXW-11-P-leuAM3C,将其转化到E.coli JM109中用于启动子活性分析。
通过测定氯霉素乙酰转移酶CAT的酶活来表征启动子活性,结果见表3。CAT酶活测定结果显示,L-瓜氨酸合成途径调控argCJBDFR表达的启动子P-argC活性为25.12 U/mg,而分解途径调控argGH表达的启动子P-argG活性为6.97 U/mg,表明仍有大量L-瓜氨酸被分解形成L-精氨酸。因此,我们选择活性最弱的启动子P-dapAB6(1.21 U/mg)替换C.crenatum H-7基因组上的启动子P-argG,以期最大程度弱化降解途径,提高L-瓜氨酸积累。

表3 通过氯霉素乙酰转移酶(CAT)酶活测定的启动子活性Table 3 Promoters activity characterized by the activity of CAT reporter
2.2 启动子替换重组菌株H-7-PdapAB6:argGH的构建
将重组质粒pK18mobsacB-PdapAB6:argGH电转到C.crenatum H-7感受态细胞中,会发生两次同源重组,将重组菌涂布于含卡那霉素的LBHIS平板和含10 g/dL蔗糖的LB平板上进行两轮筛选。以筛选得到的阳性转化子基因组为模板,用引物PsodargG1F和Psod-argG6R进行PCR验证,结果见图3。1号通道为以原始菌株基因组为模板PCR验证结果,条带大小为1 300 bp,2号通道为以重组菌株H-7-PdapAB6:argGH基因组为模板PCR验证结果,条带大小为1 430 bp,这表明P-dapAB6弱启动子替换成功,C.crenatum H-7-PdapAB6:argGH重组菌株构建完成。

图3 启动子替换PCR验证结果Fig.3 PCR verification of promoter replacement in H-7 chromosome
2.3 启动子弱化对H-7-PdapAB6:argGH胞内关键基因转录水平和关键酶活性的影响
重组菌株H-7-PdapAB6:argGH和原始菌株H-7代谢途径中关键基因的转录水平比较见图4。可以看出,重组菌株H-7-PdapAB6:argGH分解途径基因argG和argH的转录水平分别降低了86.23%和90.74%,L-瓜氨酸合成途径基因的转录水平普遍上调,其中gdh的转录水平提高了2.09倍。

图4 关键基因的相对转录水平分析Fig.4 Relative transcription level of the key genes determined by RT-PCR
对转录水平有显著差异的3个关键酶的酶活进行分析,结果见表4。相比原始菌株H-7,重组菌株H-7-PdapAB6:argGH合成途径谷氨酸脱氢酶(GDH)的比酶活提高了67.05%,分解途径中精胺琥珀酸合成酶(ASS)和精胺琥珀酸裂解酶(ASL)的比酶活分别降低了91.80%和55.35%。上述结果表明,启动子替换显著弱化了L-瓜氨酸的分解途径,且合成途径得到一定程度的加强。

表4 GDH,ASS,ASL比酶活测定Table 4 Specific activity of GDH,ASS and ASL
2.4 重组菌株H-7-PdapAB6:argGH发酵过程分析
在摇瓶水平上对重组菌株H-7-PdapAB6:argGH的L-瓜氨酸生产性能进行评价,结果见图5-6。1)96 h发酵结束时,重组菌株H-7-PdapAB6:argGH的生物量达到32.17 g/L,比原始菌株H-7的生物量(26.32 g/L)提高了 22.22%,H-7-PdapAB6:argGH的最大及平均比生长速率分别为0.44 h-1和0.048 h-1,均高于原始菌株(分别为0.27 h-1和0.037 h-1);2) 相比原始菌株 H-7, 发酵前期 H-7-PdapAB6:argGH的葡萄糖消耗速率显著降低,H-7 84 h时葡萄糖已经耗尽,而重组菌株直到发酵终止时葡萄糖才消耗完全。重组菌株H-7-PdapAB6:argGH的最大及平均比底物消耗速率分别为0.16 g/(g·h)和 0.085 g/(g·h),低于原始菌株 H-7(分别为 0.36 g(g·h)和 0.11 g/(g·h));3) 重组菌株H-7-PdapAB6:argGH的L-瓜氨酸的产量可以达到33.85 g/L,相比原始菌株H-7(6.90 g/L)提高了4.91倍,L-瓜氨酸的糖酸转化率 (0.25 g/g)和生产强度(0.34 g/(L·h)) 分别提高了 5.00 倍和 4.86 倍,最大及平均比产物得率也得到了提高;4)相比原始菌株H-7主要积累L-精氨酸,重组菌株H-7-PdapAB6:argGH L-精氨酸只有少量积累。
3 结语
启动子在基因表达过程中具有重要作用,决定了基因表达的时间强度,是必需的顺式调控元件[20],通过启动子调控和改变基因表达水平,已成功应用于赖氨酸[21]、缬氨酸[18]和精氨酸[22]等生产菌株的改造中,该方法有效地改变了代谢流分布,实现了目标产物的高产。然而,此方法在瓜氨酸的研究中还未见相关报道。


图5 原始菌株H-7和重组菌株H-7-PdapAB6:argGH的发酵过程曲线Fig.5 Time course of L-citrulline fermentation by the parent strain H-7 and the engineered strain H-7-PdapAB6:argGH
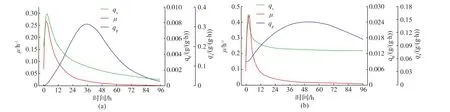
图6 原始菌株H-7和重组菌株H-7-PdapAB6:argGH的发酵动力学参数图Fig.6 Fermentation kinetics of the parent strain H-7 and the engineered strain H-7-PdapAB6:argGH
作者通过分析L-瓜氨酸分解途径中调控argGH表达的启动子P-argG,发现催化瓜氨酸分解为精氨酸的P-argG具有较强的活性,造成瓜氨酸无法大量积累。因此,作者采用启动子替换手段,利用启动子P-dapAB6[19]调控argGH的表达,弱化瓜氨酸的分解途径,成功构建了一株L-瓜氨酸高产菌株 C.crenatum H-7-PdapAB6:argGH。重组菌株H-7-PdapAB6:argGH L-瓜氨酸合成途径关键基因和关键酶的表达水平分析结果表明,L-瓜氨酸分解代谢途径基因argGH表达水平降低,ASS和ASL酶活大幅度下降,L-瓜氨酸的分解代谢流明显弱化,但调控α-酮戊二酸进入L-瓜氨酸合成途径的基因gdh表达水平和GDH酶活水平显著提高,因此提高了TCA循环到L-瓜氨酸合成途径的代谢流量。发酵结果表明,重组菌株H-7-PdapAB6:argGH L-瓜氨酸的产量,糖酸转化率和生产强度分别达到33.85 g/L、0.25 g/g 和 0.34 g/(L·h),比原始菌株 H-7 提高了4.91倍、5.00倍和 4.86倍。 该菌株与 VF Wendisch等[23]报道相比,发酵过程中无需外源添加抗生素和精氨酸,且L-瓜氨酸的生产性能得到大幅提升,具有良好的工业应用前景。
