基于二次发酵酵母活力确定乙醇分批补料发酵最佳补料时间
2019-05-25柯善恢伍时华赵东玲黄翠姬
柯善恢, 伍时华, 赵东玲, 张 健, 黄翠姬
(广西科技大学 生物与化学工程学院,广西 柳州545006)
关键字:二次发酵酵母活力;乙醇分批补料发酵;补料时间
甘蔗富含蔗糖、葡萄糖和果糖,价格低廉,不占用耕地,是燃料乙醇理想的糖质原料,而燃料乙醇被视为最清洁的能源之一[1,3]。甘蔗汁(糖质量浓度140 g/L左右)直接发酵酒度偏低,不利于工业化生产,希望通过补加糖蜜提高初始糖质量浓度(220 g/L左右),然后在酵母活力高的时间点继续补加糖蜜提高最终酒度,但是甘蔗糖蜜对发酵抑制作用大,补料需在酵母活力高的时候进行。与分批发酵相比,补料发酵有多方面的优势,可以解除高浓度基质对生产菌株的抑制作用[4],也可延长细胞稳定期而获得更多的目的产物,对生产高浓度乙醇具有重要的意义。但由于发酵过程的复杂性,补料时机和补料策略都难以确定[5]。目前研究较多的补料策略主要是通过建立模型的方法来优化补料控制,如模糊模式识别法[6]、神经网络辨识法[7]、动力学模型与遗传算法联用[8]、动力学模型与扩大功能的拉格朗日算法联用[9]和补料反馈控制模型法[10]等,这些方法都建立在对发酵过程的数学模拟上,并未以酵母本身属性为出发点。酵母活力是高浓度乙醇发酵成败的关键因素之一[11],酵母活力可能会影响补料时间,是补料流加时间的一个重要指标。
用YPDF模拟甘蔗汁和甘蔗糖蜜培养基,将乙醇分批发酵不同时间点酵母等量转接入新鲜发酵培养基中,在相同条件下接种相同数目酵母进行二次发酵,比较各时间点二次发酵酵母活力强弱,然后以二次发酵酵母活力为基础,进行乙醇分批补料发酵试验,以验证二次发酵酵母活力与补料时间关系,试图为乙醇补料分批发酵建立一种新的流加时间确定策略。
1 材料与方法
1.1 实验材料
1.1.1 菌株 乙醇酵母 (Saccharomyces cerevisiae)GJ2008由广西科技大学发酵工程研究所保藏。
1.1.2 培养基 斜面培养基与种子培养基:参见左松方法[15]。发酵培养基:配置初始总糖质量浓度为140、180、220、260 g/L 的发酵培养基(添加糖为葡萄糖与果糖,各占50%),酵母浸膏、蛋白胨及pH条件与种子培养基相同,上速培养基的装液量都为200 mL/瓶。将20 g糖 (添加糖为葡萄糖与果糖,各占50%)装入三角瓶灭菌。主发酵培养基的初始总糖质量浓度为220 g/L,装液量为300 mL。以上培养基都采用蒸汽灭菌法(115℃灭菌20 min)。
1.1.3 种子培养方法 斜面种子经恒温活化,接入一级种子培养基中,培养方法参见左松方法[16],将二级种子液离心后,用无菌水将酵母泥振荡均匀制成10倍浓缩菌悬液,备用。
1.1.4 乙醇发酵方法 乙醇分批发酵方法:将二级种子10倍浓缩菌悬液按1%的接种体积分数接入发酵培养基中,用透气膜和牛皮纸包扎封瓶口,摇床120 r/min,32℃条件下发酵,进行不同初总糖质量浓度发酵试验和220 g/L总糖主发酵试验。
二次发酵方法:于主发酵培养基中每隔6小时取样一次,离心制成浓缩菌悬液(2 mL),接入二次发酵培养基。取出的主发酵液体积0 h时为200 mL,并进行细胞计数,细胞浓度为N0,主发酵其它时间点细胞浓度记为 N6、N12、N18、N24、N30、N36,则主发酵各时间点取出主发酵液体积为200/(Ni/N0)mL,以此保证二次发酵接种酵母数相同。用透气膜和牛皮纸包扎封瓶口,摇床转速与温度同乙醇分批发酵。发酵过程中每6小时取一次样,每组试验两个平行,所得结果为平均值。
乙醇补料分批发酵方法:将二级种子10倍浓缩菌悬液按 1%的接种体积分数接入发酵培养基中,用透气膜和牛皮纸包扎封瓶口,摇床转速与培养温度均与乙醇分批发酵相同。在12、18、24、30、36 h时将发酵液倒入装有葡萄糖和果糖的500 mL三角瓶中振荡溶解,所有操作均在无菌环境下进行。整个发酵过程每6小时取样,每组试验三个平行,所得结果为平均值。
1.2 检测方法
总糖的测定:使用SGD-IV还原糖测定仪测定;细胞存活率测定:亚甲基蓝法[12];乙醇质量浓度测定:用气相色谱仪测定发酵过程中乙醇质量浓度。采用装FID检测器的气相色谱仪和T2100P色谱工作站,用面积外标法分析乙醇质量浓度。色谱条件见文献[13];发酵最终乙醇质量浓度用蒸馏法测定。
1.3 糖代谢曲线分析
曲线下面积采用GraphPad Prism 5计算。
1.4 数据处理方法
运用Origin9.0软件对发酵数据处理并作图,数据处理按蒋凯所述方法计算[13]。
2 结果与讨论
2.1 乙醇补料分批发酵最佳初糖质量浓度的选择
由表1可知,初总糖质量浓度为140 g/L时,乙醇产率和总糖发酵效率高,残糖少,但初总糖质量浓度太低,发酵后期需要补加高质量浓度的糖发酵液才能达到产高质量浓度乙醇的要求;初总糖质量浓度为260 g/L时,乙醇产率小,总糖发酵效率低,残糖质量浓度较高,不适合作为补料发酵初始糖质量浓度;在220 g/L左右时乙醇产率、总糖发酵效率综合较高,后期补料压力相对小。乙醇补料分批发酵初总糖偏高会抑制酵母活力[4],残糖多;偏低会导致设备利用率低,后期补糖质量浓度高等问题,因此选择一个酵母不受抑制且尽可能高的初始糖质量浓度对分批补料发酵有重要意义。所以本实验初总糖质量浓度设定在220 g/L左右。
由图1可知,主发酵过程0~12 h糖消耗速率最大,为(9.53±0.02) g/(L·h),酵母数量增长最快,乙醇产率也最大,为(3.79±0.01) g/(L·h),酵母发酵初期的指数级生长表明酵母受糖抑制作用小;30~36 h糖消耗速率仅为 0.17 g/(L·h),发酵基本结束。以 0~12 h乙醇产率/糖消耗速率 (即乙醇对耗糖产率)值为标准,此后每6小时占标准比分别为104.49%、154.22%、116.01%和0%,可知随着糖消耗速率和乙醇产率的下降,每克糖所产的乙醇却在增加,说明发酵后期酵母仍具有较高的发酵活力,只因糖被消耗完而乙醇质量浓度不再增加,并非酵母没有发酵能力,发酵后期仍可进行补料。要弄清何时适合补料,需要知道发酵过程的酵母活力。

表1 不同总糖质量浓度乙醇分批发酵主要参数Table 1 Main parameters of the ethanol batch fermentation by S.cerevisiae strain GJ2008 at different total sugar concentration

图1 初总糖质量浓度为220 g/L时的乙醇分批发酵过程曲线Fig.1 Profiles of residual sugars,biomass concentration and ethanol during the ethanol fermentation with 220 g/L initial sugar
2.2 根据二次发酵酵母活力选择最佳补料时间
酵母活力包括酵母的细胞活性和发酵能力,二次发酵酵母活力反映的是主发酵不同时间点的酵母活力。作者从乙醇分批发酵的二次发酵酵母细胞活性、糖代谢和乙醇生成能力综合分析酵母活力强弱。
2.2.1 二次发酵酵母细胞活性分析 酵母细胞活性从细胞总数和活细胞数两方面考察。如图2所示,主发酵不同时间点(0、6、12、18、24、30、36 h)取样酵母的二次发酵细胞生长趋势基本一致。酵母细胞数AUC可以整体的评价细胞生长状况[14-16],AUC越大细胞生长越快,由表2可知,0~30 h主发酵取样酵母的二次发酵细胞数AUC相差不大,36 h取样酵母细胞数AUC偏小,说明36 h取样酵母生长情况比其他取样点差,主要原因可能是主发酵36 h酵母已经进入衰亡期,重新接种到新培养基的酵母生长迟缓。各个时间点取样酵母最终细胞数保持在相近水平,差别不大。如图3和表2所示,主发酵各时间点取样酵母的二次发酵酵母存活率很高,死亡细胞比较少,其中24 h取样酵母整个发酵过程几乎没有死亡细胞,细胞数AUC与活细胞AUC之差最小,说明24 h取样酵母的细胞活性最高。细胞活性表示的是酵母生长状况,要知道酵母活力还需分析酵母的发酵能力。

图2 主发酵不同时间取样酵母的二次发酵细胞生长曲线Fig.2 Profiles of biomass growth during the secondary fermentation by yeast sampling from the primary fermentation at different time

图3 主发酵不同时间取样酵母的二次发酵活细胞数Fig.3 Profilesofliving cellduring the secondary fermentation by yeast sampling from the primary fermentation at different time
2.2.2 二次发酵耗糖能力分析 如图4-5所示,二次发酵在36 h内基本结束,在0~6 h时段,总糖消耗速率由 0、6、12、18、24 h 取样酵母逐渐增大,24 h取样酵母总糖消耗速率最大,为(10.98±0.29) g/(L·h),36 h 最小,为(7.2±0.09) g/(L·h);6~12 h 主发酵各时间点取样,酵母的总糖消耗速率都达到最大值且开始趋于相同;12~18 h时段总糖消耗速率都减小。主要原因是主发酵各时间点取样的酵母活力不同,使刚接种(0~6 h)的二次发酵酵母总糖消耗速率不同,经过适应期后酵母活力得到恢复,总糖消耗速率开始一样(6~12 h),说明二次发酵初期酵母活力差异明显。比总糖消耗速率表示单位活细胞量的总糖消耗速率,比总糖消耗速率越大表明单位活细胞的耗糖能力越强[13]。如图6所示,二次发酵0~6 h时段各时间点取样酵母的比总糖消耗速率由0 h取样酵母到6 h取样酵母略微减小,然后开始逐渐增大,24 h 取样酵母达到最大值(9.49±0.15) g/(1011个活细胞·h),说明24 h取样酵母单位活细胞量的耗糖能力最强。
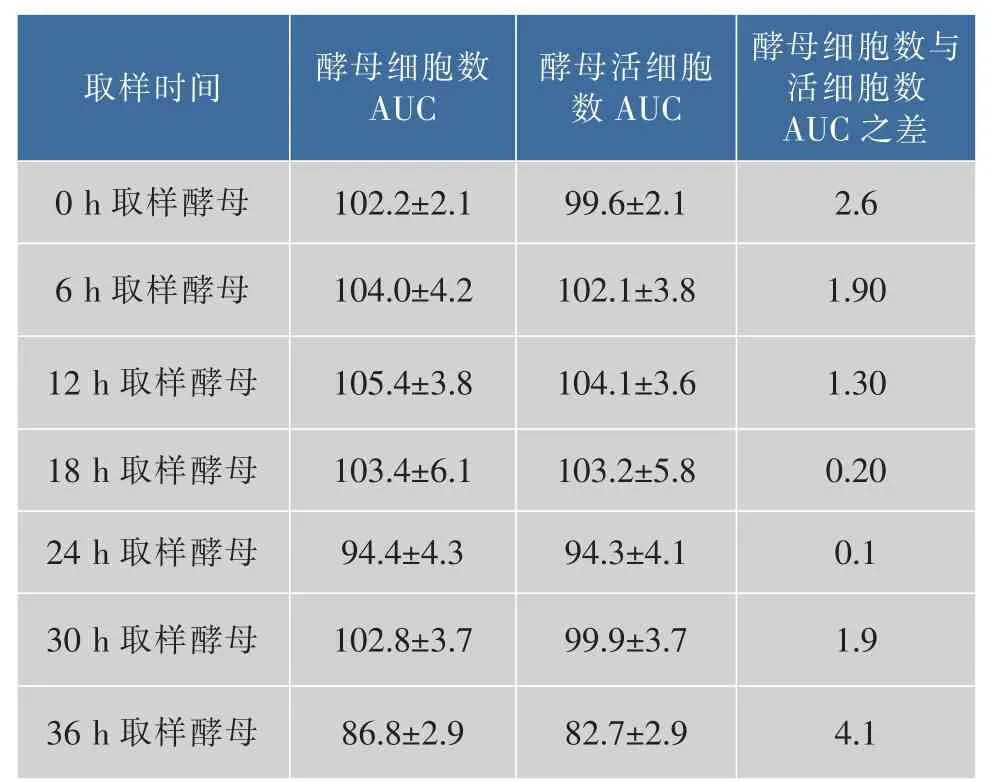
表2 主发酵不同时间取样酵母的二次发酵细胞生长曲线下面积Table 2 Area under growth curves during the secondary fermentation at different time of the primary

图4 主发酵不同时间取样酵母的二次发酵残总糖代谢拟合曲线Fig.4 Fitted profiles of sugar metabolism during the secondary fermentation by yeast sampling from the primary fermentation at different time

图5 主发酵不同时间取样酵母的二次发酵总糖消耗速率Fig.5 Profiles of total sugar uptake rate during the secondary fermentation by yeast sampling from the primary fermentation at different time

图6 主发酵不同时间取样酵母的二次发酵比总糖消耗速率Fig.6 Profiles of specific glucose uptake rate during the secondary fermentation by yeast sampling from the primary fermentation at different time
二次发酵残总糖曲线下面积可以定量地表示酵母发酵活力的强弱[17],二次发酵残总糖曲线下面积越小,酵母发酵活力越强;反之,二次发酵残总糖曲线下面积越大,酵母发酵活力越弱。由图7可知,24 h取样酵母二次发酵残总糖曲线下面积最小,为2 390.0±59.4,发酵活力最强,36 h取样点曲线下面积最大,为2 972.0±3.5,发酵活力最弱。以24 h取样酵母AUC为对照组AUC24h,各取样点比值依次为1.10、1.15、1.09、1.07、1.00、1.17、1.24,30 h 取样酵母AUC开始增大,30 h和36 h分别高出24 h取样点17%和24%,酵母发酵活力变弱,所以24 h取样酵母的发酵活力最强。
2.2.3 二次发酵乙醇生成能力分析 如图8所示,主发酵各时间取样酵母的二次发酵乙醇生成趋势相同,乙醇生成曲线下面积可以整体的评价乙醇生成快慢[14],24 h取样酵母的乙醇生成曲线下面积最大为2 703,说明24 h取样酵母乙醇生成最快。由图9可知,0~6 h时段各时间点乙醇生成速率趋势与比总糖消耗速率一致,24 h取样酵母乙醇生成速率最大, 为 (4.56±0.4) g/(L·h),36 h 取样酵母最小,为(2.80±0.23) g/(L·h),说明 24 h 取样酵母生成乙醇能力最强。比乙醇生成速率表示单位活细胞量的乙醇生成速率[13]。由图10可知,0~6 h各时间点取样酵母之间的趋势与比总糖消耗速率和乙醇生成速率一致,24 h取样点酵母细胞比乙醇生成速率最大,为(3.95±0.14)×10-11g/h,说明 24 h 取样酵母单位活细胞量生成乙醇的能力最强。综合0~6 h时段主发酵不同时间点各速率的趋势,24 h取样点酵母最高。

图7 主发酵不同时间取样酵母二次发酵残总糖曲线下面积Fig.7 Area under the curve of residual sugar secondary fermentation by yeast sampling from the primary fermentation at different time

图8 主发酵不同时间取样的酵母二次发酵乙醇生成曲线Fig.8 Profiles of ethanol during the secondary ethanol fermentation by yeast sampling from the primary fermentation at different time
主发酵各时间点取样酵母的二次发酵主要参数见表3。24 h取样酵母二次发酵糖代谢曲线下面积、乙醇曲线下面积,乙醇质量浓度、乙醇产率、总糖发酵效率都是所有取样酵母中最好的,18 h取样酵母次之。综合细胞活性,二次发酵初期酵母活力和二次发酵酵母发酵活力的趋势,主发酵各时间点取样酵母的二次发酵酵母活力强弱顺序大致24、18、12、0、6、30、36 h,最适合的补料时间点为24 h。

图9 主发酵不同时间取样酵母的二次发酵乙醇生成速率Fig.9 Profiles of ethanol production rate during the secondary fermentation by yeast sampling from the primary fermentation at different time

图10 主发酵不同时间取样酵母的二次发酵比乙醇生成速率Fig.10 Profiles of specific ethanol production rate during the secondary fermentation by yeast sampling from the primary fermentation at different time
2.3 乙醇补料分批发酵验证试验
在初总糖为220 g/L乙醇分批发酵基础上以相同条件下于不同时间点一次补加100 g/L糖进行乙醇补料分批发酵,乙醇分批补料发酵主要发酵参数见表4。24 h补料发酵乙醇产率最高、总糖发酵效率最高、最终乙醇产率最高、残糖最少和发酵周期最短,与之对应二次发酵酵母活力最强。发酵结果与二次发酵酵母活力强弱趋势完全一致,二次发酵酵母活力最强的24 h补料效果最好,说明在初始总糖质量浓度为220 g/L时,选择在24 h进行补料效果是最佳的。相反,二次发酵酵母活力最弱的36 h补料乙醇产率、总糖发酵效率和最终乙醇产率最低,发酵效率只有66.10%,所剩残总糖质量质量浓度最高为84.8 g/L,发酵周期长,很多残糖没被利用,不适合补料。

表3 主发酵不同时间取样酵母的二次发酵主要参数Table 3 Main parameters of the secondary fermentation by S.cerevisiae strain at different time from the primary fermentation

表4 补料发酵实验主要参数Table 4 Main parameters of the feeding fermentation by S.cerevisiae GJ2008 at different time
3 结 语
以主发酵不同时间取样酵母的二次发酵酵母活力作为确定乙醇分批补料发酵流加时间的指标。结果表明:二次发酵酵母活力强弱反映了所对应的主发酵取样时间点酵母活力,在二次发酵酵母发酵活力最强所对应的主发酵时间点(24 h)补料,主发酵效果最好。作者以二次发酵酵母活力作为流加指标为乙醇分批补料发酵建立了一种新的流加时间确定策略。该流加时间确定策略缺点是费时,必须进行二次发酵,分析得到二次发酵酵母活力,以此反映主发酵不同时间点的酵母活力,但是如果乙醇分批发酵(主发酵)参数固定,该方法不失为一种简单有效的流加时间确定策略。此方法也可推广到其他类似细胞的补料时间确定上,具有广泛实用性。
