樟芝提取物Fr.3抑制TGF-β1诱导的肝纤维化机制
2019-05-25许正宏
孙 青 , 耿 燕 *, 杜 妍 , 许正宏 ,2
(1.江南大学 药学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室 江苏 无锡 214122)
樟芝(Antrodia camphorata),俗称牛樟菇、牛樟芝、红樟芝等,属于担子菌纲、非褶菌目、多孔菌科、薄孔菌属,是一种仅寄生于台湾牛樟树腐朽树干内的珍稀药食用真菌,素有“台湾森林之红宝石”、“灵芝之王”之美誉[1]。在台湾民间,樟芝被用来解酒保肝已有悠久历史,且国内外药理实验表明,樟芝菌丝体及发酵液具有抗肿瘤[2]、抗炎[3]、保肝[4-5]等多种活性。樟芝成分复杂,含有多糖类、三萜类、酚类及琥珀酸类等物质。据文献报道,樟芝中的三萜类物质Antcin K可显著抑制肝癌细胞的粘附、迁移、侵袭[6]、琥珀酸衍生物Antrodin B具有抗肝纤维化活性[7-8]、Antrodin C具有抗乳腺癌活性[9]。因此,樟芝具有良好的研究价值及应用前景,尤其是在肝病治疗上。
肝脏是机体重要的器官,具有物质代谢、生物转化、解毒等功能,在受到各种致病因素和刺激因子的侵袭后发生肝脏损伤和炎症反应。肝脏在遭受持续性损伤时会反复自我修复进而形成肝纤维化,主要特征为肝星状细胞(HSCs)的激活以及细胞外基质(ECM)异常积累,特征标志为平滑肌肌动蛋白(α-SMA)。静息状态的HSCs是存储脂滴和维生素A的主要场所,在活化时脂滴丢失,HSCs分泌大量的胶原(I,III,IV 型)、纤维连接蛋白(Fn)、透明质酸等[10]。TGF-β1是刺激肝星状细胞激活进而发生增值和分化的重要细胞因子之一,可以上调α-SMA和ECM的表达水平[11-13]。TGF-β1可以激活多个信号通路,参与肝纤维化的发生,如Smad、PI3K、MAPK信号通路,调节肝星状细胞的激活、增值、迁移以及凋亡[14-16]。我国是一个肝病高发国家,积极防治肝纤维化能有效降低肝硬化及肝癌发病率。
本课题组前期从樟芝菌体正己烷提取物中经硅胶柱层析分离得到 5 个组分(Fr.1、Fr.2、Fr.3、Fr.4和Fr.5),并发现Fr.2组分能有效抑制PDGF-BB诱导的肝纤维化[7],课题组随后对Fr.2组分做了进一步分离及活性分析,发现其抗肝纤维化活性主要来自化合物Antrodin B[8]。作者主要对Fr.3组分抑制TGF-β1诱导的肝纤维化活性进行了研究,同时通过检测ECM的表达及其相关信号通路中蛋白质表达水平的变化来探究作用机制,为樟芝抗肝纤维化的进一步研究提供了理论依据。
1 材料与方法
1.1 实验器材
1.1.1 材料与试剂 大鼠肝星状细胞CFSC-8B:购自中南大学湘雅中心实验室细胞库;TGF-β1:购自美国PeproTech公司;RPMI-1640培养基、胎牛血清(FBS):购自美国Gibco公司;胰酶-EDTA消化液、青霉素-链霉素 (100×)、10%SDS、pH 8.8 的 1.5 mol/L Tris-HCl、pH 6.8 的 1 mol/L Tris-HCl: 购自碧云天公司;MTT及SB431542[8]:购自美国Sigma公司;WST-1 细胞增殖试剂盒、Trizol、FastStart Universal SYBR Green Master、细胞裂解液:购自美国Roche公司;MAPK信号通路中抗体、p-AKT及p-Smad2抗体:购自Cell Signaling Technology公司;Collagen I抗体:购自Abcam公司;α-Actin抗体:购自Santa Cruz公司;其他试剂购自国药集团化学有限公司。樟芝菌粉中物质提取方法见文献[7]。
1.1.2 仪器 旋转蒸发仪:德国Heidolph公司;中低压柱层析:Grace公司;Multiskan MK3型酶标仪:德国 Eppendorf公司;CO2细胞培养箱:Thermo公司;倒置显微镜:Nikon公司;RT-PCR仪、化学发光成像仪:Bio-Rad公司。
1.2 实验方法
1.2.1 Fr.3组分的制备方法 3 L烧杯中加入500 g樟芝菌粉与2.5 L甲醇混合,室温浸提12 h,布氏漏斗过滤,重复浸提3次,收集澄清的滤液,经旋转蒸发仪旋转蒸发得甲醇提取物;800 mL去离子水复溶甲醇提取物,等体积与正己烷混合萃取3次,收集正己烷相,旋转蒸发后得正己烷提取物;利用中低压柱层析仪分离樟芝正己烷提取物,条件为:40 g硅胶柱,流速20 mL/min,检测波长为254 nm,流动相为正己烷、乙酸乙酯梯度洗脱,在乙酸乙酯洗脱比例为13%时收集馏分并旋转蒸发得组分Fraction 3(Fr.3)。
1.2.2 CFSC-8B细胞培养与传代 培养基:RPMI-1640培养基+含10%胎牛血清 (FBS)+1%抗生素(100 U/mL 青霉素、100 μg/mL 链霉素)。
培养条件:置于37℃、5%CO2的培养箱中培养。
细胞传代:细胞贴壁生长,长至80%~90%时胰酶消化,加培养基终止消化后悬浮细胞,接种传代,选取对数生长期的细胞进行实验。
1.2.3 MTT法检测Fr.3组分作用CFSC-8B后细胞活力的影响 胰酶消化对数生长期的细胞后加培养基悬浮,以5×103个/孔的细胞密度铺于96孔板,每孔100 μL,24 h后换含有不同质量浓度Fr.3组分(0、5、10、20 μg/mL)的培养基作用细胞 24 h,每组6个平行,弃去培养液,随后每孔加入含0.5 mg/mL MTT 的培养基 100 μL,孵育 4 h,弃去废液,每孔再加150 μL DMSO,用酶标仪在570 nm处测OD值[8]。

1.2.4 WST-1法检测Fr.3组分对TGF-β1诱导的CFSC-8B细胞增值 将处于对数生长期的细胞以5×103个/孔的密度铺于96孔板中培养24 h,用含有体积分数0.5%FBS的培养基同步化细胞24 h,加含不同质量浓度的 Fr.3 组分(0、5、10、20 μg/mL)及SB431542(2 μmol/L)预作用细胞 1 h,换含有不同质量浓度的Fr.3组分,SB431542及TGF-β1培养基共同孵育24 h,每孔加入10 μL WST-1培养1 h,用酶标仪在450 nm处测OD值。

1.2.5 细胞小室迁移实验检测Fr.3组分对TGF-β1诱导的CFSC-8细胞迁移 取2×105个/mL的对数生长期细胞悬液100 μL,加入8 μm孔径的聚碳酸酯微孔滤膜Transwell小室(Millipore公司),小室放入预先加有500 μL含10%FBS细胞培养基的24孔板中。孵育4~5 h后,加入不同质量浓度的Fr.3及 SB431542(2 μmol/L)预作用 1 h,换含有不同质量浓度的Fr.3组分、SB431542及TGF-β1培养基继续培养24 h。取出滤膜,用棉签擦去上室内表面细胞,用质量分数4%多聚甲醛固定迁移至滤膜外表面的细胞30 min,质量分数0.1%的结晶紫染色,显微镜拍照,用体积分数33%的醋酸脱色10 min,洗脱液在酶标仪上于570 nm处测定OD值,间接反映细胞数。
1.2.6 实时荧光定量PCR(RT-PCR)检测Fr.3组分对TGF-β1诱导的肝纤维化ECM相关基因的表达采用Trizol法提取细胞总RNA,将RNA逆转录为cDNA,采用SYBR Green进行荧光定量PCR反应,用2-△△t法定量分析ECM相关基因的表达水平。相关基因为:α-SMA、Collagen I (Col1)、Collagen III(Col3)、Fibronectin(Fn)[7]。
1.2.7 蛋白免疫印迹(Western Blotting)法检测Fr.3组分对TGF-β1诱导的相关蛋白的表达的影响 细胞加药作用后,预冷的PBS润洗细胞,每皿加入100 μL蛋白裂解液(含蛋白酶及磷酸酶抑制剂),在冰上裂解30 min,将细胞刮下收集于1.5 mL离心管中,12 000 g,4℃离心 10 min,取蛋白质上清液,BCA试剂盒测样品的蛋白质浓度。经10%的SDSPAGE电泳湿法转膜至PVDF膜上,5%脱脂牛奶封闭后,分别孵育一抗和二抗,ECL试剂盒(Thermo)显色拍照,用Image J软件分析蛋白质条带灰度值,定量检测 α-SMA、Col1 以及 Smad、MAPK、PI3K 信号通路相关蛋白质的表达水平。
1.2.8 数据统计 用One-Way ANOVA统计学分析实验结果,每组数据以平均值±标准偏差表示。p<0.05,与空白对照组相比;极显著水平表示为***p<0.001;与模型组相比,极显著水平表示为###p< 0.001。
2 结果与分析
2.1 Fr.3组分体外抗肝纤维化活性评价
2.1.1 Fr.3组分的制备 樟芝菌粉(500 g)与2.5 L甲醇室温浸提12 h,过滤,重复浸提3次,收集滤液旋转蒸发后得到甲醇提取物,以水复溶至800 mL,与正己烷等体积萃取得正己烷提取物44.36 g。通过硅胶柱层析法分离樟芝正己烷相,在乙酸乙酯洗脱比例为13%时收集馏分得组分Fraction 3(Fr.3)共2.2 g,在樟芝菌粉中的得率为0.64%,Fr.3组分为黄色油状物,溶于甲醇。
2.1.2 Fr.3组分对CFSC-8B细胞活力的影响 将不同质量浓度的 Fr.3 组分(3、6、10、15、20、30、60 μg/mL)与CFSC-8B细胞共孵育24 h,利用MTT方法检测细胞存活率。如图1所示,Fr.3组分在低于20 μg/mL时对CFSC-8B细胞无明显毒性,细胞存活率均在80%以上,但在高质量浓度60 μg/mL的Fr.3作用下,CFSC-8B细胞存活率显著被抑制,抑制率达到72.75%,有明显的毒副作用,Fr.3组分的IC50值为54.56 μg/mL。因此,选择Fr.3组分作用质量浓度在0~20 μg/mL时与CFSC-8B细胞孵育 24 h进行后续研究。
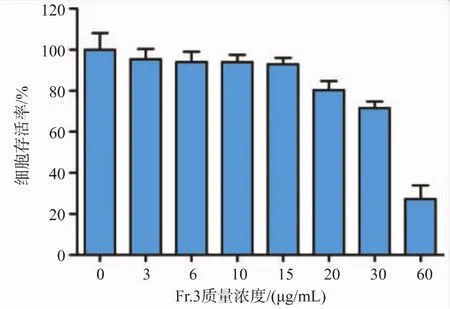
图1 Fr.3对CFSC-8B细胞存活率的影响Fig.1 Effect of Fr.3 on cell viability in CFSC-8B cells
2.1.3 Fr.3组分对TGF-β1诱导的CFSC-8B细胞迁移及细胞增值的影响 Geng等通过实时荧光定量和蛋白免疫印迹法确定TGF-β1活化CFSC-8B细胞的最佳作用质量浓度和时间分别为10 ng/mL和24 h[8]。在此基础上通过WST-1法检测Fr.3组分(0、5、10、20 μg/mL)作用于 TGF-β1 诱导的 CFSC-8B细胞后,其细胞增值活性的变化见图2。TGF-β1显著诱导细胞增值,Fr.3作用后可以显著抑制TGF-β1 诱导的增值作用(###p<0.001)。

图2 Fr.3组分对TGF-β1诱导的CFSC-8B细胞增值的影响Fig.2 Effects of Fr.3 on TGF-β1 induced cell proliferation in CFSC-8B cells
2.1.4 Fr.3组分对TGF-β1诱导的CFSC-8B细胞迁移影响 通过小室迁移法检测细胞增值,考察Fr.3 组分(0、5、10、20 μg/mL)抗肝纤维化活性,见图3。与空白组相比,TGF-β1诱导后细胞迁移率显著增加(**p<0.01),Fr.3 组分作用活化的细胞后,显著抑制细胞迁移(##p<0.01),且具有明显的剂量依赖关系,20 μg/mL Fr.3组分抑制率与阳性药物SB431542抑制率相当。
2.2 Fr.3组分改善TGF-β1诱导的肝纤维化作用机制初步探讨
2.2.1 Fr.3组分下调TGF-β1诱导的肝纤维化细胞ECM中相关基因的表达水平 TGF-β1诱导的肝纤维化细胞活化后,ECM异常积累,在基因水平上,α-SMA、Col1、Col3、Fn 转录水平升高。 采用 qRT-PCR技术进一步检测 Fr.3组分对 TGF-β1诱导的CFSC-8B相关基因表达水平的影响,结果见图4。TGF-β1作用于CFSC-8B细胞后可显著上调α-SMA、Col1、Col3、Fn 基因的表达水平(***p<0.001)。Fr.3组分作用后显著降低基因的表达 (###p<0.001),且具有剂量相关性。

图3 Fr.3组分对TGF-β1诱导的CFSC-8B细胞迁移的影响(标尺:100 μm)Fig.3 Effects of Fr.3 on TGF-β1 induced cell migration in CFSC-8B cells(Scale bar,100 μm)

图 4 Fr.3组分对 TGF-β1诱导的 α-SMA、Col1、Col3及Fn mRNA的相对表达量的影响Fig.4 Effect of Fr.3 on the expression of α-SMA,Col1,Col3 and Fn mRNA induced by TGF-β1
2.2.2 Fr.3组分降低TGF-β1诱导的α-SMA、Col1的表达并下调Smad、PI3K、MAPK通路中相关蛋白质磷酸化表达水平 通过Western blotting法检测在TGF-β1的诱导下,不同质量浓度的Fr.3组分作用于CFSC-8B后,ECM中α-SMA、Col1蛋白质表达情况,见图 5(a)。 TGF-β1作用于 CFSC-8B 细胞后可显著诱导α-SMA、Col1的蛋白质表达 (###p<0.001),而Fr.3组分作用后降低其表达水平(***p<0.001)。因此,Fr.3组分可以降低TGF-β1诱导的肝星状细胞ECM的积累。
TGF-β1可以介导Smads的信号通路从而影响肝纤维化的发展[17],如图 5(b)所示,Fr.3组分可以显著抑制TGF-β1介导的Smad信号通路中Smad2的磷酸化表达水平(##p<0.01);磷脂酰肌醇-3激酶/蛋白激酶(PI-3K/AKT)信号通路可通过激活AKT进入肝星状细胞核,调节相关基因的转录水平[18],如图5(c),Fr.3组分还可以显著抑制 TGF-β1介导的PI3K信号通路中AKT的磷酸化表达水平 (##p<0.01);丝裂原活化蛋白激酶 (MAPK)信号通路由Ras/ERK、JNK/SAPK 和 P38三条途径组成[19],也是肝纤维化进程中的主要通路之一,如图 5(d)-(e)所示,在MAPK信号通路中,TGF-β1可以显著诱导p-ERK及p-P38蛋白质的表达 (***p<0.001),Fr.3组分作用后磷酸化表达水平降低 (###p<0.001),但p-JNK无影响。因此,Fr.3组分通过调控多个TGF-β1诱导的信号通路中的蛋白表达水平抑制肝纤维化。

图 5 Fr.3对TGF-β1诱导的CFSC-8B细胞中α-SMA、Col1、p-Smad2、p-AKT、p-ERK及p-P38及蛋白质表达的影响Fig.5 Effect of Fr.3 on expression of α-SMA,Col1,p-Smad2,p-AKT,p-ERK and p-p38 in CFSC-8B cells stimulated by TGF-β1
3 结 语
Lu等研究表明,樟芝菌粉对乙醇诱导的肝损伤有保护作用[20],Song等通过建立四氯化碳诱导的大鼠肝损伤模型,证明樟芝发酵液有保肝活性[21],并且Geng等从樟芝菌粉正己烷提取物中分离出具有抗肝纤维化活性的化合物Antrodin B[8]。有研究表明,肝纤维化是可逆的过程[22],合理治疗可以逆转肝纤维化的进程,从而达到缓减甚至治愈肝纤维化的目的。抑制HSC的活化,使其从活化状态转变为静息状态,是研究抗肝纤维化药物的重要方向之一。
作者以樟芝菌粉中分离得到Fr.3组分为研究对象,在已建立的TGF-β1诱导的细胞肝纤维化模型上,进行了Fr.3组分体外抗肝纤维化活性及作用机制的研究。研究表明,Fr.3组分可显著抑制TGF-β1诱导的CFSC-8B细胞增值及细胞迁移,质量浓度为 20 μg/mL Fr.3组分与阳性药物 SB431542(2 μg/mL)相比,抑制细胞增值及细胞迁移效果相当;Fr.3组分能有效抑制TGF-β1诱导的CFSC-8B细胞 ECM 中 α-SMA、Col1、Col3、Fn 的基因转录及α-SMA和Col1的蛋白质表达水平。
为研究Fr.3组分抗肝纤维化活性机制,考察了Fr.3组分作用后,对TGF-β1诱导的Smad、MAPK以及PI3K/AKT信号通路中相关磷酸化蛋白质的表达水平的影响。研究表明:Fr.3组分可以显著下调TGF-β1诱导的 Smad2、AKT、ERK 及 p38磷酸化蛋白质表达水平,而Smad、PI3K、MAPK信号通路,与肝星状细胞的激活、增值、迁移等有关[14-16]。综上所述,Fr.3组分通过调控 Smad、PI3K、MAPK信号通路,抑制细胞增值、迁移及ECM的积累,进而抑制肝纤维化。王静等在建立的PDGF-BB诱导的肝纤维化模型基础上,研究了樟芝提取物Fr.2组分通过调控MAPK信号通路的转导来抑制肝纤维化[7],因此樟芝不同提取物Fr.2、Fr.3组分都能有效抑制肝纤维化细胞的增值、迁移,Fr.2、Fr.3组分可能是通过调控多种信号通路综合作用抑制肝纤维化。
后期需要对樟芝提取物Fr.3组分进一步分离纯化,分析鉴定Fr.3组分中主要活性化合物,并且建立四氯化碳诱导的小鼠肝纤维化模型,评价其体内抗肝纤维化活性,同时结合体外细胞模型,研究其抗肝纤维化作用机制,为治疗肝纤维化的研究提供理论依据。
