拟粉红锁掷孢酵母降解展青霉素的蛋白质组学
2019-05-25赵利娜孙艺文张晓云张红印
赵利娜, 孙艺文, 张晓云, 张红印
(江苏大学 食品与生物工程学院,江苏 镇江 212013)
展青霉素(Patulin,PAT)又称棒曲霉素,是一种主要由曲霉属、青霉属等产生的有毒的真菌次级代谢产物,主要污染水果及其衍生制品。食用受展青霉素污染的食物和饮料严重威胁人类的健康[1],其可以氧化损伤人类细胞导致致突变性[2]、细胞毒性[3]、致畸性[4]以及遗传毒性[5]等。食品生产中展青霉素的污染十分普遍,广泛存在于桔子、苹果、梨、菠萝、玉米以及谷物等产品中,特别是在苹果及其制品中展青霉素的污染最为严重。
PAT是对人类危害最大的真菌毒素之一[6],可以引起一些急慢性病症及细胞水平病症。动物试验表明,小鼠在注射PAT后会导致皮下组织水肿、呼吸困难、肺充血等急性症状。大剂量的PAT还具有致畸性、免疫毒性、致突变性及遗传毒性。其细胞毒性是由于PAT能改变细胞膜的通透性,导致K+过度流失,抑制大分子物质合成,最终导致细胞活性丧失。食品中污染PAT严重威胁着人类的健康,相关机构已严格限制其含量标准。欧盟规定果汁、果酒(仅以苹果和山楂为原料制成的产品)中PAT的最高限量为50 μg/L,固体苹果产品及其制品中PAT的最高限量为25 μg/L,而婴幼儿食品中PAT的最高限量为 10 μg/L[7];美国食品药品管理局(FDA)规定苹果及其制品中PAT的含量不得高于50 μg/kg[8];苹果及其制品中PAT的限量标准在我国国标中是50 μg/L[9]。因此,控制食品中的PAT,尤其是控制苹果及其制品中PAT的污染,具有十分重要的卫生学意义。
控制苹果中PAT污染的传统方法是使用化学合成杀菌剂。然而,随着化学杀菌剂的持续和大量使用,病原体逐渐产生了抗药性,不仅防治效力降低,而且化学残留也会对食物造成污染。因此,人们迫切需要寻求可替代化学杀菌剂的安全、高效、环保的新方法。近年来国内外的研究表明,部分酵母菌可以直接抑制PAT的产生,有的甚至可以降解PAT。例如:胶红酵母(Rhodotorula mucilaginosa)[10-11]、卡利毕克毕赤酵母(Pichia caribbica)[12]、红冬孢酵母(Rhodosporidium kratochvilovae)[13]等拮抗菌均能不同程度地控制和降解PAT。Castria等[14]的研究表明,初始质量浓度为100 μg/mL的PAT分别与胶红酵母 (R.glutinis)和罗伦隐球酵母(Cryptococcus laurentii)共同培养10 d后,发现PAT的质量浓度分别降低了82%和47%。Zhu等[15]的研究表明,R.paludigenum可以降低苹果体内PAT的含量,同时在体外实验中初始质量浓度为10 mg/L的PAT与酵母培养3 d后已完全检测不到。
作者所在课题组从江苏省镇江市江心洲有机果园筛选得到一株对苹果及葡萄具有高效生物防治效力的酵母菌[16],经鉴定为拟粉红锁掷孢酵母(Sporidiobolus pararoseus Y16)。初步试验发现该酵母菌不仅能够降低苹果由扩展青霉引起的青霉病的发病率,同时还能够降低苹果伤口处PAT的积累,并且在体外能够降解PAT[17],但具体的降解机制尚不明确。作者拟利用蛋白质组学技术对拟粉红锁掷孢酵母体外降解PAT的相关机制进行研究,不仅可以为拮抗菌降解PAT的研究提供一定的理论依据,也将有助于推动生物法控制及降解PAT的实际应用。
1 材料与方法
1.1 主要仪器和试剂
Ettan IPGhor等电聚焦仪、SDS-PAGE电泳仪、Image Scanner扫描仪:美国GE Healthcare公司;UltrafleXtrem MALDI-TOF/TOF质谱仪:美国Bruker Daltonics公司;TS-A型脱色摇床:金坛市中大仪器厂;PHS-3BW酸度计:上海理达仪器厂;UV-6100A型紫外可见分光光度计:上海元析仪器有限公司;GR85DR型全自动高压灭菌锅:致微(厦门)仪器有限公司;恒温摇床:太仓市强乐试验设备厂产品;电子显微镜:江南光学仪器厂产品;高速冷冻离心机:湘仪离心机仪器有限公司产品;血球计数板:购自丹阳市健陵医疗器械公司。
1.2 酵母菌
酵母菌S.pararoseus Y16:作者所在课题组分离鉴定并保存的菌种,于NYDA培养基(酵母浸膏5 g,牛肉膏 8 g,葡萄糖 10 g,琼脂 20 g,无菌水定容至1 L后灭菌)中4℃保存,经NYDB培养基(酵母浸膏5 g,牛肉膏 8 g,葡萄糖10 g,无菌水定容至1 L)活化(28 ℃,180 r/min 摇床培养 20 h)后,7 500 r/min离心10 min,无菌水洗涤两次,用无菌水重新悬浮酵母细胞,血球计数法计数并用无菌水调至所需浓度。
1.3 总蛋白质的提取
经活化后的S.pararoseus Y16用无菌水调整其浓度为1×108个/mL,在20 mL NYDB培养基中加入1 mL S.pararoseus Y16菌悬液,分两组处理:一组添加终质量浓度为5 μg/mL的PAT储备液,另一组添加无菌水作为对照,于28℃、180 r/min摇床培养18 h,4 ℃、10 000 r/min 离心 10 min,并用预冷的无菌水洗涤两次。将菌体加入液氮快速研磨,把菌体粉末倒入50 mL离心管中,加入10 mL TE缓冲液(50 mmol/L),再加入 174 μL 质量浓度为 10 mg/mL的PMSF溶液。加入终质量浓度为50 μg/mL的RNase A 和 200 μg/mL的 DNase,充分振荡,置于冰上静置30 min。于4℃、10 000 r/min离心20 min,取全部上清液,加入2倍体积20%TCA/丙酮溶液(预冷),充分振荡混匀,-20 ℃沉淀过夜(12~16 h)。上下颠倒混匀,于4℃、10 000 r/min离心15 min,弃上清液,之后用预冷的丙酮洗涤沉淀2次。沉淀移至1.5 mL EP管,再加入1 mL丙酮清洗沉淀两次,弃上清液,13 000 r/min离心2 min,置于冰上风干。加入200 μL裂解液溶解蛋白质,并用移液枪不断吹打促溶(冰上)。若蛋白质含量较高,可增加裂解液用量,或相应延长裂解时间。用Barford法[18]测定蛋白质浓度后,置于-80℃保存备用。
1.4 双向电泳
IPG胶条的水化上样:将-20℃保存的IPG(24 cm,pH 3~10)胶条取出,室温放置 30 min。 将水化缓冲液置于室温融化,加入2.8 mg DTT和5 μL IPG缓冲液(pH 3~10),充分混匀。蛋白质上样量为3 mg,与适量水化液吹打混匀,总体积为450 μL。把泡涨盘放入IPG box,样品均匀点到盘中。去掉胶条保护膜,缓缓放到胶条槽中,胶面正对蛋白质样品(避免气泡),保持IPG box水平,室温水化 12~16 h。
第一向等电聚焦 (IEF):水化结束后,将IPG box中的IPG胶条转移至聚焦盘中,胶面朝上,使胶条上的正极对应于聚焦盘上的正极。在胶条两端加盖滤纸片,滤纸片的三分之一压住胶条。将电极丝卡住滤纸片,在胶条上覆盖石蜡油之后,合上盖子。设置IPGphor等电聚焦程序。每根胶条的最大电流50 μA,聚焦温度20℃。等电聚焦参数设置为:①100 V,快速 1 h;②200 V,快速 2 h;③500 V,快速 1 h;④100 V,慢速 2 h;⑤10 000 V,慢速 3 h;⑥10 000 V,快速 6.5 h;⑦500 V,快速 15 h。
第二向SDS-PAGE电泳:配制12.5%的SDSPAGE凝胶。按照GE说明书组装灌胶模具,灌胶后每块胶加入1 mL饱和正丁醇封胶。凝胶凝固后将聚焦结束后的胶条取出,滤纸吸去多余的矿物油。置于泡涨盘中进行平衡,每两根胶条加入10 mL平衡缓冲液I(含0.1 g DTT),将泡涨盘置于水平摇床上,平衡15 min。结束后倒掉多余的平衡液,再等体积加入10 mL平衡缓冲液II(含0.25 g IAM),步骤同第一次平衡。将IPG胶条取出,浸泡于1×电泳缓冲液中。待SDS-PAGE凝胶完全凝固后,将凝胶固定于电泳架上。将低熔点琼脂糖用移液器加入到凝胶上部,将胶条置于凝胶上表面,使其充分贴合,同时避免结合处产生气泡。转入电泳槽进行第二向蛋白质电泳。打开电泳仪,循环水温度17℃,电泳程序1 W/胶条,运行约60 min,待蓝色条带进入凝胶后,电压增加到15 W/胶条,待蓝色条带距离底部1 cm时关闭电泳设备。将凝胶小心转移到染色托盘中。加入适量的染色液置于染色盒中,在水平摇床上室温染色2~3 h。染色结束后,用双蒸水冲洗凝胶,加入脱色液,脱色直至蛋白质点清晰为止。将凝胶扫描分析或4℃保存于7%冰醋酸溶液。
1.5 凝胶图谱分析及质谱实验操作流程
凝胶使用ImageScannerIII扫描仪进行扫描,分辨率600 dpi。使用ImageMaster 7.0软件对凝胶上的蛋白点进行分析。根据分析结果将蛋白质点从凝胶上切下,用蒸馏水洗两次。用NH4HCO3/乙腈(100 mmol/L)脱色,清晰至透明,去除上清液。用乙腈(100%)脱水2次,每次5 min,得到白色胶粒。加入5 μL 胰酶(10 ng/μL)置于 4 ℃中 30~60 min,加入20 μL NH3HCO3(25 mmol/L)缓冲液,37 ℃ 水浴反应过夜。上清液经真空冷冻干燥后,用于蛋白质MS分析。样品使用UltrafleXtrem MALDI-TOF/TOF质谱仪进行检测。
1.6 蛋白质鉴定
肽指纹图谱信息通过FlexAnalysis软件和BioTools软件进行分析。质谱结果利用Mascot本地数据库进行搜索,搜索参数为:NCBInr真菌数据库,酶类是胰蛋白酶,Peptide tol为±0.3,半胱氨酸的氨酰甲基化及甲硫氨酸的氧化修饰。鉴定结果利用MASCOT的 Mowse score。
2 结果与分析
2.1 拟粉红锁掷孢酵母蛋白质双向电泳图
S.pararoseus Y16在未添加PAT和添加PAT的NYDB培养基中分别培养18 h后,收集酵母细胞提取蛋白质进行SDS-PAGE凝胶双向电泳,见图1。通过ImageMaster 7.0分析后,结果表明,添加PAT和未添加PAT的NYDB培养基中S.pararoseus Y16共检测出236个蛋白质点,97种蛋白质表达量有显著性差异,其中68个上调蛋白质,29个下调蛋白质,集中对30种高峰度差异蛋白质进行鉴定。MS/MS质谱分析的数据提交Mascot。30个蛋白质点中有5个没有与数据库中相匹配的信息,鉴定需要进一步确定。
2.2 PAT诱导S.pararoseus Y16蛋白质差异点质谱鉴定结果
表1简述了30个差异蛋白质点的相对分子质量、等电点等基本情况。大多数差异表达的蛋白质与基础代谢有关,还包括一些环境胁迫下产生的应激蛋白,以及多种假设蛋白 (点7,13,17,20,25,26)。 结果表明 PAT 可以激活 S.pararoseus Y16的基础代谢,引起细胞的免疫调节,由于差异表达的蛋白质参与了多种代谢途径,所以S.pararoseus Y16对PAT的反应机制是复杂的。
2.3 差异蛋白质的GO分析
质谱结果在Mascot数据库比对得到蛋白质的基因 ID,通过 Uniprot数据库(http://www.uniprot.org)找到蛋白质相应的GO ID。根据差异蛋白质的GO ID使用Notepad++软件对蛋白质GO信息进行分类。蛋白质的GO信息分为生物过程(Biological process)、分子功能(Molecuar function)、细胞组分(Celluar component)三大功能。对未添加PAT和添加PAT培养导致的 S.pararoseus Y16细胞差异蛋白质进行GO富集分析,见图2。由图2可知,差异蛋白质主要涉及生物过程和细胞组分,少数与分子功能相关。涉及到主要的10种生物过程中参与最多的是细胞过程和代谢过程,其次是应激反应、生物体调节过程、生物附着、色素沉积等;差异蛋白质参与的细胞组成主要包括:细胞组分合成、大分子配合物合成、细胞器组成及膜封闭腔的形成等;在分子功能中,差异蛋白质主要参与结合作用、催化作用、电子载体和结构分子。

图1 未添加PAT和添加PAT的NYDB培养基培养的S.pararoseus Y16蛋白质双向电泳图Fig.1 Two-dimensional pattern of intracellular proteins of S.pararoseus Y16 after cultivation in NYDB or NYDB amended with PAT

表1 未添加PAT和添加PAT的NYDB培养基培养的S.pararoseus Y16差异蛋白质谱肽段在Moscot中的分析结果Table 1 Identification of cellular proteins of S.pararoseus Y16 showing differential expression after cultivation in NYDB or NYDB amended with PAT using MS/MS analysis

续表1
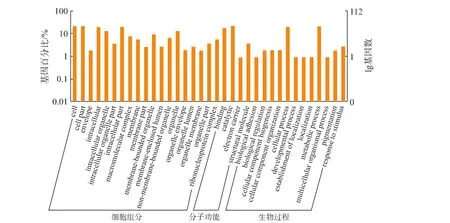
图2 未添加PAT和添加PAT对S.pararoseus Y16细胞差异蛋白质GO分析Fig.2 GO categorization of S.pararoseus Y16 showing differential expression after cultivation in NYDB or NYDB amended with PAT
3 结 语
蛋白质图谱经过IPM7.0软件分析,添加PAT和未添加PAT条件下的S.pararoseus Y16细胞大约检测出总蛋白质236个,97种蛋白质表达量有显著性差异,其中68个上调蛋白质,29个下调蛋白质,对其中30种高峰度差异蛋白质进行了鉴定。差异蛋白质涉及少数抗性相关蛋白质及多种基础代谢相关的酶,包括氨基酸、糖类及能量代谢,说明S.pararoseus Y16在降解PAT的过程中,能增强一些与自身基础代谢及环境胁迫相关的酶,而这些酶可能与降解PAT的机制有关。对差异蛋白质进行GO分析可知,差异蛋白质的功能主要包括:细胞基础代谢、细胞结构、胞内途径、应激反应等。
研究表明,当细胞受到很大环境压力时,它的第一反应就是合成更多的热休克蛋白 (Heat shock protein,HSP)。HSP是一种重要的非特异性细胞保护蛋白质,可以保护基本生理过程中不可或缺的蛋白质,还能分解受损蛋白质,回收合成蛋白质的原材料,维持免疫细胞生存和内环境的稳定,将细胞内正常的生理生化过程维持在稳定状态[19-20]。当病原菌等抗原激活免疫细胞产生免疫应答时,免疫细胞分泌的细胞因子可诱导生成热休克蛋白,其可协同免疫细胞完成一系列的应答过程[21]。图1显示,PAT可以刺激S.pararoseus Y16细胞中Heat shock 70 000 protein(HSP70)(点 8)和 Heat shock protein sks2(点2)表达上调,从而增强细胞对环境的适应能力,启动免疫应答,维持细胞的正常生命活动,由此推测HSP是S.pararoseus Y16降解PAT过程中重要的参与酶之一。
果糖二磷酸醛缩酶 (Fructose-bisphosphate aldolase,FBA)(点 21)是植物中参与糖酵解、糖异生和卡尔文循环的关键酶。Cai等[22]的研究表明,FBA基因在生物和非生物的胁迫反应中具有重要的作用,并调节植物的生长和发育,而番茄FBA家族的扩增结果也表明,FBA基因参与了对低温和高温胁迫的响应,并能增强种子萌发中的耐受性。甘露糖-1-磷酸鸟嘌呤转移酶 (mannose-1-phosphate guanylyltransferase,GDP)(点 11) 属于转移酶家族,参与果糖和甘露糖的代谢。研究表明,GDP可以参与合成甘露糖基甘油酸(Mannosylglycerate,MG),对微生物的渗透压适应和高温稳定性起着重要作用[23]。由图1可以看出,S.pararoseus Y16在降解PAT的过程中,FBA和GDP均显著上调。由此推测S.pararoseus Y16面对PAT造成的环境胁迫时,FBA及GDP可能促进了酵母细胞的糖类代谢,并且增强了S.pararoseus Y16对环境的适应能力,为PAT的生物降解提供了条件。
除抗性相关蛋白质之外,多种与基础代谢相关的酶在S.pararoseus Y16降解PAT的过程中表达量也显著上调。包括1)氨基酸代谢:天冬氨酸转氨酶(Aspartate aminotransferase,AST)(点 19)催化芳香族氨基酸的合成,以天冬氨酸和酮酸为底物,具有高催化活性。2)脂肪酸代谢:β-酮酰基合成酶(beta-ketoacyl synthase)(点 23)是催化丙二酰-ACP(malonyl-ACP)与脂肪酸链缩合的酶,是许多酶系统的组成部分,包括脂肪酸合成酶 (fatty acid synthetase,FAS)以及 6-甲基水杨酸合成酶 (6-methysalicylic acid synthase,MSAS),可以催化乙酰辅酶 A(acetyl-CoA),丙二酰辅酶 A(malonyl-CoA)和NADPH形成长链脂肪酸,而脂肪酸是机体的主要能量来源之一。3)TCA循环:柠檬酸合成酶(citrate synthase,CS)(点 18)是调控酶,催化 TCA 循环中的第一步反应;产生于糖酵解及细胞呼吸作用中的柠檬酸循环;琥珀酸脱氢酶黄素蛋白(succinate dehydrogenase flavoprotein,SDH)(点 15),属于细胞色素氧化酶,在TCA循环中为真核细胞线粒体和多种原核细胞需氧和产能的呼吸链提供电子。
此外,还有多种与代谢相关的蛋白质在S.pararoseus Y16与PAT共培养的过程中被诱导或抑制,包括伴侣蛋白 (Chaperonin Cpn60)(点 3),2,5-二酮-葡萄糖酸还原酶(2,5-diketo-D-gluconic acid reductase)(点 22), 异柠檬酸脱氢酶(isocitrate dehydrogenase)(点 5),异柠檬酸(裂合)酶(isocitrate lyase,ICL)(点 16) 及假设的 UDP-葡萄糖异构酶(putative UDP-glucose 4-epimerase)(点 30)。
由于研究的局限性,对于鉴定出来的蛋白质,只能知道其在代谢过程中的基本功能,而无法验证其在降解PAT过程中的具体作用,这也是在后续研究中尚需努力的方面。
