双调蛋白对小鼠呼吸机相关性肺损伤的保护作用及机制研究
2019-05-24蒙臣王思露钟政王贤裕昌睿杰
蒙臣,王思露,钟政,王贤裕,昌睿杰
对于全身麻醉与呼吸衰竭的病人,机械通气是非常关键的呼吸支持治疗措施[1]。然而当潮气量设定过高时,机械通气本身就会导致肺组织受损而引发呼吸机相关性肺损伤(ventilator-associated lung injury,VALI),严重时可能引起急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)而危及生命[1-2]。目前临床上针对VALI的治疗主要集中在优化机械通气、限制液体输注与抑制炎症反应等方面,但尚无特效措施,因此,寻求新的有效治疗VALI方法的仍然是亟待解决的重要问题[3]。双调蛋白(Amphiregulin,Areg)是一种上皮生长因子,具有抑制细胞凋亡和保护组织器官的作用[4],在过度通气的离体肺组织中Areg有显著表达[5]。然而,Areg对VALI有何作用至今仍不清楚。本研究于2016年9月到2017年5对Areg在VALI中的具体作用及可能机制进行探讨,以期为VALI的治疗提供新的思路和方法。
1 材料与方法
1.1 动物与试剂雄性C57BL/6小鼠(周龄为6~8周,体质量20~24 g)购自武汉大学动物实验中心[动物合格证号:42000900000381;许可证号:SYXK(鄂)2016-0031],ALC-V8S小动物呼吸机购自中国奥尔科特公司,动物处置符合伦理学原则。使用的试剂有:重组小鼠Areg蛋白(rmAreg)(R&D公司,批号989-AR-100)、表皮生长因子受体(EGFR)抗体(Abcam公司,批号ab40815)、磷酸化表皮生长因子(P-EGFR)抗体(CST公司,批号#3777)、蛋白激酶B (AKT)(CST公司,批号#4691)、磷酸化蛋白激酶B(p-AKT)抗体(CST公司,批号#13038)、β-actin抗体(Santa Cruz公司,批号sc-47778)和BCA蛋白检测试剂盒(Thermo公司,批号23250)。另外,Areg(批号DY989)、肿瘤坏死因子-α(TNF-α)(批号MTA00B)与白细胞介素-6(IL-6)(批号M6000B)的酶联免疫吸附实验(ELISA)检测试剂盒购于美国R&D公司,免疫球蛋白M(IgM)的ELISA试剂盒购于中国NeoBioscience公司(EMC129.96),蛋白提取试剂盒KGP250购自中国南京建成公司,二甲基亚砜(DMSO)购于美国Sigma-Aldrich公司,EGFR阻断剂AG1478和AKT抑制剂派立福新(Perifosine)购于美国Selleck Chemicals公司。
1.2 VALI动物模型的制备与分组C57BL/6小鼠经硫喷妥钠(80 mg/kg)麻醉后行气管插管,接小动物呼吸机行大潮气量机械通气制备VALI模型[6]:吸入空气,潮气量12 mL/kg,呼吸频率90次/分,通气维持4 h。rmAreg溶于磷酸盐缓冲液(PBS)中,给予每只小鼠腹腔注射5 μg。小鼠根据随机数字表法随机分为8组:①对照组(Control组),每只腹腔注射PBS 200 μL,维持正常呼吸;②Areg组,腹腔注射rmAreg,维持正常呼吸;③PBS+VALI组,腹腔注射PBS,30 min后行机械通气;④Areg+VALI组,腹腔注射rmAreg,30 min后行机械通气;⑤DMSO+VALI组;⑥DMSO+Areg+VALI组,每只腹腔注射DMSO 100 μL,30 min后腹腔注射PBS或rmAreg,再经30 min后行机械通气;⑦AG1478+Areg+VALI组与⑧Perifosine+Areg+VALI组,每只腹腔注射AG1478 1 mg或Perifosine 1 mg,30 min后腹腔注射rmAreg,再经30 min后行机械通气。
1.3 肺组织病理学检测与肺损伤评分机械通气结束24 h后取小鼠左肺,使用4%甲醛固定,再用石蜡包埋。将肺组织切成5 μm切片,行HE染色,在光学显微镜下观察肺组织病理变化。根据美国胸科协会发布的标准对肺组织实行肺损伤评分[7](评分范围为0~1分),见表1。总评分=[(20×A)+(14×B)+(7×C)+(7×D)+(2×E)]/视野数×100)。

表1 肺损伤的评分标准
1.4 ELISA与BCA蛋白检测在机械通气结束3、6、12、24 h后,根据我们之前的方法行肺泡灌洗[8-9]:分离小鼠气管,将1 mL的PBS从气管缓慢注入肺内,然后慢慢回抽,重复3次,回收的支气管肺泡灌洗液(BALF)体积>2.7 mL视为合格。将收集的BALF用400g离心10 min,收集上清液。严格按照ELISA与BCA蛋白检测试剂盒中的说明书操作,检测BALF中Areg、TNF-α、IL-6、IgM与总蛋白浓度。
1.5 蛋白质印迹法(Western Blot)检测机械通气结束6 h后提取小鼠右侧肺组织蛋白,加入上样缓冲液,于沸水中煮10 min变性。然后行上样、电泳、转膜操作,在5%脱脂牛奶中封闭1 h。分别使用β-acitn、EGFR、P-EGFR、AKT与p-AKT一抗(1∶1 000)于4 ℃中孵育过夜。加入二抗(1∶3 000)孵育1 h,在EC3凝胶成像系统下曝光并拍照,使用Image J软件处理并分析目标条带中的光密度值。
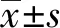
2 结果
2.1 VALI肺组织中Areg的表达与未行机械通气(0 h组)的小鼠相比,在大潮气量机械通气后24 h内,小鼠BALF中的Areg浓度均有明显升高(见图1),其中在机械通气结束后6 h,BALF中的Areg浓度[(231.8±58.7) pg/mL]升高最为显著。
注:与0 h组相比,aP< 0.05,bP< 0.01,cP< 0.001图1 VALI后24 h内小鼠BALF中Areg的浓度变化(n=4)
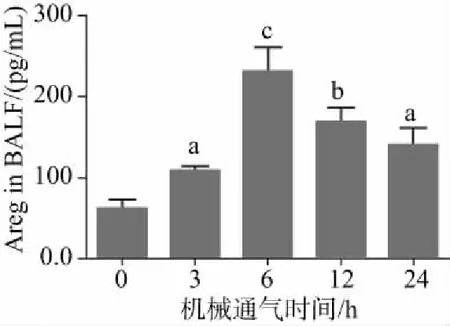
2.2 Areg对VALI肺组织病理变化的影响与Control组相比,单独使用rmAreg对肺组织病理学并无影响(Control组 比 Areg组),见图2A和图2B。但在接受大潮气量机械通气的小鼠中,肺组织肺泡壁显著增厚,中性粒细胞浸润增加,透明膜形成明显,见图2C。而使用rmAreg处理显著减轻了肺组织的肺泡壁厚度、中性粒细胞浸润与透明膜形成(PBS+VALI组 比 Areg+VALI组),见图2D,抑制了肺组织病理学损伤,明显改善了肺损伤评分,见图2E。
注:与Control组相比,aP< 0.001;与PBS+VALI组相比,bP< 0.05图2 Areg对VALI小鼠肺组织病理学及肺损伤评分的影响(HE染色,20×20倍,n=6):A为Control组;B为Areg组;C为PBS+VALI组;D为Areg+VALI组;E为各组肺损伤的比较
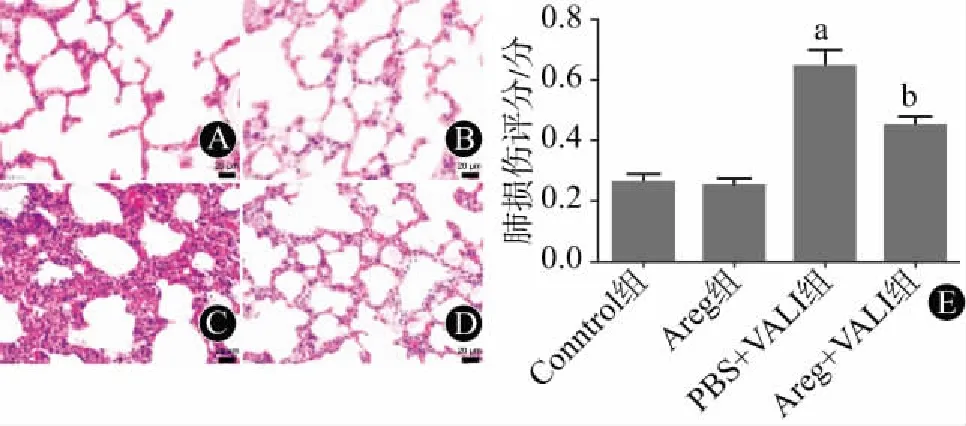
2.3 Areg对VALI肺组织渗透性与炎症反应的影响本实验结果显示,大潮气量机械通气显著增加了小鼠BALF中的TNF-α与IL-6(图3A和图3B)、总蛋白与IgM(图3C和图3D)浓度(PBS+VALI组 比 Control组),而使用rmAreg处理则显著抑制了这些指标的升高(Areg+VALI组 比 PBS+VALI组)。
2.4 Areg对VALI肺组织EGFR与AKT的影响Western Blot的光密度分析显示(图4),与Control组相比,大潮气量机械通气可增加肺组织中的EGFR与AKT磷酸化水平(PBS+VALI组 比 Control组);使用rmAreg处理不仅可以使正常小鼠肺组织中的EGFR与AKT发生磷酸化(Areg组 比 Control组),还可以进一步增加VALI小鼠肺中的EGFR与AKT磷酸化水平(PBS+VALI组 比 Areg+VALI组)。
2.5 AG1478与Perifosine对Areg保护效果的影响分别使用EGFR抑制剂AG1478与AKT抑制剂Perifosine处理小鼠,再检测Areg对VALI小鼠的肺保护作用。HE结果显示(图5A),与DMSO+Areg+VALI组相比,AG1478+Areg+VALI组与Perifosine+Areg+VALI组小鼠肺组织肺泡壁明显增厚,中性粒细胞浸润水平显著增高。BALF中蛋白检测显示(图5B~E),相较于DMSO+Areg+VALI组,AG1478+Areg+VALI组与Perifosine+Areg+VALI组BALF中TNF-α、IL-6、总蛋白与IgM浓度均有明显增加。
注:与Control组相比,aP< 0.001;与PBS+VALI组相比,bP< 0.01图3 Areg对VALI小鼠肺组织炎症反应及渗透性的影响(n=5):A、B、C、D分别为各组BALF中TNF-α、IL-6、总蛋白与IgM的浓度
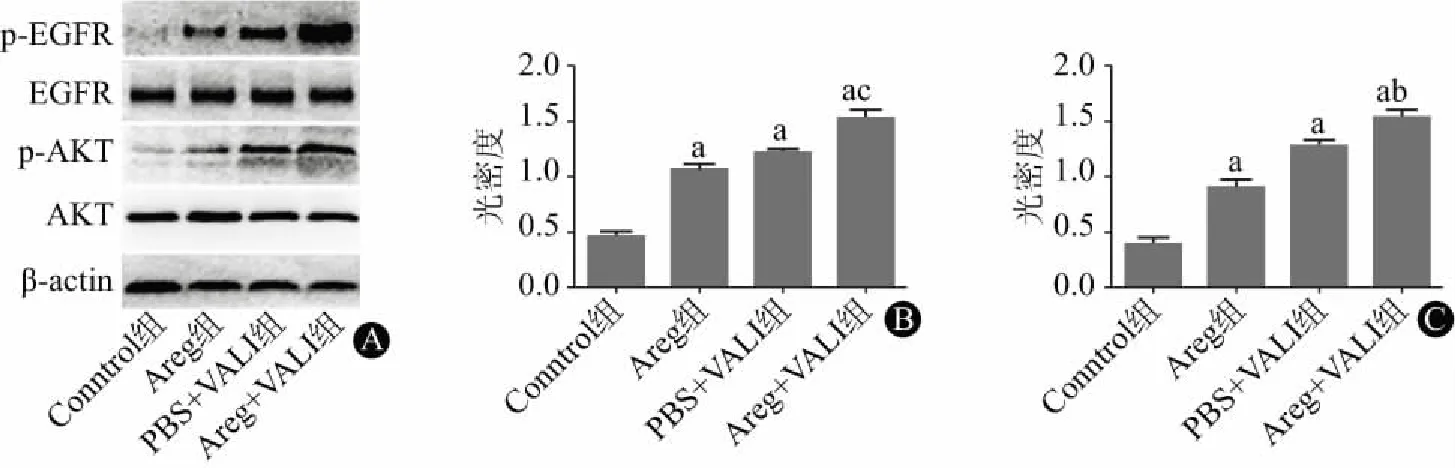
注:与Control组相比,aP< 0.001;与PBS+VALI组相比,bP< 0.05,cP<0.01图4 Areg对VALI小鼠肺组织EGFR与AKT磷酸化的影响(n=5):A为小鼠肺组织中EGFR、P-EGFR、AKT与p-AKT的Western Blot检测结果;B、C分别为P-EGFR/EGFR、p-AKT/AKT的光密度比值
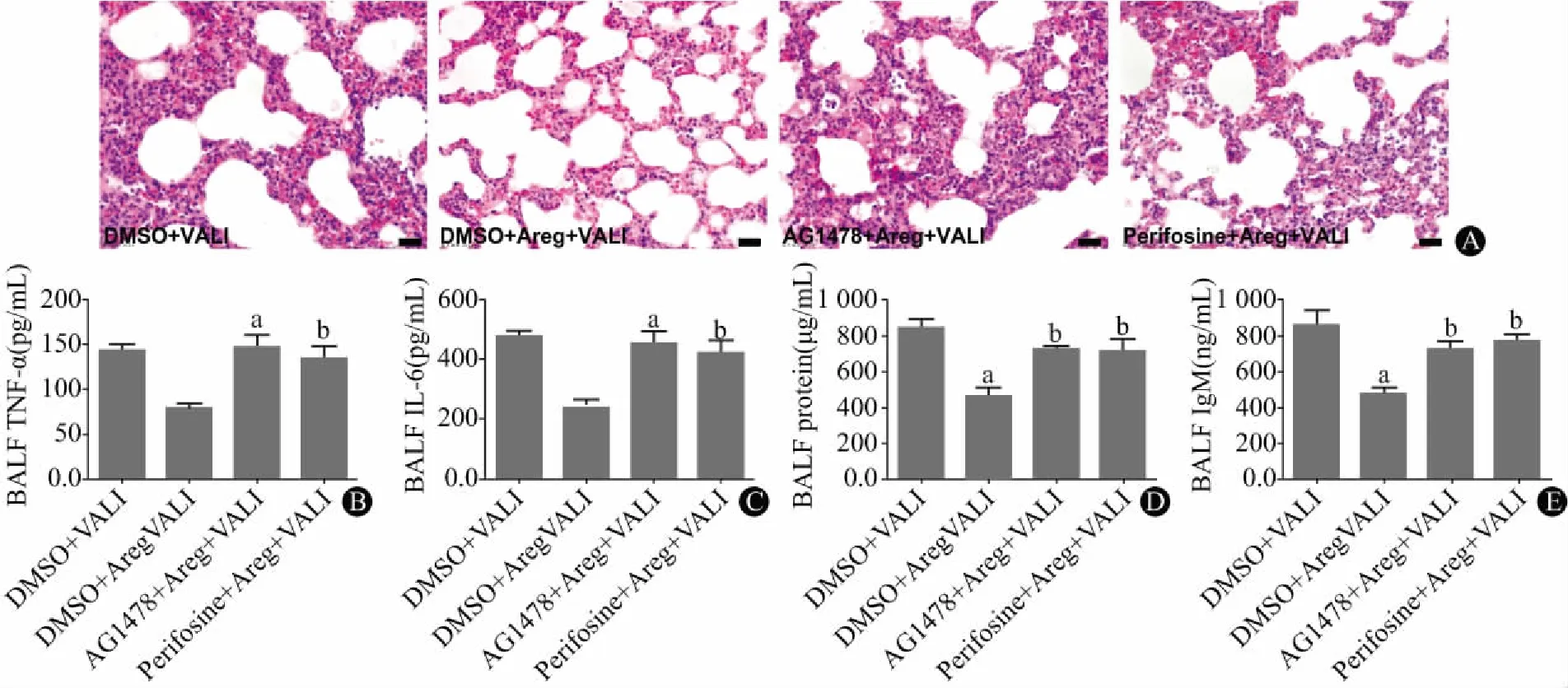
注:与DMSO+VALI组相比,aP< 0.01;与DMSO+Areg+VALI组相比,bP< 0.05图5 AG1478与Perifosine对Areg保护效果的影响:A为肺组织HE染色(20×20倍,n=6);B、C、D、E分别为BALF中TNF-α、IL-6、总蛋白与IgM的浓度(n=5)
3 讨论
早在2006年,Dolinay等[5]就已发现离体肺组织受到过度牵拉后会大量表达Areg,但Areg对VALI的作用一直未被详细阐明。有些研究将Areg作为肺损伤严重程度的一个判定指标[10],暗示了Areg可能有促进肺部损伤的作用。我们之前的研究证实,Areg对细菌内毒素引发的急性肺损伤有保护作用[9]。而在本实验中,我们首次证明了Areg能显著抑制大潮气量机械通气所导致的肺组织损伤。
与内毒素引发的肺组织炎性损伤机制不同,VALI主要是因为大潮气量通气过度扩张肺泡而引起肺泡牵拉受损所致[11]。然而,在损伤效应上VALI与内毒素肺损伤类似,表现为肺组织病理形态异常、通透性增加与炎症反应激活[7]。在本实验中,我们选取了与临床密切相关的大潮气量机械通气(潮气量为12 mL/kg、通气4 h)制作VALI模型[6]。可以看出在行大潮气量机械通气结束24 h后,肺组织有明显的病理损伤,表现为中性粒细胞浸润增加、肺泡壁增厚与透明膜形成等(图2)。而BALF中TNF-α与IL-6、IgM与总蛋白含量的明显升高(图3)也分别证明了肺组织在过度机械通气后炎症反应被大量激活、渗透性显著增加,这些结果证明我们成功制作了VALI模型。
已有离体细胞实验证实,肺泡上皮细胞在受到过度牵拉时会表达Areg[12],而离体的肺组织在行过度通气后Areg的基因水平也有明显升高[5]。我们则在接受了大潮气量机械通气的小鼠BALF中检测到Areg有大量表达,与离体的肺泡上皮细胞与肺组织实验结果一致,这说明过度牵拉会使肺组织中的Areg表达量显著升高。在细菌内毒素引起的急性肺损伤中,Areg来源于经典激活型肺泡巨噬细胞[9],但在VALI中,Areg则很可能来源于被牵拉的肺泡上皮细胞,而这一点还需要在今后的活体实验中进一步证明。
Areg是上皮生长因子(EGF)类家族的一员,能够促进细胞的生存、增殖和分化,因此具有保护损伤组织的作用[4]。研究表明,当肠组织受到炎症伤害时,Areg的产生有助于肠黏膜的保护和修复[13];在肝脏的急性炎症中,Areg的缺失会使肝脏损伤明显加重[14-15]。我们之前也证实了Areg能抑制肺泡上皮细胞凋亡[9]。在本实验中,给予外源性Areg可以大大减轻大潮气量机械通气所导致的肺损伤病理学变化,并显著改善肺组织的通透性与炎症反应,说明了Areg对于VALI肺组织也有明显的保护作用。
本实验中,我们发现在VALI发生6 h后,肺组织中的Areg表达升高最为显著。而EGFR是Areg的唯一受体[16],在肺组织中有广泛表达。活化的EGFR可激活调节细胞生存的磷脂酰肌醇3-激酶(PI3K)-AKT通路[17]。因此,我们选择在VALI发生后6 h检测EGFR与AKT的活化水平。结果显示,EGFR与AKT均有明显的磷酸化,与我们之前在内毒素诱导的肺损伤小鼠中所观察的结果一致[9]。在内毒素刺激后,肺组织中的EGFR能被自身大量表达的Areg所激活。VALI发生后,肺组织中的Areg表达量也有明显升高,因此,VALI肺组织中EGFR与AKT的磷酸化很可能也是由分泌的Areg所引起。本实验还发现,给予外源性Areg处理后,VALI肺组织中的EGFR与AKT磷酸化进一步加强了。研究已证实,EGFR-AKT能显著增强细胞的生存能力,如在肝细胞中,抑制AKT后,Areg对抗细胞凋亡的能力明显降低[18],说明AKT是Areg-EGFR通路发挥保护作用的重要组成部分。而且AKT的磷酸化水平与急性肺损伤的伤害程度密切相关[19]:当肺组织的AKT激活水平降低后,肺组织的损伤程度会明显加重;而且AKT的活化能直接促进肺泡上皮细胞的生存[20]。为了验证EGFR-AKT通路对Areg肺组织保护作用的影响,我们分别使用EGFR阻断剂AG1478[21]、AKT抑制剂Perifosine[22]做预处理,再行Areg干预。结果显示,抑制EGFR与AKT几乎消除了Areg对VALI肺组织病理损伤、炎症反应及渗透性变化的负性调控作用。因此,EGFR与AKT的活化是Areg在VALI中发挥保护作用的主要机制。
综上所述,本研究确认了活体肺组织在受到大潮气量机械通气后会大量表达Areg,并首次发现Areg能够通过激活EGFR-AKT通路减轻大潮气量机械通气所引发的肺损伤,表现为减轻肺组织病理学变化与渗透性、抑制炎症反应,因此证明了Areg在VALI中具有明显的保护作用。
