CT纹理分析鉴别胃肠道间质瘤c-kit/PDGFRA基因突变的初步研究
2019-05-24任采月王升平张盛箭彭卫军
任采月,王升平,任 敏,刘 壮,张盛箭,彭卫军
1. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032;
2. 复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是起源于胃肠道Cajal细胞或与Cajal细胞同源的间叶干细胞的梭形细胞肿瘤,大多数因80%~85%的c-kit和5%~10%的血小板源性生长因子受体α(platelet-derived growth factor receptor alpha,PDGFRA)基因功能获得性突变所致[1]。甲磺酸伊马替尼(imatinib mesylate,STI-571,Gleveec)可选择性抑制原癌基因c-kit及PDGFRA,已成为治疗手术难以切除、中高危风险GIST或转移复发患者的一线分子靶向药物[2]。研究证实,GIST有无基因突变及突变类型与靶向治疗的剂量选择及疗效密切相关,如PDGFRA突变型GIST对伊马替尼的敏感性比c-kit突变型稍差;c-kit外显子9突变患者推荐使用双倍剂量伊马替尼(800 mg/d);PDGFRA外显子18突变型GIST对伊马替尼原发耐药等[3-4]。因此,治疗前的正确病理学诊断和基因检测对临床制订个体化治疗方案及疗效评估具有重要指导价值。CT作为GIST的首选影像学检查方法,可对其恶性程度进行初步评估,但对分子层面上的精准诊断及分类价值有限。纹理分析(texture analysis,TA)通过定量分析肿瘤区域内像素信息,可提供大量肉眼无法识别的内部特征,从而更加全面、客观地反映肿瘤潜在的生物学特性及微观异质性程度,在肿瘤影像学诊断中的应用逐渐广泛[5-7]。本研究旨在探讨CT纹理分析鉴别c-kit与PDGFRA突变型GIST的价值,以期为GIST个体化治疗提供依据。
1 资料和方法
1.1 研究对象
回顾性分析2011—2017年间复旦大学附属肿瘤医院符合以下标准的患者资料。纳入标准:①经复旦大学附属肿瘤医院手术后病理学检查证实为GIST者,组织标本均行基因检测;② 术前有完整增强CT影像学资料;③ 患者检查前未经手术、化疗及放疗等任何治疗。排除标准:① 既往间质瘤或其他肿瘤病史;② 图像质量不佳或肿瘤体积过小(<2 cm)而影响病灶分割。共140例患者纳入研究,其中男性77例,女性63例,平均年龄(58.00±9.31)岁。
1.2 影像学检查方法
患者检查前常规禁食4~6 h,扫描前30 min饮水500~800 mL,扫描前再饮1 000 mL,以充盈胃肠道。采用SIEMENS Somatom Sensation 64层螺旋CT进行平扫及动态增强扫描,管电压120 kV,管电流250~300 mA,层厚、层距为1.5 mm。增强扫描采用非离子型对比剂碘海醇(300 mgI/mL),剂量1.5~2.0 mL/kg,注射速率2~3 mL/s。注射对比剂后60 s行门静脉期扫描,扫描范围包括所有病变区域。将图像上传至影像归档和通信系统(Picture Archiving and Communication Systems,PACS)工作站。考虑到病灶部位不同,而所有病灶在门静脉期显示最清晰,为确保结果的准确性及一致性,本研究只选取肿瘤CT门静脉期图像进行纹理分析。
1.3 病理学诊断及基因检测方法
病理学诊断以组织形态学符合典型GIST表现和免疫组织化学染色检测CD117和(或)CD34阳性为标准,基因突变检测采用聚合酶链反应(polymerase chain reaction,PCR)扩增-直接测序法[8]。病理及基因检测结果均由2名病理科医师审核。
1.4 图像分割与纹理特征提取
采用LIFEx3.40软件对CT图像进行纹理分析。由2名分别具有3年和13年工作经验的放射科医师在不知病理学检查结果的情况下,选取肿瘤最大层面沿病灶轮廓勾画感兴趣区(region of interest,ROI),意见不同时通过讨论取得一致(图1)。ROI的选取尽量包括全部肿瘤,同时避开血管、钙化及气体。软件自动计算得到41个如下参数[9]。① 2个形态特征:球形度、密实度;② 8个灰度直方图特征:偏度、峰度等;③ 6个灰度共生矩阵(gray-level cooccurrence matrix,GLCM)特征:同质性、自相关等;④ 11个灰度行程矩阵(gray-level runlength matrix,GLRLM)特征:短行程因子、长行程因子、行程百分比等;⑤ 2个邻域灰度区别矩阵(neighborhood gray-level different matrix,NGLDM)特征:粗糙度、对比度;⑥ 11个灰度区域矩阵(gray-level zone length matrix,GLZLM)特征:短区域因子(short-zone emphasis,SZE)、长区域因子、区域百分比(zone percentage,ZP)等。

图1 ROI放置及纹理特征提取
1.5 统计学处理
使用SPSS 23.0软件进行统计学分析。对两组纹理特征进行正态性和方差齐性检验,符合正态分布的计量资料以s表示,不符合正态分布的数据以中位数及四分位数间距表示。采用独立样本Mann-Whitney U检验(偏态分布)或t检验(正态分布)比较两组间的差异,P<0.05为差异有统计学意义。采用受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,ROC)评价各纹理参数鉴别c-kit与PDGFRA突变型GIST的效能。
2 结 果
126例为c-kit突变型,14例为PDGFRA突变型。两组患者之间性别及年龄差异均无统计学意义(P>0.05,表1),与文献[10]报道一致。c-kit突变型GIST的SZE、短区高灰度级因子(short-zone high gray-level emphasis,SZHGE)、ZP均高于PDGFRA突变型GIST(P<0.05,表1)。其余纹理参数在两组间差异无统计学意义(P>0.05)。SZE、SZHGE、ZP鉴别两者的AUC分别为0.69(95% CI:0.56~0.81)、0.70(95% CI:0.58~0.83)及0.71(95% CI:0.58~0.85)(P<0.05,图2),灵敏度分别为46.03%、47.62%及78.57%,特异度分别为92.86%、92.86%及64.29%,准确率分别为83.57%、83.57%及90.00%。

图2 SZE、SZHGE、ZP鉴别c-kit与PDGFRA突变型GIST效能的ROC曲线
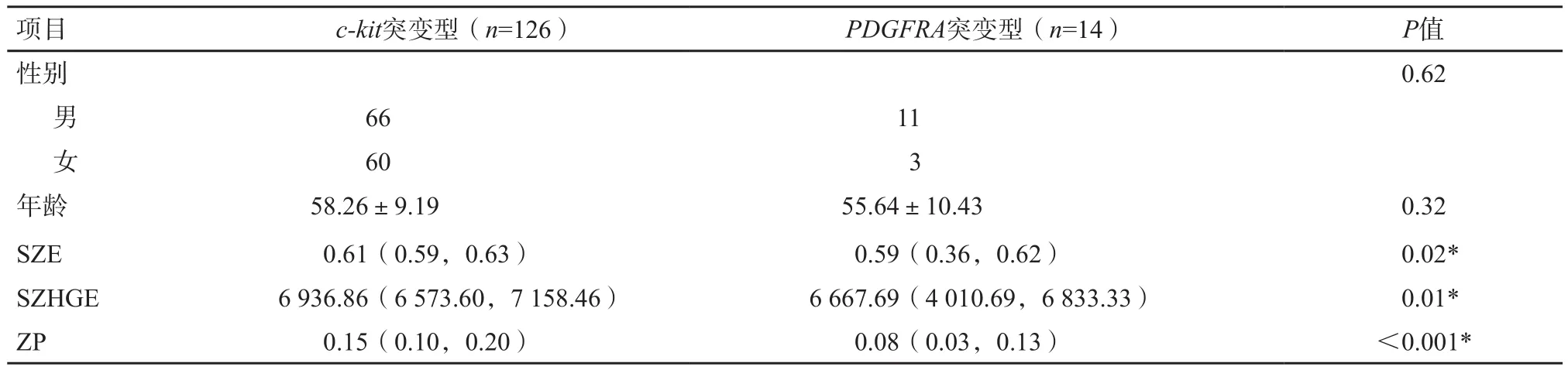
表1 c-kit/PDGFRA突变型GIST患者基本信息及纹理特征值比较
3 讨 论
近年来随着分子病理学研究的深入,GIST已成为靶向治疗实体肿瘤的典范,基于不同基因突变类型的靶向治疗是其主要治疗模式[11]。病理学活检是术前检测基因突变类型的较准确的手段,但不恰当的操作可能引起肿瘤破溃、出血,增加肿瘤播散的危险性;且取材组织较少或部位不理想时,诊断难度较大[12]。研究表明,肿瘤的纹理特征与微观基因、蛋白质及分子改变存在联系,在肺癌、直肠癌、乳腺癌等基因检测及受体表达中有重要辅助价值[13-15]。目前,纹理分析方法在GIST中的研究较少,且多集中于探讨纹理特征与GIST生物学行为之间的关系[16],尚缺乏在分子层面的应用研究。本研究通过对CT门静脉期图像进行纹理分析,获得相关参数,可初步判断GIST基因突变类型,准确率较高。
本研究结果表明,SZE、SZHGE及ZP值在c-kit突变型GIST患者中较高。其中SZE和SZHGE分别描述图像中短均匀区域及高灰度级短均匀区域的分布情况,值越大,肿瘤ROI的纹理越短,灰度值越高;ZP描述图像中均质带的均匀性,值越大,ROI内纹理越均匀。这一结果表明,c-kit突变型GIST患者的CT图像较PDGFRA突变型纹理更短,灰度值更高,纹理分布更均匀。c-kit和PDGFRA均为酪氨酸激酶受体超家族成员,但c-kit突变型与PDGFRA突变型GIST在组织学上表现各异。前者组织学上特异性表现为梭形细胞,细胞较一致,呈长梭形或短梭形,胞质丰富,嗜酸性,多呈旋涡状或束状交织排列;后者组织学上常表现为上皮样细胞或混合型,细胞呈圆形或卵圆形,胞质宽而嗜酸或透明,细胞境界清楚[17]。本研究结果显示,c-kit突变型GIST患者CT图像的纹理较短,推测可能与细胞形态有关;灰度值较高,可能与胞质较为丰富有关;纹理分布更均匀,可能与细胞排列方式及组成成分有关。Shen等[18]研究表明,SZE是宫颈鳞状细胞癌与非鳞状细胞癌之间唯一有差异的纹理特征;本研究也提示SZE可能与肿瘤的基因表达有关。目前,国内外对SZHGE及ZP与肿瘤微观改变之间关系的研究尚不透彻,仍需进一步探索。
本研究存在以下不足:① 仅包括c-kit/PDGFRA突变型GIST,以后将纳入更多其他突基因变类型的GIST患者,并与临床及实验室资料、CT影像学特征等相关联。② 仅基于CT门静脉期图像进行纹理分析,结合延迟期及多期图像是否能提高诊断效能,仍需进一步研究。
综上所述,CT纹理分析无创、简便、可重复,可用于GIST治疗前基因突变类型的检测,有助于临床治疗方案的制订,也可为患者的预后判断提供参考信息。
