超声造影在细针抽吸活检不能明确诊断的甲状腺结节中的应用
2019-05-24杨德斌姚晓华王迎春
周 洁,杨德斌,姚晓华,王迎春
上海健康医学院附属嘉定区中心医院超声科,上海 201800
近年来,随着超声检查在甲状腺结节诊断中的普及,恶性结节的检出率明显增加[1-2]。超声引导下细针抽吸活检(fine-needle aspiration biopsy,FNAB)被认为是诊断甲状腺结节良恶性的“准金标准”[3-4],然而,仍有一定的局限性[5]。超声造影(contrast enhanced ultrasound,CEUS)是甲状腺的另一项无创诊断技术[6-7],但目前CEUS用于FNAB不能明确诊断的甲状腺结节研究仍然较少。因此,本研究回顾性分析FNAB不能明确诊断的甲状腺结节的CEUS资料,旨在为临床术前准确判断甲状腺结节的良恶性提供新方法。
1 资料和方法
1.1 研究对象
选取2016年1月—2018年12月于上海健康医院附属嘉定区中心医院就诊,超声检查怀疑恶性且经FNAB无法明确诊断的患者56例,其中男性20例,女性36例,年龄23~69岁,平均年龄(47.43±12.22)岁。细胞学检查结果根据Bethesda分类标准分为6类:将Bethesda Ⅰ、Ⅲ、Ⅳ、Ⅴ类定义为细胞学无法明确诊断;将Bethesda Ⅵ类定义为细胞学恶性诊断标准;Bethesda Ⅱ类为细胞学良性诊断标准[8]。共发现62个结节。所有患者均进行CEUS检查,最后经手术后病理学检查明确诊断。
1.2 仪器和方法
采用TOSHIBA Aplio 400超声成像仪,PLT-1005BT线阵探头,频率为5~10 MHz。CEUS检查:造影剂选用SonoVue,将预先配好的造影剂混合液经肘正中静脉团注1.5 mL/次,然后用5 mL的0.9% NaCl溶液冲管。同时启动计时键,嘱患者平静呼吸,实时动态观察结节的CEUS增强模式。观察时间1 min,动态存储图像,记录结节内造影剂灌注的过程。对于多发病灶,15 min后再次用同样方法行CEUS检查。分析病灶增强模式,以不均匀低增强作为甲状腺癌的CEUS特征,将等增强、高增强、环状增强及无增强作为甲状腺良性结节的CEUS特征[9]。根据甲状腺结节大小和形状,逐帧手动调整感兴趣区(region of interest,ROI),并勾勒周围甲状腺组织作为参考区,应用时间-强度曲线(time-intensity curve,TIC)获得结节和周围组织造影参数,包括峰值强度(peak intensity,PI)、达峰时间(time to peak,TTP)及曲线下面积(area under curve,AUC),并计算△PI、△TTP及△AUC(△PI、△TTP及△AUC为结节与周围甲状腺组织PI、TTP及AUC的差值)。
1.3 统计学处理
采用SPSS 17.0软件进行统计学分析。其中计量资料以s表示,组间比较采用t检验,分类变量以n(%)表示,组间比较采用χ2检验。利用MedCalc绘制受试者工作特征(receiver operating characteristic,ROC)曲线评价造影模式及不同造影参数诊断甲状腺结节的价值,AUC比较采用Z检验。P<0.05为差异有统计学意义。
2 结 果
2.1 病理学检查结果
FNAB不能明确诊断的结节共62个(表1),经手术后病理学检查证实良性结节32个、恶性结节30个,恶性率48.39%。具体细胞学分型为:①BethesdaⅠ类,乳头状癌4个、结节性甲状腺肿伴纤维化钙化5个、滤泡性腺瘤1个;② Bethesda Ⅲ类,乳头状癌5个、结节性甲状腺肿15个、慢性弥漫性淋巴细胞性甲状腺炎7个;③ Bethesda Ⅳ类,甲状腺滤泡性癌2个、滤泡性腺瘤2个;④Bethesda Ⅴ类,乳头状癌19个(图1B~C)、结节性甲状腺肿2个。
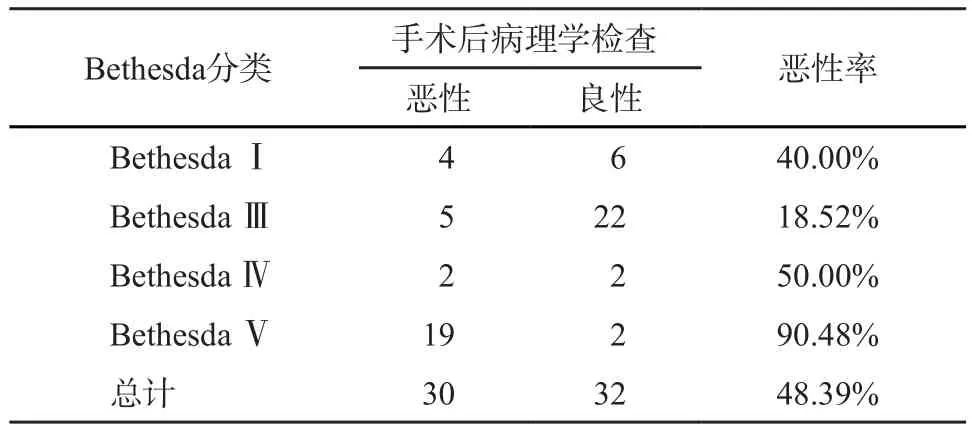
表1 FNAB不能明确诊断的患者病理学结果(n)
2.2 CEUS诊断效能
FNAB不能明确诊断的结节中,不均匀性低增强34个,确诊甲状腺癌25个(图1D);环状增强、等增强及高增强共28个,无增强0个,确诊甲状腺癌5个(表2)。CEUS增强模式诊断甲状腺癌的AUC为0.776(95% CI:0.652~0.872,Z=5.191,P<0.000 1),差异有统计学意义。其灵敏度83.33%,特异度71.88%,准确率77.42%(图2)。
TIC定量分析显示,甲状腺良恶性结节TTP差异无统计学意义(P>0.05),甲状腺恶性结节的△TTP、PI均低于良性结节(P <0.05),AUC、△PI及△AUC均显著低于良性结节(P <0.000 1,表2,图1E~F)。TTP、PI、AUC诊断甲状腺癌的AUC分别为0.543(95%CI:0.411~0.670,Z=0.566,P=0.571 2)、0.574(95% CI:0.442~0.699,Z=0.954,P=0.339 9)、0.601(95% CI:0.469~0.723,Z=1.329,P=0.184 0),差异均无统计学意义;△TTP、△PI及△AUC诊断甲状腺癌的AUC分别为0.651(95% CI:0.519~0.767,Z=2.111,P=0.034 8)、0.863(95% CI:0.751~0.937,Z=7.907,P<0.000 1)及0.799(95% CI:0.768~0.890,Z=5.284,P<0.000 1),差异均有统计学意义。以△PI诊断甲状腺癌的AUC最大,最佳诊断截点≤-0.8 db,灵敏度为83.33%、特异度为78.12%,准确率为80.62%,诊断效能优于增强方式(Z=2.306,P=0.021 1)、△TTP(Z=3.252,P=0.001 1),差异有统计学意义,但与△AUC差异无统计学意义(Z=1.328,P=0.184 2,图2)。

表2 FNAB不能明确诊断的患者CEUS结果
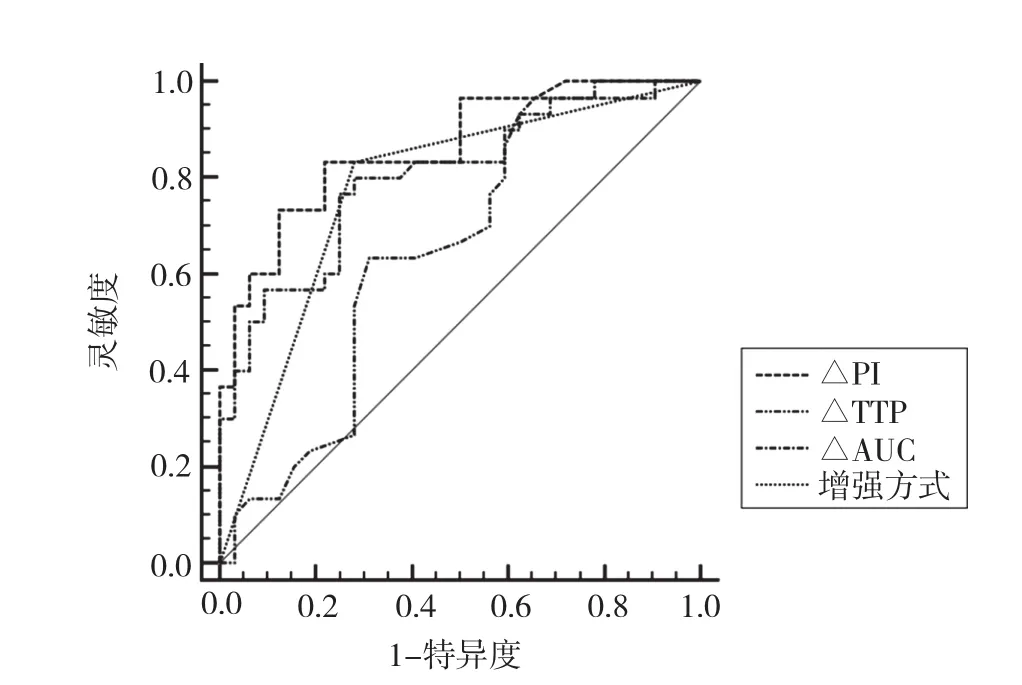
图2 CEUS诊断甲状腺结节的ROC曲线
3 讨 论
常规超声检查是应用最广泛、临床依赖程度最高的诊断甲状腺结节的影像学方法,主要依据形态、边界、低回声、纵横径、声晕及微钙化等征象评估结节的良恶性[10],但良恶性结节超声表现复杂多样,具有一定的交叉、重叠性[11]。为获得更精确的病理学诊断以指导治疗,国内外多项指南及专家共识推荐对可疑恶性结节行FNAB[1,12]。FNAB是公认的一种安全的诊断甲状腺结节良恶性的方法,对结节危险分层和治疗方案的制订有重大意义。然而,FNAB的主要缺点是取材不满意及细胞学不确定的诊断结果[8,13],有报道其给出的不确定性诊断结果中最终确诊为恶性结节者高达52.3%[8],本研究也得到类似结果,恶性率为48.39%。因此,对于不能明确诊断的结节如何管理,选择第2次FNAB还是诊断性手术?有文献报道,大约50%的结节经第2次FNAB仍无法明确诊断[14],而采取诊断性手术,无疑会造成患者的心理及经济负担。因此,应寻求一种无创检查手段,以减少不必要的手术。
CEUS是一种血池成像技术,可以实时动态地观察甲状腺结节的灌注过程,近年来用于鉴别甲状腺结节良恶性,但鉴别诊断价值存在不少争议[6,11],目前还没有国际公认的参考标准。因此,本研究比较了FNAB不能明确诊断的甲状腺结节的灌注模式和定量参数,以寻找最佳诊断方式。首先,定性分析结节灌注模式,发现良恶性结节灌注模式存在差异,以不均匀性低增强诊断甲状腺癌的灵敏度达83.33%,与多数研究结果一致[6,15-16],但特异度和准确率不高。定量参数显示,良恶性结节间的TTP无差异,与谷芬等[7]研究结果相似。PI、AUC虽存在差异,但ROC曲线分析显示无意义,可能是因为个体差异或甲状腺自身病变引起腺体血流改变造成。为进一步减少个体差异等因素的影响,本研究比较了病灶与周围组织之间各参数差值。结果显示,恶性结节△PI及△AUC均低于良性结节,而△TTP高于良性结节。为了进一步明确其临床价值,ROC曲线分析显示△PI、△TTP及△AUC均可作为甲状腺癌的评价指标,以△PI诊断效能最佳,AUC达0.863,且优于定性分析结果。分析原因,认为良性结节血供成熟,△PI多表现为正值或较小的负值,较小的负值灌注模式表现为低灌注,从而影响灌注模式的诊断效能。恶性结节内部血管网络易被破坏,造成局部坏死,△PI则多表现为较大的负值,因此笔者认为,结节△PI表现为较大的负值。且FNAB结果为Bethesda Ⅴ,应积极手术治疗。然而,部分出血后皱缩结节因纤维化、钙化也表现为较大的负值,对于此类结节,需重视对患者既往资料的综合分析。
本研究有一些局限性。① 仅为回顾性分析,结果需要通过对非手术人群的前瞻性研究来证实;② 患者选择仅为FNAB不能明确诊断者,选择偏差不可避免;③ 未针对结节大小与增强特征及造影参数进行细致探讨;④ 样本量不够大,需要扩大样本量进行验证。
综上所述,本研究证明CEUS可为FNAB不能明确诊断的甲状腺结节提供额外的评价标准,定量分析△PI具有更高的诊断效能。因此,CEUS可作为FNAB不能明确诊断的甲状腺结节的术前评估重要手段。
