锌离子螯合修饰河蚬抗氧化肽的工艺
2019-05-23刘晶晶徐蕴桃林秋逸贲蕾洁韩曜平王雪锋
刘晶晶,徐蕴桃,林秋逸,贲蕾洁,韩曜平,王雪锋
常熟理工学院生物与食品工程学院(常熟 215500)
河蚬(Corbicula fluminea)是一种环境适应能力极强的双壳类软体水生生物,遍及全国各地,分布十分广泛,而且资源丰富,产量极高。河蚬通常栖居在咸淡水、淡水水域内,它们的生长速度快,繁殖能力强,含有种类齐全的氨基酸,其脂肪品质高,富含EPA和DHA,还含有钙、钠、钾、镁、铁、锌、铜和锰等多种无机盐[1]。但目前我国对河蚬的加工利用率较低,主要以鲜食作为食用途径,也有一小部分被制成蚬干、咸蚬、罐头等廉价食品,与一些沿海国家如日本、韩国相比,我国的河蚬深加工技术还很落后,没有体现出其应有的经济价值[2]。
近年来兴起的蛋白质水解物与锌离子螯合,其原理是两个氨基酸分子挟制着一个锌离子,形成超稳固的螯合状态,然后利用氨基酸通路使机体同时吸收锌和氨基酸,能很大程度上增加其吸收率[3]。多肽锌螯合物具有抗氧化能力、抗菌效果、降血脂和降血糖等功能[4],包括鲢鱼、带鱼、罗非鱼等水产品以及金针菇、红豆、大豆等农副产品,其多肽金属螯合物已被证明具有不同程度的抗氧化性[5-10],因此,螯合物具有极大的研究潜能和广阔的应用市场。但是以河蚬蛋白为原料进行酶解反应再利用螯合技术制备多肽锌的研究还寥寥无几。试验将河蚬抗氧化肽与锌离子螯合,探究其最佳的螯合工艺条件。旨在开发新型抗氧化剂、锌补充剂,拓展河蚬的深加工途径、提高河蚬产品的品质和附加值,为河蚬螯合物的研究提供了有力的理论依据,为河蚬的研究开辟了一个新的方向。
1 材料与方法
1.1 材料与设备
河蚬肉,宿迁楠景水产食品有限公司;中性蛋白酶(蛋白酶活力不小于60 000活力单位/g),上海奥宇生物科技有限司公司;七水合硫酸锌、无水乙醇、双硫腙、盐酸、氢氧化钠、EDTA、氨水缓冲液、铬黑T和溴化钾,均为分析纯。
EL 104型电子分析天平,梅特勒托利多仪器(上海)有限公司;UV-754型紫外分光光度计,上海市精密科学仪器制造有限公司;BCD-216 TDXZA型超低温冰箱,海尔股份有限责任公司;HH-4型数显恒温水浴锅,常州市国华电器制造公司;ALPHA 1-4型冷冻干燥机,德国Martin Christ冻干机制造公司;TGL-20 M型高速台式冷冻离心机,长沙市湘仪有限责任公司;PHS-2 F型数字pH计,上海市精密科学仪器制造有限责任公司;DF-101 S集热式恒温磁力搅拌器,常州市万合仪器制造有限公司。
1.2 试验方法
1.2.1 河蚬抗氧化肽的制备[11]
速冻河蚬肉于常温的流水下解冻洗去泥沙等杂质,挤干称量。在高速组织捣碎机中添加2倍质量的纯净水进行匀浆,在匀浆液中加入3.76%的中性蛋白酶。于55.36 ℃的水浴锅内酶解4 h,酶解完成后煮沸20 min。冷却后以4 000 r/min的转速进行离心30 min,上清液进行冷冻干燥,即可制得河蚬抗氧化肽,冷藏待用。
1.2.2 锌离子螯合修饰河蚬抗氧化肽的单因素试验
准确称取1.2.1小节制备的河蚬抗氧化肽,配制河蚬抗氧化肽质量浓度为10 mg/mL,与一定量的硫酸锌在不同的pH和温度条件下螯合,用磁力搅拌的方式构建螯合环境,螯合结束后,在4 000 r/min的条件下离心20 min,加入无水乙醇洗涤直至双硫腙检测上清液不变色(4~5次),分别测定螯合率,考察各因素对螯合率的影响。
1.2.2.1 pH的筛选
称取适量的河蚬抗氧化肽粉末配制成10 mg/mL溶液,调节不同的pH(4,5,6,7和8)。在河蚬抗氧化肽与锌离子质量比为2.0︰1,螯合时间为45 min,螯合温度为45 ℃的条件下螯合,螯合结束后测定其螯合率,从而筛选最合适的pH。
1.2.2.2 抗氧化肽与锌离子质量比的筛选
称取适量的河蚬抗氧化肽粉末配制成10 mg/mL溶液,在pH为6,固定多肽液的浓度,按照多肽与锌离子的质量比分别为1.0︰1,1.5︰1,2.0︰1,2.5︰1,3.0︰1称取相应的七水合硫酸锌,在螯合时间为45 min,螯合温度为45 ℃的条件下螯合,螯合结束后测定其螯合率,从而筛选最合适的质量比。
1.2.2.3 螯合时间的筛选
称取适量的河蚬抗氧化肽粉末配制成10 mg/mL溶液,在pH为6,抗氧化肽与锌离子质量比为2.0︰1的条件下,调节不同的螯合时间(15,30,45,60和75 min)。螯合温度为45 ℃,螯合结束后测定其螯合率,从而筛选最合适的螯合时间。
1.2.2.4 螯合温度的筛选
称取适量的河蚬抗氧化肽粉末配制成10 mg/mL溶液,在pH为6,抗氧化肽与锌离子质量比为2.0︰1,螯合时间为45 min的条件下,调节不同的螯合温度(15,30,45和60 ℃),螯合结束后测定其螯合率,确定最佳的螯合温度。
1.2.3 响应面试验
在单因素试验的基础上,采用Design-Expert 8.0.6来进行试验设计与数据处理,以pH(A)、抗氧化肽与锌离子质量比(B)、螯合时间(C)和螯合温度(D)为自变量,螯合率(Y)为响应值,设计抗氧化肽-Zn2+螯合的响应面分析试验,其编码水平和因素见表1。
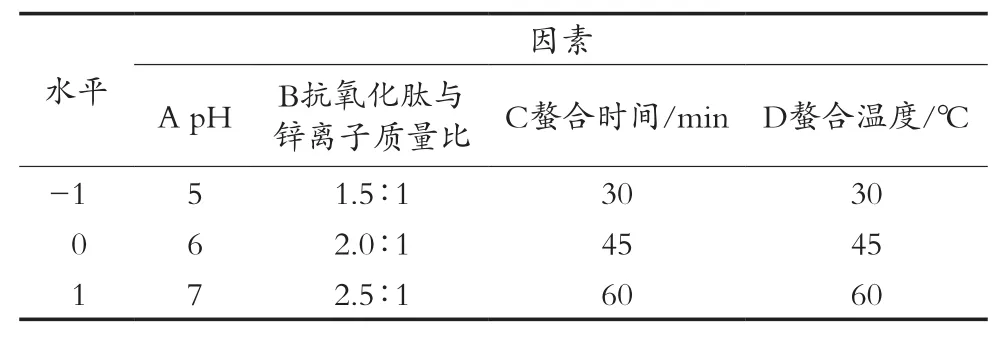
表1 响应面试验因素与水平
1.2.4 傅立叶红外光谱分析
分别取适量固体样品河蚬抗氧化肽和1~1.5 mg螯合物,加入干燥好的KBr作稀释剂,样品与溴化钾的比约为1︰200,放进玛瑙研钵中,在玛瑙研钵里进行研磨,直至样品粒子成细小而均匀状态,再压至透明薄片,将薄片放入样品架,用傅立叶变换红外光谱仪在4 000~400 cm-1光谱范围进行扫描,得到两组光谱,进行定性分析。
1.2.5 螯合率的测定方法
参考文献[12]进行改动。螯合率按式(1)进行计算:
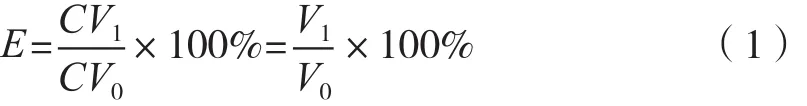
式中:E为螯合率,%;C为EDTA标准溶液的浓度,mol·L-1;V1为滴定螯合态锌离子所消耗的EDTA溶液体积,mL;V0为滴定锌离子的总量所消耗的EDTA溶液体积,mL。
1.2.6 数据统计分析
所有试验均需进行不得少于3次的平行试验以降低误差,用Microsoft Excel软件进行数据处理与分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 pH的筛选试验
从图1可以看出,随着反应溶液pH的增加,河蚬抗氧化肽螯合率逐渐升高,当反应pH增加到6时,抗氧化肽的螯合率达到最大;继续增加反应pH,螯合率又呈下降趋势。蛋白质具有最适的pH范围,只有在适当的pH环境中才能保持稳定的状态。反应体系pH过低,河蚬抗氧化肽的结构易破坏,导致螯合率的降低;反应体系的pH在7~8时,蛋白质达到其等电点,溶解度最小,因而体系中抗氧化肽浓度降低,螯合率降低。因此,选择pH 6.0作为螯合反应的较适pH。
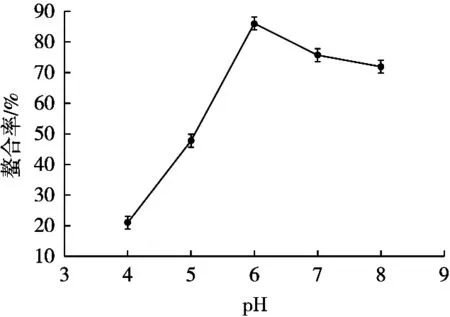
图1 pH对螯合效果的影响
2.1.2 抗氧化肽与锌离子质量比的筛选试验
由图2可知,螯合率随着抗氧化肽与锌离子质量比的增加而升高,到2.0︰1时达到最大值。原因可能是由于抗氧化肽与锌离子质量比太低,河蚬抗氧化肽锌螯合物无法合成稳固的环状构造,因此螯合率偏低;而质量比过大时,可供螯合的锌离子量不足而河蚬抗氧化肽剩余,螯合达到饱和,螯合率趋于平稳。因此,选择抗氧化肽与锌离子质量比2.0︰1作为较适条件。
2.1.3 螯合时间的筛选试验
由图3可知,螯合率随着时间的增加呈上升趋势,当螯合时间达到45 min时,螯合率达到顶峰。延长反应时间,可能是由于螯合环状结构变得不稳定而导致螯合率呈下降趋势,但没有显著性差异。因此,选定为45 min为河蚬抗氧化肽与锌离子螯合的较适时间。
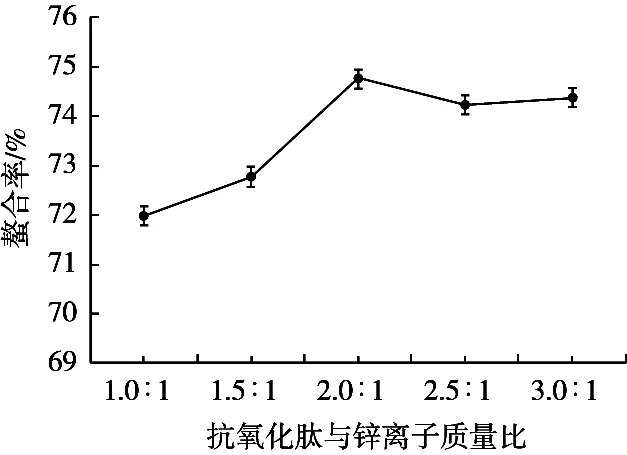
图2 河蚬抗氧化肽与锌离子质量比对螯合效果的影响
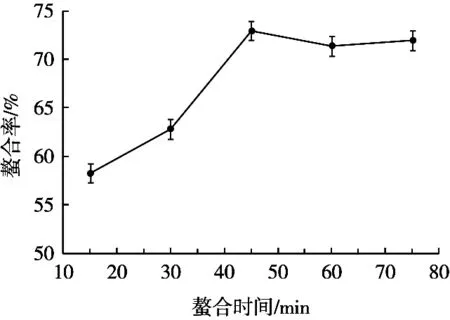
图3 螯合时间对螯合效果的影响
2.1.4 螯合温度的筛选试验
图4表明,温度对螯合率有着一定的影响,随着反应温度的升高,多肽的螯合率缓慢的增大,当温度为45 ℃左右时,多肽螯合率达到峰值。在低温下,螯合反应缓慢的进行;螯合率在45 ℃后降低可能是因为螯合反应产生的热量使得体系温度升高,螯合物分解,最终螯合率反而降低。因此,试验的螯合温度控制在45 ℃为宜。
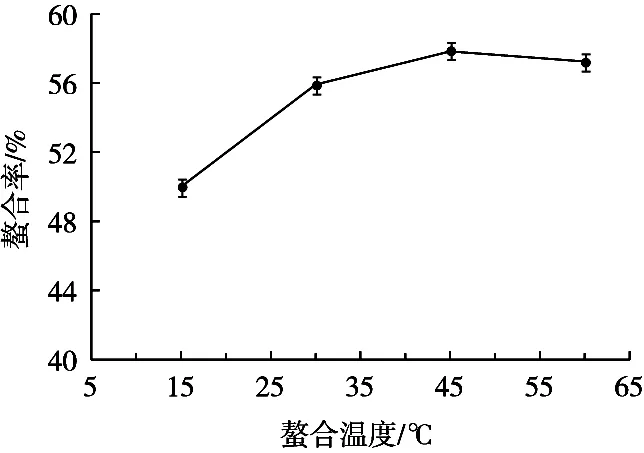
图4 螯合温度对螯合效果的影响
2.2 响应面试验结果
使用响应面软件对pH、质量比、时间和温度设计四因素三水平试验,共进行29组试验,试验方案及结果见表2。
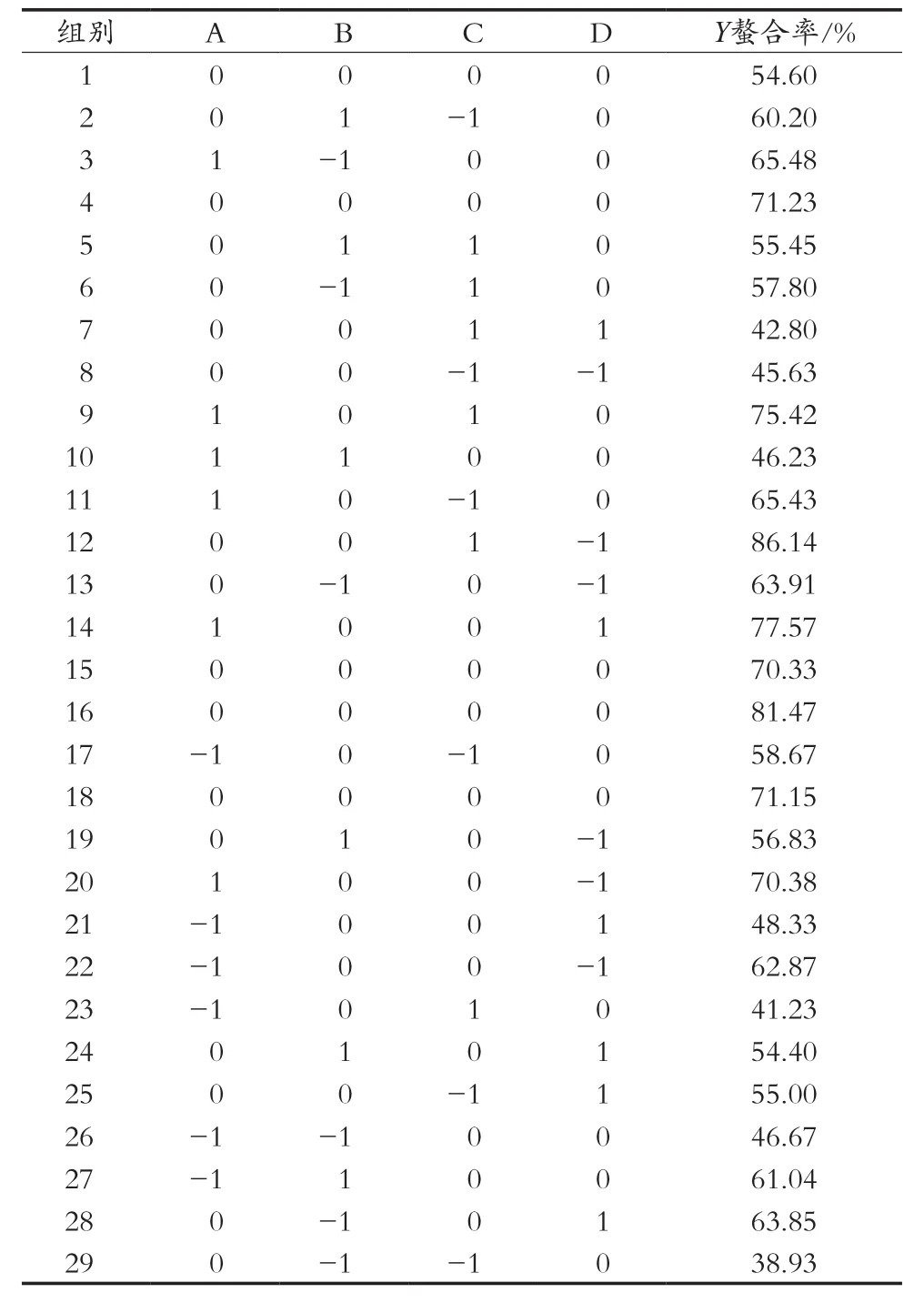
表2 响应曲面试验结果
2.2.1 方差分析
使用Design-Expert 8.0.6软件对试验所得结果进行处理与分析,得到结果见表3。
由表3可知:模型F=4.58,p=0.003 7。由于模型p<0.05,因此模型中的回归方程对河蚬抗氧化肽锌的螯合率具有显著性,而且由于失拟项p=0.157 6>0.05,因此失拟项不显著。这说明设计的模型与试验拟合较好,自变量与响应值之间的关系显著,可以用于该反应的理论推测并能正确地预算出最佳螯合工艺条件。单因素中pH和螯合时间对螯合率的影响是显著的(p<0.05);交互因素中pH与螯合时间对螯合率的影响显著(p<0.05)。
2.2.2 回归模型优化
将软件计算所得模型中的不显著项手动删除,优化结果见表4。
手动优化后的二次回归方程为:
Y=71.84-10.50A+5.91C-8.04AC-10.73A2-6.34B2-6.24D2
对结果影响较强的交互项响应曲面图见图5。
图5显示,反应时间越长螯合率越高,而当pH为5~6、反应时间为46 min左右时出现峰值,整个图形呈现上升趋势并且其坡度较为陡峭,表明pH与反应时间的相互作用能显著影响螯合率,所以控制一定的pH与反应时间可以达到较理想的螯合率。
通过Design-Expert 8.0.6软件计算分析并预测出最优工艺条件:pH为5.07,抗氧化肽与锌离子质量比2.18︰1,反应时间为46.50 min,反应温度为52.65 ℃。
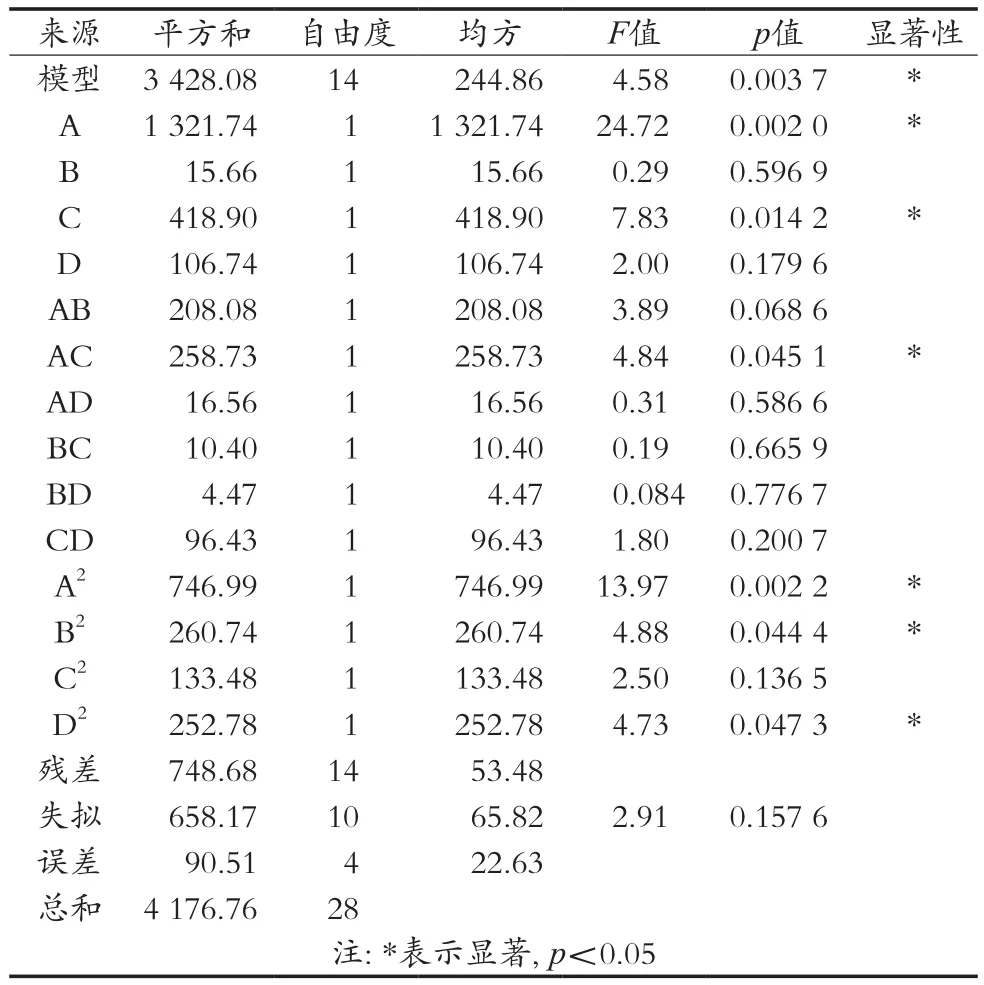
表3 回归方程显著性检验和方差分析

表4 删除不显著项后的优化结果

图5 pH与反应时间及其相互作用对螯合率影响的响应曲面和等高线
2.3 验证试验
参照软件计算、优化的工艺条件进行验证试验,实际测得河蚬抗氧化肽螯合锌的螯合率为81.78%,而理论预测值为83.39%,与之相差1.61%。可见模型预测值在实际值的误差范围之内,说明该模型适合用来优化制备河蚬抗氧化肽螯合锌。
2.4 河蚬抗氧化肽及肽锌螯合物红外光谱比较
抗氧化肽及抗氧化肽-Zn2+螯合物红外光谱图见图6和图7。
由图6和图7可知,河蚬抗氧化肽螯合后,各主要基团的吸收峰表现出一定程度的改变。在特征区,河蚬抗氧化肽在3 419.32 cm-1处是由于N—H的伸缩振动引起的,当抗氧化肽与Zn2+螯合后,该峰移动到3 441.13 cm-1处,波数增加21.81 cm-1,是发生螯合的特征峰,可见抗氧化肽中的氨基与Zn2+发生了螯合反应。而且,河蚬抗氧化肽红外光谱图中的C==O吸收峰由1 657.63 cm-1处位移至1 635.95 cm-1处,吸收强度也随之发生了明显的变化,可能是河蚬抗氧化肽中的COO-参加了锌离子的配位反应。由此可以说明河蚬抗氧化肽中的氨基和羧基参与了螯合反应,进一步说明河蚬抗氧化肽和锌离子螯合生成河蚬抗氧化肽-Zn2+螯合物。

图6 河蚬多肽的红外光谱

图7 河蚬抗氧化肽-Zn2+螯合物的红外光谱
3 结论
1) 在单因素试验的基础上,通过响应面分析软件Design-Expert 8.0.6得出的回归方程,确定出螯合工艺优化条件:pH为5.07,抗氧化肽与锌离子质量比为2.18︰1,螯合时间为46.50 min,螯合温度为52.65 ℃。模型预测此条件下螯合率为83.39%,而以此工艺测得的河蚬抗氧化肽锌螯合率仅为81.78%,属于试验可接受误差范围内。因此,此模型可用来优化肽锌螯合物的工艺参数,具有较高的准确性和良好的实用价值。
2) 在对河蚬肉进行酶解的基础上,考虑到利用螯合技术,进一步将河蚬肉进行深加工。这不仅为制备一种新型抗氧剂和具有抗氧化功效的锌制剂以及开发系列功能食品奠定强有力的理论基础,也为河蚬的深度加工提供一条新的途径。
