姜黄素碳酸钙微球的制备及其载药性能
2019-05-23宋娟张华山鲁江卢薇
宋娟,张华山,鲁江,卢薇
湖北工业大学分析测试中心(武汉 430068)
姜黄素(Curumin,Cur)是从中药姜黄、郁金、莪术等植物块茎中提取出来的天然活性物质。研究表明,姜黄素具有多方面的药理作用,如抗肿瘤、抗氧化、抗炎、抗纤维化等,具有非常大的开发应用前景[1-6]。但由于姜黄素的水溶性差、易氧化、体内吸收差和生物利用度低等诸多缺陷,目前其在临床上运用十分有限[7-8]。近年来大量研究致力于克服这些缺陷,将药物制成胶束,从而提高溶解度和稳定性[9];制成高分子共聚物从而改善其溶解度和缓释性[10];微球[11]和微乳[12]能够改善稳定性、缓释性及生物利用度。
目前,在CaCO3药物载体研究领域主要通过仿生合成的方法制备具有良好生物学性能的CaCO3矿化产物。CaCO3作为药物控缓释载体,与聚合物载体相比,具有很多优点。CaCO3的制备处理过程相对简单,并且对环境无污染,还具有生物相容性和生物可降解性,对人体无毒副作用,易于排出体外,上述优点使得CaCO3成为较为理想的药物载体[13-15]。蛋黄卵磷脂(Egg yolk lecithin,EYL)作为磷脂的较好来源之一,其主要成分为磷脂酰胆碱(Phosphatidylcholine,PC)和神经鞘磷脂(Sphingomyelin,SM),其中PC含量70%~80%,SM含量15%~20%。磷脂分子的极性头部含有一个带负电的磷脂酰基基团及一个带正电的季铵基团,即其有一个非极性的疏水端和一个极性的亲水端。卵磷脂分子的极性头部对钙离子有特异的结合作用,具有局部富集钙离子的作用,而这种特异性的结合作用可以促进碳酸钙团聚态微球的形成。EYL和CaCO3两者均具有良好的生物相容性,可降解性和无毒等特点。试验选取Cur作为模型药物,以EYL为制备模板调控得到的CaCO3复合微球作为药物载体,采用溶剂法制备姜黄素碳酸钙微球,考察其体外溶出变化,并通过物相表征探索其提高溶出速率的机制,为EYL为制备模板调控得到的CaCO3微球作为药物载体提供理论和实践依据,以期提高难溶性药物的溶出度。
1 材料与方法
1.1 材料与仪器
姜黄素、蛋黄卵磷脂(分析纯,美国Sigma公司);试验用水(Milli-Q超纯水);其他试剂均为分析纯。
扫描电镜(JSM-6390 LV型,日本电子公司);透射电镜(JEM-2100型,日本电子公司);热重分析仪(TGA/DSC-1 Star system,瑞士Mettler Toledo公司);紫外分光光度计(UV-2410 PC,日本Shimadzu公司)。
1.2 CaCO3微球的制备
据前期试验结果[16],将250 mg EYL在超声下溶胀于10 mL 0.3 mol/L CaCl2溶液中,制备EYL的CaCl2溶液。将此混合液与0.3 mol/L Na2CO3溶液在搅拌下快速混合,沉淀迅速产生。待沉淀静置陈化2 h之后,将沉淀清洗离心并用乙醇淋洗几次,自然干燥后待测。由于每个样品的陈化时间相同,可认为陈化作用对样品的形貌不会产生影响,或可能由于陈化作用而造成的形貌差异可以被消除。空白试验与上述试验条件相同,将不含EYL的10 mL 0.3 mol/L的CaCl2溶液与10 mL 0.3 mol/L的Na2CO3溶液在搅拌下快速混合,沉淀同样陈化30 min后离心清洗、干燥后待用。
1.3 姜黄素碳酸钙微球的制备
按照Cur与CaCO3质量比为1︰1,1︰2和1︰4,分别制备不同比例的姜黄素碳酸钙微球,精密称取100 mg Cur溶于100 mL 80%乙醇溶液中,按照不同的质量比加入适量CaCO3粉末,水浴超声至载体完全分散,室温下继续磁力搅拌,旋转蒸发溶剂,得到均一的黄色固体,真空干燥,研磨,过80目筛,得到姜黄素碳酸钙微球。
1.4 载体和微球结构、形貌及性质的表征
1.4.1 透射电镜分析(TEM)
TEM用于分析制得的CaCO3样品精细结构,将研磨后的样品分散于乙醇溶液中,超声分散后,铜微栅捞起,样品附于栅网上,晾干备用。工作条件为100 kV。
1.4.2 扫描电镜分析(SEM)
SEM用于观察将原料药、CaCO3、物理混合物和姜黄素碳酸钙微球的粉末样品表面形貌分析,将样品分别置于离子溅射仪中,喷镀约20 nm铂金膜。工作条件为:高压30 kV,束流5×10-9mA,工作距离10 mm。
1.4.3 差示量热扫描分析(DSC)
分别对Cur、CaCO3、物理混合物和姜黄素碳酸钙微球进行DSC分析。扫描范围25~250 ℃,升温速率10.00 ℃/min。
1.5 体外溶出度测定
1.5.1 标准曲线的建立
1.5.1.1 线性关系考察
精密称取Cur 5.0 mg,加入无水乙醇10 mL溶解,得到500 mg/L的对照品储备液。精密量取适量储备液,分别置于10 mL量瓶中,用0.2% SDS溶出介质稀释至刻度,摇匀,得到质量浓度分别为0.25,0.50,1.00,2.00,4.00,6.00和8.00 mg/L工作液。对照储备液用溶解介质稀释后,运用紫外分光光度计在200~600 nm波长扫描,Cur的最大吸收波长430 nm,选择430 nm为检测波长。利用紫外分光光度计测定各质量浓度样品在430 nm检测波长下的吸光度(A)。以吸光度A为纵坐标,质量浓度C为横坐标,绘制标准曲线。
1.5.1.2 精密度试验
精确配制姜黄素高、中、低(0.4,2.0和6.0 mg/L)3种浓度标准溶液,在1 d之内分别测定5次,计算日内误差;同法每日测定1次,连续测定5 d,计算日间误差。
1.5.1.3 稳定性试验
取2.0 mg/L姜黄素对照品,分别于0,2,4,6,8和12 h测定吸收度。
1.5.1.4 重现性试验
分别取对照品溶液加溶出介质稀释成含姜黄素0.4,2.0和6.0 mg/L标准液,在430 nm处测定吸光度,重复测定5次。
1.5.2 溶出度测定
按照《中国药典》2015年版溶出度测定法第二法(桨法)测定[17]。溶出介质900 mL,转速100 r/min,水浴温度37.0±0.5 ℃。将Cur及各种比例的姜黄素碳酸钙微球(均含10 mg Cur),分别分散至介质中,分别于5,10,20,30,45,60,90和120 min取样5 mL,并即时补充5 mL溶出介质,样品以15 000 r/min离心3 min,取上清液于430 nm检测波长下测定A。将A值带入回归方程计算药物积累溶出度。每个样品平行试验6次,计算平均值,绘制溶出曲线。
2 结果与讨论
2.1 载体和微球的结构、形貌及性质的表征
2.1.1 透射电镜分析(TEM)
为进一步了解CaCO3中纳米结构,采用高分辨透射电镜对其进行分析,结果见图1。图1(A)所示,球状颗粒的纳米团聚结构明显,这些纳米颗粒的直径在几十个纳米左右,颗粒之间相互搭建,形成较为松散的多孔结构。晶格像(图1B)说明一个纳米颗粒中还存在取向各异的亚晶结构,大小约几个纳米。EYL作为有机模板对CaCO3的成核与生长具有明显的调制作用。
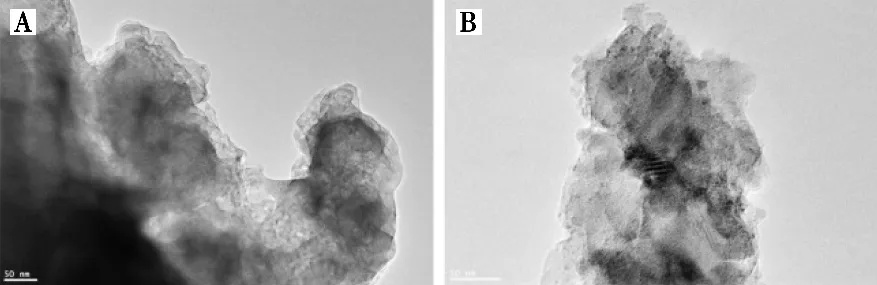
图1 CaCO3的高分辨透射电镜图(A)和局部放大高分辨像(B)
2.1.2 扫描电镜分析(SEM)
对原料药、CaCO3、物理混合物和姜黄素碳酸钙微球分别进行表面形貌分析,结果见图2。SEM下可见Cur呈现明显晶体颗粒状(图2A),CaCO3则外观呈球状,大小均一,分散性好的球型颗粒,粒径在5 μ m左右(图2B),Cur和CaCO3物理混合样品的微球和晶体掺杂在一起(图2C),而姜黄素碳酸钙微球不同于物理混合样品,未见明显晶体颗粒(图2D),说明Cur很好地分散到碳酸钙微球中。

图2 Cur原料药(A)、CaCO3(B)、物理混合物(C)、姜黄素碳酸钙微球(D)的扫描电镜图
2.1.3 差示量热扫描分析(DSC)
DSC分析结果如图3所示。Cur原药在183 ℃处有明显的吸收峰,对应Cur的熔点,CaCO3在25~250 ℃未出现吸热峰,物理混合物中仍可见Cur的吸收峰,表明该混合物是原料药和载体的简单混合,而姜黄素碳酸钙微球中药物吸热峰消失,提示药物成功加载于微球。

图3 Cur原料药(A)、CaCO3(B)、物理混合物(C)和姜黄素碳酸钙微球(D)的差示扫描量热图
2.2 体外溶出度测定
2.2.1 标准曲线的建立
将吸光度(A)和质量浓度进行回归,得到回归方程A=1.269X+0.054,r=0.999 9,可知Cur在0.25~8 mg/L质量浓度内线性关系良好。姜黄素低、中、高浓度重复测定5次,其日内精密度RSD为0.308%,0.112%和0.171%,日间精密度RSD为0.366%,0.426%和0.659%,结果显示该方法精密度良好。稳定性试验结果表明,在不同的时间点测定姜黄素吸收度RSD为0.145%,表明样品在12 h内性质稳定。姜黄素低、中、高浓度测定5次,其吸收度RSD分别为0.149%,0.050%和0.084%,表明该方法测定结果重现性良好。
2.2.2 溶出度测定
溶出度结果见图4。姜黄素碳酸钙微球的溶出速率明显高于Cur原药,并且随着CaCO3比例增加,姜黄素碳酸钙微球的溶出速率明显增加,以Cur-CaCO31︰4时制备的姜黄素碳酸钙微球溶出效果最佳,120 min累计溶出率可达78%。

图4 姜黄素及姜黄素碳酸钙微球样品释放曲线
3 结论
CaCO3作为药物载体,与其他聚合物载体相比,具有明显优势:制备过程简单且对环境无污染;同时具有优良的生物相容性和生物可降解性,对人体无害并能排出体外;pH敏感性使其可以通过癌细胞内部溶酶体或在癌细胞外部的弱酸性环境下触发药物释放[18]。近年来,随着仿生矿化研究的不断发展,CaCO3作为药物载体研究取得诸多成果,主要集中在利用直接载药[18],利用CaCO3作为牺牲模板的载药微囊[19],CaCO3载体表面加载靶向配体[20]。试验创新性地采用CaCO3作为药物载体,加载疏水性药物Cur,提高Cur的生物利用度,为CaCO3在中药及有效成分的研究提供创新性思路。
EYL与Ca2+之间存在着特异性的相互作用,表面带负电的EYL可以在溶液中有效地吸附、富集Ca2+,从而在表面形成有利于大量成核位点形成的局部过饱和区,并进一步导致CaCO3纳米粒子的生长。这些纳米粒子随后团聚成多孔的球形颗粒。在EYL为有机模板的调控下,诱导出由纳米粒子团聚而成的具有多级构造的多孔CaCO3球形颗粒。试验通过制备姜黄素碳酸钙微球,将Cur负载于松散多孔结构的CaCO3内,显著增加了Cur的有效溶出面积。故以EYL调控得到的CaCO3为载体,可显著提高难溶性药物的溶出速率和溶出度,为后期提高水难溶性的药物的生物利用度提供新的思路,并为进一步试验研究奠定基础。
