辣木籽中酚酸化合物的提取工艺
2019-05-23汤逊尤王李平林晨方丽张方圆李雪莹
汤逊尤,王李平,林晨,方丽,张方圆,李雪莹
中国广州分析测试中心,广东省化学危害应急检测技术重点实验室(广州 510070)
辣木原产于印度及非洲地区[1-2],是一种耐旱且适应性很强的速生植物[3-4],因其根部具有辛辣味而得名辣木。自20世纪初中国由缅甸进行引种以来,其种植面积已发展至长江以南的大部分省市[5-6]。辣木的各个部位均含有丰富的营养物质而具有食用价值及药用价值,因此被人们称为“神奇之树”[7]。自2012年卫生部批准将辣木叶划分为新资源食品后,辣木在中国的关注度日益提升。目前辣木已被广泛应用于食品[8-9]、净水[10]、医药[11]、工业原料[12]等领域,具有较大的商业和工业开发潜力。
酚酸类化合物在植物中分布十分广泛,辣木籽中的酚酸化合物主要为没食子酸及鞣花酸[13]。这两种酚酸化合物具有抗心脑血管疾病、抗菌消炎、抗肿瘤、降血糖等药理活性[14-15]。辣木籽中的营养均衡,因此成为辣木中各部位的研究重点。辣木籽中含有丰富的油脂、蛋白质、多糖、黄酮类化合物、多酚类化合物、维生素、矿质元素及可溶性纤维等多种营养成分,其中研究最多的是油脂和黄酮类化合物[16-17]。试验就辣木籽中研究较少的酚酸类化合物进行相关研究。
1 材料与方法
1.1 原料与试剂
辣木籽(购于广州清平药材市场);乙醇、甲醇、乙酸乙酯、磷酸(分析纯,广州化学试剂厂);乙腈(色谱纯,Honeywell);没食子酸、鞣花酸(中国食品药品检定研究院)。
1.2 仪器与设备
高效液相色谱仪(Agilent 1290,美国安捷伦公司);摇摆式中药粉碎机(上海顶帅电气公司);Sartorius电子天平(BSA 224 S,广州市深华实验仪器设备有限公司);超声波清洗仪(KQ 2200 B,昆山市超声仪器有限公司),循环水式多用真空泵(SHB-Ⅲ,郑州长城科贸有限公司),电热恒温水浴锅(WBK-4 B型,广东环凯微生物科技有限公司);氮吹仪(EFAA-DC 12,上海安谱实验科技股份有限公司)。
1.3 试验方法
1.3.1 辣木籽中酚酸化合物的提取
精密称取0.5 g粉碎后的辣木籽于离心管中,加入一定体积的甲醇溶液,置于超声中进行提取,设定超声时间与温度。待提取液冷却后真空抽滤,将滤液过0.22 μm针孔过滤器,进行HPLC分析。
1.3.2 色谱条件
色谱柱Phenomenon Gemini C18柱,4.6 mm×250 mm,5 μm;流动相,A 0.1%磷酸水溶液,B乙腈;梯度:0 min,2% B;5 min,2% B;20 min,30% B;35 min,80% B;流速1 mL/min;检测波长260 nm;柱温35 ℃;进样量10 μL。
1.3.3 标准曲线的绘制
试验选择辣木籽中2种主要的酚酸化合物标准品作为参照,即没食子酸、鞣花酸。分别精确称取这2种标准物质5.05和5.02 mg,用甲醇定容至25 mL。然后按照需要逐级稀释,进行HPLC分析。
1.3.4 单因素试验设计
称取0.5 g粉碎后的辣木籽,以没食子酸、鞣花酸的提取量为指标,研究提取时间(20,40,60,80和100 min)、提取温度(40,50,60,70和80 ℃)、液料比(1︰10,1︰20,1︰30,1︰40和1︰50 g/mL)、药材颗粒度(20,40,60,80和100目)对辣木籽中酚酸化合物提取量的影响。
1.3.5 因素水平设计
以单因素试验结果为基础,对辣木籽中酚酸化合物提取量影响较大的3个因素,采用响应面优化法中的中心组合设计进行优化试验。以液料比(A)、提取温度(B)和提取时间(C)为自变量,没食子酸、鞣花酸的提取量为响应值进行试验设计,因素水平设计表如表1所示。

表1 响应面分析因素水平
2 结果与讨论
2.1 线性关系及检出限
分别量取不同浓度的混合标准溶液,按照1.3.2小节的方法进行HPLC分析,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线。结果如表2所示。
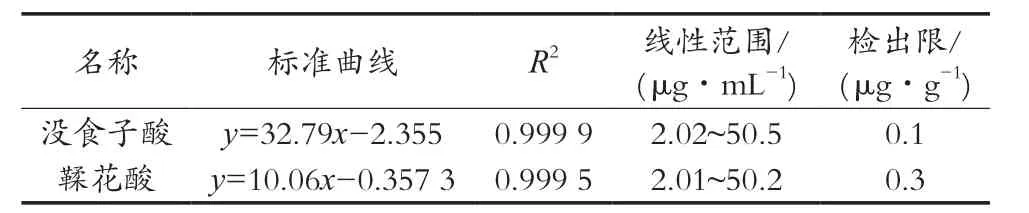
表2 2种酚酸的标准工作曲线、线性范围及检出限
2.2 单因素试验
影响辣木籽中没食子酸、鞣花酸提取量的主要因素为提取溶剂、提取时间、提取温度、液料比和颗粒度,因此对各因素进行考察。
2.2.1 不同提取溶剂对辣木籽中没食子酸及鞣花酸提取量的影响
分别考察甲醇、乙醇、乙腈以及乙酸乙酯等不同溶剂对辣木籽中没食子酸及鞣花酸提取量的影响,结果如图1所示。
结果表明,不同极性的提取溶剂的提取量有所不同。根据化学中“相似相溶”的原理可知,这两种酚酸化合物的极性与甲醇极性更为接近。因此这4种不同提取溶剂中甲醇对于2种酚酸的提取量最高。
2.2.2 提取时间及温度对辣木籽中没食子酸及鞣花酸提取量的影响
提取温度对于提取量的影响较大,过高或过低都不利于酚酸化合物的提取。因此,选取的考察提取温度范围为40~80 ℃。同时,试验所考察的提取时间范围为20~100 min。这2个因素的影响规律如图2所示。
随着提取温度的增加,溶液提取没食子酸及鞣花酸的量逐渐增加,在所考察的提取温度范围里,60 ℃时的提取效果达到最佳。从图2可知,提取时间对于2种酚酸化合物的提取量影响不大,提取时间60 min时,没食子酸及鞣花酸的提取量达到最大。

图2 提取温度(a)和时间(b)对2种酚酸化合物提取量的影响
2.2.3 液料比及颗粒度对辣木籽中没食子酸及鞣花酸提取量的影响
液料比及颗粒度的不同,对辣木籽中酚酸物质的提取量也有所差异。试验考察不同液料比及颗粒度对没食子酸及鞣花酸提取量的影响,其结果如图3所示。
不同液料比对辣木籽中酚酸化合物提取量的影响较大。其提取量随液料比增大而逐渐增大,液料比1︰30(g/mL)时,提取完全,提取量趋于平衡。由3图(b)可知,随着颗粒度的增大,没食子酸及鞣花酸的提取量逐渐增大,颗粒度80目时达到最大。随后提取量则逐渐降低。这是由于适当增大颗粒度能增大物料的比表面积,有利于有效物质的提取。若颗粒度过小,其导致有效物质被吸附,反而会影响其提取量,导致提取量降低,不利于萃取。

图3 液料比(a)和颗粒度(b)对2种酚酸化合物提取量的影响
2.3 响应面优化提取工艺条件
2.3.1 响应面试验结果及分析
根据表1中响应面试验方案,设计试验及试验结果见表3,回归方程方差分析见表4。
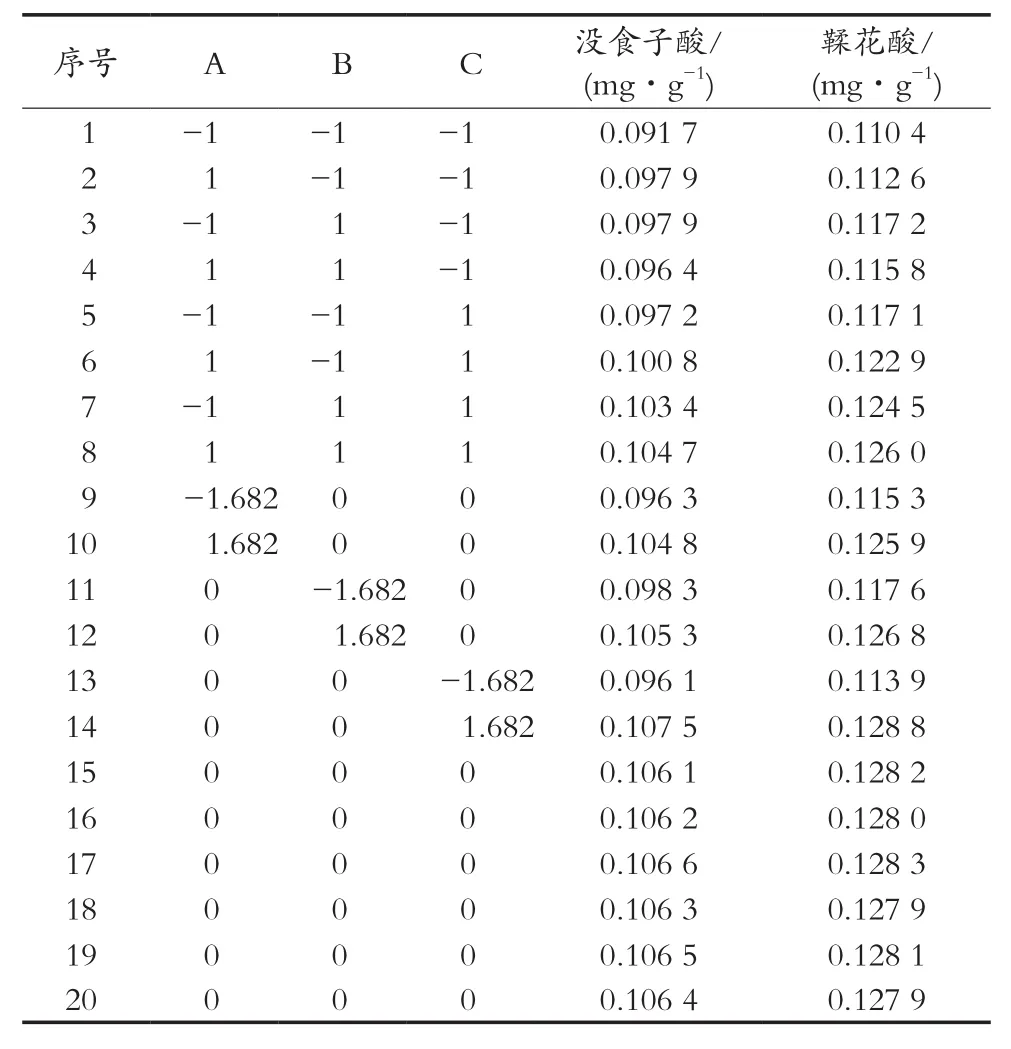
表3 试验方案及结果

表4 2种酚酸提取量的回归方程方差分析
根据Design-Expert 7.0软件的分析结果可知,该模型p值均小于0.000 1,表明模型拟合成功。对没食子酸和鞣花酸的提取量采用二次多项式模型分别进行拟合,其方程为:Y没食子酸=0.11+1.750×10-3A+1.946×10-3B+3.029×10-3C-1.250×10-3AB+2.500×10-5AC+6.750×10-4BC-2.542×10-3A2-2.100×10-3B2-2.100×10-3C2(R2=0.934 6);Y鞣花酸=0.13+1.898×10-3A+2.634×10-3B+4.361×10-3C-9.875×10-4AB+8.125×10-4AC+6.250×10-5BC-3.236×10-3A2-2.670×10-3B2-2.971×10-3C2(R2=0.950 1)。
拟合方程相关性R>0.9,其拟合度良好,可用于辣木籽中没食子酸和鞣花酸提取量的优化。
2.3.2 响应曲面分析
采用Design-Expert 7.0软件对所得试验进行响应曲面分析,得出两两因素之间对没食子酸和鞣花酸提取量的影响。结果如图4和图5所示。
图4和图5中等高线图中曲线呈椭圆形,说明提取时间、提取温度及液料比两两之间辣木籽中酚酸的提取量的交互作用显著。由响应曲面的斜率的分析可知,辣木籽中没食子酸和鞣花酸的提取量均随着提取时间、提取温度及液料比的增大而先升高后减小。两者说明所选的3个优化因素对于两类酚酸化合物的提取量影响十分显著。由两两因素之间的响应曲面分析,以及对表4中各因素p值可知,各因素之间对辣木籽中没食子酸和鞣花酸的提取量影响顺序为:提取时间>提取温度>液料比,Design-Expert 7.0软件给出的最优灰化条件为:提取时间75.8 min、提取温度64.8℃、液料比1︰32.8(g/mL);方程预测在该条件下没食子酸提取量为0.108 3 mg/g、鞣花酸提取量0.130 8 mg/g。为方便实际操作,修正最优条件为:提取时间76 min、提取温度65 ℃、液料比1︰33(g/mL)。
2.3.3 最佳条件验证
按2.3.2小节的最优试验条件,进行6次平行验证性试验,其色谱图如图6所示。测得在最优试验条件下没食子酸及鞣花酸的提取量的平均值分别为0.104 9和0.131 7 mg/g,与预测值接近,且RSD值为0.86%和1.07%,表明响应面分析所得的理论最佳提取条件准确可靠。

图4 两两交互因素对辣木籽中没食子酸提取量的影响

图5 两两交互因素对辣木籽中鞣花酸提取量的影响

图6 辣木籽样品与酚酸对照品色谱图
3 结论
根据所建立高效液相色谱法对辣木籽中没食子酸和鞣花酸进行测定,通过单因素试验然后在此基础上进行中心组合设计-响应面试验考察提取时间、提取温度和液料比等条件对2种酚酸化合物提取量的影响,并分析得到最佳提取条件:提取时间76 min、提取温度65 ℃、液料比为1︰33(g/mL)。在此条件下,没食子酸和鞣花酸的提取量达到最大值。方法简单,而且响应面优化的提取量实际测定值与理论值无显著差异。研究结果可为辣木籽中没食子酸和鞣花酸的提取提供工艺指导。
