龙须菜酶解制备琼胶寡糖的工艺优化
2019-05-23邓宇峰林娟叶秀云杨捷
邓宇峰,林娟,叶秀云,杨捷*
福州大学,福建省海洋酶工程重点实验室(福州 350116)
龙须菜(Gracilaria lemaneiformis)是江篱(Gracialaria Greville)属下的一种海藻类植物,种植面积广,年产量高。目前龙须菜主要作为制备琼胶和制作鲍鱼饲料的原料[1]。目前琼胶主要作为生物试验的培养基、食品凝固剂等,利用价值低。琼胶经过化学或生物方法处理后可得到各种具有功能活性、低分子量的琼胶寡糖[2]。新琼寡糖一般指聚合度2~10的低聚糖,主要由新琼二糖的重复单位连接而成。天然琼胶多糖因其黏性大、不易溶解、难消化、分子量大等缺点[3],难以被人体利用;但琼胶多糖被降解后生成的新琼寡糖在有效清除自由基抗氧化[4-5]、抗菌[6]、益菌[7]、抗肿瘤[8-9]、诱导细胞凋亡、预防糖尿病等方面具有显著的生物活性,可广泛用于食品、饲料[10-11]、化妆品[12]和医药等行业,与当前社会的健康、绿色、安全等理念相呼应,成为国内外学者们的研究热点[13]。
目前国内外制备琼胶寡糖的方法分为化学分解法和生物分解法[2]。化学分解法包括强酸分解法、氧化还原分解法、衍生化分解法。其中应用最广泛的是酸降解法(盐酸、乙酸、硫酸、柠檬酸等)。盐酸降解产物主要集中在三糖至八糖,硫酸降解产物集中在一糖至二糖,采用酸降解得到的寡糖得率高,但存在产物不均一,需要高温酸解、污染环境、寡糖活性丧失,产物分析和回收难等问题,故而难以进行工业化生产功能性寡糖,以满足社会需求[14]。生物分解法采用琼胶酶对琼胶多糖糖苷键进行特异性剪切,生成不同分子量的功能性寡糖。生物学方法能够克服化学方法存在的不足,具有分解条件温和、易控制、产物专一性好、产物易于分离纯化和分析、产物活性高、工艺绿色环保等优点[15]。
试验选取龙须菜为原料,采用纤维素酶酶解其细胞壁中含量较多的纤维素以便其中的琼胶释放出来,再采用琼胶酶酶解琼胶制备琼胶寡糖,以最大化地提高琼胶寡糖得率。目前国内制备新琼寡糖的原料为琼胶[16],试验直接选取琼胶的上游原料作为底物,省去龙须菜高温水提琼胶的工艺,简化寡糖的制备工艺,建立酶解制备最优工艺,并对酶解产物进行高效液相分析,以实现龙须菜的高值化利用,并为功能性琼胶寡糖的应用打下基础。
1 材料与方法
1.1 材料与试剂
龙须菜,福建亿达食品有限公司,洗净烘干后备用;琼胶酶由福州大学海洋酶工程重点实验室提供,酶活为1 074 U/mL,在pH 5.0~9.0稳定;纤维素酶,福建福大百特科技发展有限公司;苯酚、硫酸、半乳糖、葡萄糖等试剂均为分析纯;新琼寡糖标准品,青岛博智生物科技有限公司。
1.2 仪器与设备
T 6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;CF 16 RXII高速冷冻离心机,日本HITACHI公司;MXX-612电子天平,DENVER INSTRUMENT;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;Waters色谱仪,沃特世科技(上海)有限公司。
1.3 方法
1.3.1 水解度测定
取1 mL酶解液,加入0.5 mL 5%苯酚溶液,迅速加入2.5 mL浓硫酸,充分混匀,室温放置30 min,测定OD490。通过半乳糖标准曲线[17]计算酶解液中的多糖含量。按式(1)进行计算。

式中:n为酶解液中糖含量,mg;m为龙须菜干质量,mg。
1.3.2 还原糖含量测定
准确取1 mL酶解液,然后加入1.5 mL DNS溶液,水浴锅煮沸5 min,置于冷水中冷却至室温。测定OD540,再通过半乳糖标准曲线计算酶解液中的还原糖含量。
1.3.3 琼胶酶酶解龙须菜的单因素试验
不同颗粒大小(过40目,40~60目和60目)的龙须菜用相应pH(4,5,6,7和8)缓冲液配成一定浓度(0.3%,0.5%,1.0%,2.0%和3.0%)的底物,加入适量(10,20,25,30和40 U/mL)琼胶酶液,在一定温度(30,40,45,50和60 ℃)条件下振荡反应一定时间(3,5,8,10和16 h),立即沸水灭酶5 min,离心(12 000 r/min,5 min),过滤,蒸馏水定容至一定体积,苯酚-硫酸法测糖含量计算水解度,DNS法测定其还原糖含量。
1.3.4 纤维素酶酶解龙须菜单因素试验
不同颗粒大小(过40目,40~60目和60目)的龙须菜用相应pH(3,4,5,6和7)缓冲液配成一定浓度(0.3%,0.5%,1.0%,2.0%和3.0%)的底物,加入适量(2,3,5,6.5和8 U/mL)酶液,在一定温度(30,40,45,50和60 ℃)条件下振荡反应一定时间(3,5,8,10和16 h),立即沸水灭酶5 min,离心(12 000 r/min,5 min),过滤,蒸馏水定容至一定体积,苯酚-硫酸法测糖含量计算水解度,DNS法测定其还原糖含量。
1.3.5 复合酶解纤维素酶添加量的确定
在pH 6.5,酶解时间为5 h,酶解温度为45 ℃,底物浓度为1%、琼胶酶添加量为30 U/mL、龙须菜颗粒大小为40~60目的条件下,研究不同纤维素酶添加量(2,3,5,6.5和8 U/mL)对水解度的影响。
1.3.6 正交试验设计
在单因素试验的基础上,利用L9(34)正交表进行试验设计,运用方差分析试验结果,确定最优提取工艺。因素水平编码表如表1所示。

表1 正交试验设计因素水平编码表
1.3.7 产物分析
对酶解产物进行高效液相色谱分析,HPLC条件:检测器为示差检测器;色谱柱为氨基柱;柱温为50 ℃;流动相为乙腈-水溶液(体积比为70︰30);流速为1 mL/min。
2 结果与分析
2.1 琼胶酶酶解龙须菜单因素试验
在龙须菜颗粒大小为过40~60目筛、底物浓度0.5%、pH 7、加酶量30 U/mL、酶解时间5 h、酶解温度45 ℃的条件下,水解度最高为37.8%(图1)。刘燕研[18]究海洋细菌ZCL对龙须菜发酵产寡糖的影响中,发现龙须菜颗粒大小为40目时糖含量最大,与此次试验的结果一致。随着颗粒大小的增大,寡糖含量逐渐变小,可能是因为颗粒过大,琼胶不易释放出来,底物与酶不能充分地接触。酶解温度和酶解pH直接影响酶促反应速率。不同琼胶酶具有不同的最适温度与pH,过高或过低都会影响酶活性,从而影响寡糖得率。梅建凤等[2]研究发现在酶解pH为7.0时还原糖含量最高,为0.477 mg/mL,其琼胶酶加酶量为250 U/mL,从经济效益来看,此次试验琼胶酶加酶量仅为30 U/mL即可达到5.092 mg/mL的还原糖含量。刘美英等[19]研究发现在酶解温度为45 ℃、pH为7.0时的琼胶还原糖含量最高,为0.6 mg/mL。合适的酶解时间与酶浓度也是影响寡糖得率的重要因素之一。酶解时间和酶浓度过短,反应不完全;时间和酶浓度过长,造成浪费能源。邵锦挺[20]研究得到当酶解时间为2 h、底物浓度为0.2%时,琼胶还原糖含量最高,为0.148 mg/mL,因为其酶解的底物为琼脂粉,而此次试验的底物选取的为龙须菜粉末,酶解初始琼胶释放较缓慢,因此所需反应时间较长,但是此次试验还原糖含量较高。韩莎莎[21]研究发现当琼胶酶加酶量为4%、酶解温度为40 ℃、酶解pH为6.0、酶解时间2 h时,其龙须菜多糖的还原糖含量最高,为2.23 mg/mL。侯艳平[22]发现当龙须浓度为2%、琼胶酶加酶量为2.5 μg/mL时,得到的还原糖质量浓度最高,为2 mg/mL。姚德桓[23]在酶解温度40 ℃、pH 7.0、加酶量15 U、底物浓度1.1%、酶解时间40 min的条件下,还原糖含量达到最高,为1.762 mg/mL。此次试验通过优化之后的酶解较为彻底,残余总糖仅为4.78%,并且还原糖含量较高,为之后琼胶寡糖的应用奠定基础。

图1 不同的酶解因素对琼胶酶酶解龙须菜水解度的影响
2.2 纤维素酶酶解龙须菜单因素试验
在龙须菜颗粒大小为过60目筛、底物浓度0.5%、pH 6、加酶量6.5 U/mL、酶解时间5 h、酶解温度45 ℃的条件下水解度最高,为22.1%(图2)。万玮等[24]研究琼胶酶降解龙须菜制备寡糖的过程中发现当龙须菜颗粒大小为60目时糖含量最大,这与此次试验结果一致。谭佩毅等[25]在研究纤维素酶制备壳寡糖的过程中发现当纤维素酶添加量为1.2%、酶解温度50 ℃时寡糖得率最大。李庆旺[26]以纤维素酶酶解琼脂糖制备寡糖的过程中得到纤维素酶加酶量1 909.3 U/mL、酶解温度50 ℃、酶解时间24 h、酶解pH 4.9时的还原糖转化率最高,为29.58%。

图2 不同的酶解因素对纤维素酶酶解龙须菜水解度的影响
2.3 复合酶解纤维素酶添加量的确定
在琼胶酶酶解龙须菜的最优条件基础上,通过改变纤维素酶加酶量来确定复合酶解的最优添加量。随着纤维素酶量的增加,龙须菜水解度呈先增大后趋于平稳的趋势,还原糖含量也有同样的趋势;当纤维素酶添加量达6.5 U/mL时,龙须菜水解度最高,达43.9%,还原糖含量达8.8 mg/mL(图3)。添加纤维素酶可以提高龙须菜的水解度和还原糖含量,可能是纤维素酶通过降解龙须菜细胞壁中的纤维素得到纤维寡糖提高水解度,并且使龙须菜内的琼胶释放出来,与琼胶酶充分接触酶解。
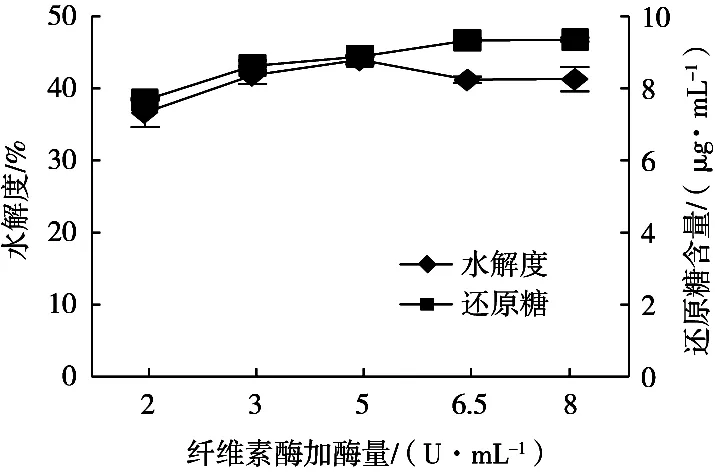
图3 纤维素酶加酶量对水解度的影响
2.4 正交试验设计及结果
方差分析可知,只有因素D(底物浓度)对龙须菜水解度具有显著性影响,因素作用的主次顺序为D(底物浓度)>A(琼胶酶加酶量)>C(pH)>B(纤维素酶加酶量)。通过表3和表4可知,最优水平组合为A3B3C2D1,即琼胶酶加酶量为30 U/mL,纤维素酶加酶量为6.5 U/mL,pH为6.5,底物浓度为0.5%,此时龙须菜水解度为56.6%。经过验证,龙须菜的水解度为57.6%。并对酶解后的龙须菜残渣进行多糖含量的测定,其中多糖含量仅为3.27%,说明酶解得较为彻底,并且可明显得出在酶解过程中添加纤维素酶可以提高水解度。
刘刚[27]采用盐酸酸解龙须菜琼胶制备琼胶寡糖,并对酸解条件进行了响应面优化,得到水解率(反应液糖含量/琼胶总糖含量)为81.43%。徐强等[28]同样采用盐酸水解龙须菜琼胶,在盐酸浓度0.075 mol/L、水解120 min、底物浓度1%的条件下,水解度为87.2%。而此次试验采用琼胶酶与纤维素酶复合酶解龙须菜提取琼胶寡糖,省去提取琼胶的步骤,简化制备工艺,并且得到了高水解度的酶解产物,通过琼胶酶酶解的水解度可达97.5%,相对于酸法制备琼胶寡糖来说,其具有分解条件温和、易控制、产物专一性好、产物易于分离纯化和分析、产物活性高、工艺绿色环保等优点,且利用该方法的水解度高。

表2 正交试验设计及试验结果

表3 方差分析表L9(34)
2.5 产物分析
对酶解产物进行高效液相色谱分析,在此条件下,新琼寡糖标准品按照分子量大小的顺序出峰,其出峰时间分别为6.44,9.33,13.44和21.94 min。对照标准品,确定酶解24 h产物主要为新琼四糖(峰值占比为89%),含有少量的新琼二糖(峰值占比为11%)(图4)。不同的琼胶酶的作用机制各不相同,因此其酶解终产物也各不相同。其中侯艳平[22]、姚德桓[23]、唐啸龙[29]与此次试验的降解终产物相同,均为新琼四糖与六糖为主,最后出现新琼二糖,其中采用的琼胶酶分别来源于火色杆菌属、海洋弧菌属和海洋杆菌属,均为β-琼胶酶。而王静雪[30]、董素洁[31]降解得到的最小单位为新琼四糖,终产物为新琼四糖与六糖,无新琼二糖,所采用的琼胶酶分别来源于单胞杆菌属、嗜琼胶卵链菌属,均为β-琼胶酶。而此次试验的琼胶酶来源于耐热微球菌,也为β-琼胶酶,降解终产物为新琼四糖与新琼二糖,属于内切酶。

图4 琼胶寡糖HPLC图
3 结论
采用琼胶酶与纤维素酶直接酶解龙须菜制备琼胶寡糖,考察不同因素对酶解过程中水解度和还原糖的影响。在单因素试验基础上,通过正交试验得出最佳酶解工艺:底物浓度0.5%,酶解温度45 ℃,pH 6.5,琼胶酶加酶量30 U/mL,纤维素酶加酶量6.5 U/mL,龙须菜颗粒大小为过40~60目筛,酶解时间5 h,得到的水解度为56.6%,还原糖含量为4.652 mg/mL。通过液相色谱分析酶解终产物,主要为新琼四糖,存在少量的新琼二糖。此次试验为功能性琼胶寡糖的酶解制备和应用打下基础,后续可对此混合寡糖进行分离纯化得到大量高纯度的新琼四糖与少量新琼二糖。
