敦煌地区产胞外多糖菌株的筛选鉴定及其发酵条件研究*
2019-05-23牛世全郑豆豆朱学泰孔维宝张爱梅
周 璇 牛世全 郑豆豆 王 彦 朱学泰 孔维宝 张爱梅
(西北师范大学生命科学学院 甘肃兰州 730070)
微生物胞外多糖(exopolysaccharide,EPS)是指微生物在生长代谢过程中分泌到培养基中的大分子聚合物[1]。近年来,微生物胞外多糖以其生长周期短、安全性高、理化性质独特等优点广泛应用于食品、制药、化工、环保等领域[2-3]。据统计,目前全世界微生物多糖年加工产值可达80 亿美元左右[4]。 虽然到目前为止有49属76种微生物能够产生胞外多糖[5],但是真正投入工业化生产的胞外多糖只有黄原胶(xanthan)、结冷胶(gellan)、普鲁兰(pullulan)、热凝多糖(curdlan)、鼠李胶(rhamsan)等10 余种[6]。 因此,开发具有应用价值的新型微生物胞外多糖是目前世界上亟待解决的问 题[7-8]。
极端环境是潜在的、 重要的微生物资源库之一。 极端环境下微生物所产生的胞外多糖在多样性和功能上更具优势, 已经成为近几年新的研究热点[9]。赵惠娅等[10]从600 余株南极微生物中筛选出2 株可产生显著提高大菱鲆免疫活性的胞外多糖的极地菌株20#3 和3-3-1-2, 为极地胞外多糖作为水产动物饲料添加剂提供一定的基础资料;龙寒等[11]从广西北部湾分离得到一株产EPS 的海洋弧菌, 并发现该EPS 对肿瘤细胞的生长具有明显的抑制作用。 盐碱土壤是极端环境的一种,盐碱土壤中微生物所产胞外多糖同样也具有多种优良特性。 艾雪等[12]从柴达木盆地荒漠盐土中分离出19株耐盐碱细菌, 并发现其所产胞外多糖对沙漠化防治及改善荒漠生态环境有极大应用价值;高爽等[13]分离得到的一株中度嗜盐菌Halomonas sp.H09 所产胞外多糖在玉米淀粉加工企业废水的处理中,添加量少、絮凝热稳定性较好,具有较高的应用优势;Juan Antonio Mata 等[14]从西班牙南部Jaén 地区盐碱土壤中分离得到菌株H. ventosae Al12 T 和Al16 所产胞外多糖具有较强的结合阳离子的能力, 在治理重金属离子的污染等方面有着深远的意义;Ruiz-Ruiz 等[15]分离得到的一株嗜盐菌所产EPS 经硫酸化后具有较强的抗肿瘤活性,为癌症的治疗提供理论依据。
敦煌地区位于河西走廊的最西端, 常年干旱少雨,水分蒸发量较大,土壤盐碱化严重,是一类典型的极端环境。笔者前期研究发现,河西走廊盐碱土壤中微生物多样性非常丰富, 存在大量的微生物类群[16],但目前对于河西走廊产胞外多糖的细菌研究未见报导。 因此河西走廊可作为产具有应用价值的胞外多糖微生物的潜在菌源地, 有待进行进一步探究。 本文对从敦煌地区盐碱土壤中分离的一株胞外多糖产量较高的菌株进行了筛选及鉴定,同时优化了该菌株的产糖培养基。
1 材料和方法
1.1 菌种分离源 样品采自敦煌地区盐碱土壤。
1.2 培养基 菌株初筛用LB 固体培养基, 种子液用LB 液体培养基,菌株复筛用发酵培养基[17]。
1.3 菌株初筛 称取土样5 g, 放入已灭菌的装有45 mL 蒸馏水的三角瓶中,振荡均匀后稀释6 个梯度; 取50 μL 10-4、10-5、10-6梯度土壤悬浮液涂布于LB 培养基上,28℃恒温倒置培养48~72 h;挑取在LB 培养基上能产生大量粘稠物质的单菌落,反复划线纯化后,接种于斜面培养基中于4℃冰箱中保存。
1.4 菌株复 筛[18-20]
1.4.1 苯酚硫酸法标准曲线的测定[20]称取10 mg葡萄糖于100 mL 容量瓶中配制成100 μg/mL 的葡萄糖溶液。 分别取0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL、1.6 mL、1.8 mL、2.0 mL 配制好的葡萄糖溶液于洁净干燥的试管中,加蒸馏水补至2.0 mL,配制成不同浓度的葡萄糖溶液。 在不同浓度的葡萄糖溶液中分别加入1.0 mL 6%苯酚溶液和5.0 mL 浓硫酸,静置10 min 后振荡摇匀,室温静置20 min 后,测定其在490 nm 处的吸光值。 取2.0 mL 蒸馏水作为空白对照。 以490 nm 处吸光度为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线,并求出回归方程。 通过苯酚硫酸法确定了总糖含量的标准曲线如图1所示,标准曲线的回归方程为y=0.01115x+0.23192,R2=0.9974。

1.4.2 粗多糖的分离 将初筛得到的菌株接种到含有50 mL LB 液体培养基的250 mL 三角瓶中,28℃、160 r/min 培养24 h 制成种子液。 将发酵好的种子液以5%(v/v) 的接种量接种于装有50 mL发酵培养基的250 mL 三角瓶中, 培养48 h 后将发酵液煮沸灭活,10 000 r/min 离心10 min,取10 mL 上清液,加入3 倍体积95 %乙醇,用力振荡至产生絮状沉淀后,4 ℃沉淀过夜。 再经过10 000 r/min 离心10 min 后弃上清液,所得沉淀烘干,加入少量蒸馏水溶解,定容至10 mL。 以葡萄糖为标准品,制作标准曲线,用苯酚硫酸法测定多糖含量, 选取胞外多糖产量最高的菌株作为目标菌株。
1.4.3 多糖含量测定[20]将按照1.4.2 操作所得的粗多糖溶液稀释10 倍,取2 mL 稀释后的多糖溶液于试管中, 分别加入1.0 mL 6%苯酚溶液和5.0 mL 浓硫酸,静置10 min 后振荡摇匀,室温静置20 min,测定其在490 nm 处的吸光值,并参照回归方程求出总糖含量。
1.5 菌株鉴定
1.5.1 生理生化测定及形态学鉴定 将目标菌株划线接种于LB 培养基上,28℃恒温倒置培养24 h,观察菌落形态特点,通过革兰氏染色和芽孢染色对菌体形态进行观察,并参考东秀珠等[21]的方法进行生理生化鉴定。
1.5.2 16S rDNA 分子生物学鉴定及系统发育树的构建 采用细菌基因组DNA 提取试剂盒(Omega bio-tek,America)提取细菌DNA,以27F和1492R 为引物进行PCR 扩增。 反应体系如下:12.5 μL 2×Taq mix,7.5 μL 去离子水,4 μL 模板DNA,引物各1 μL,总体积25 μL。PCR 反应体系组成为:95℃预变性3 min,95℃变性45 s,56℃退火45 s,72℃延伸45 s,30 个循环;72℃终延伸5 min。
产物经1%的琼脂糖凝胶电泳分离,阳性PCR产物经纯化后送北京奥科鼎盛生物科技有限公司测序。 所得序列与NCBI 数据库比对,采用MEGA 4.0 绘制系统进化树。
1.6 最佳培养基优化
1.6.1 粗多糖分离与多糖含量测定 将粗多糖溶液稀释100 倍后用苯酚硫酸法测定多糖含量,粗多糖的分离与多糖含量测定同1.4。
1.6.2 单因素实验 为提高产糖量,通过设计单因素实验,28℃160 r/min 振荡培养48 h 后测定产糖量,选择发酵因子中的最佳水平。
1.6.3 正交设计实验 在单因素实验结果的基础上,设计4 因素3 水平的正交实验(表1)。
2 结果与分析
2.1 菌株的筛选 从敦煌地区盐碱土壤中初筛共得到的18 株产多糖的菌株, 经编号并通过苯酚硫酸法测定多糖含量,结果表明,菌株Ⅱ4-01 胞外多糖产量最高,达到0.846 g/L。 选取菌株Ⅱ4-01 作为目标菌株。初筛所得18 株菌株胞外多糖产量如表2 所示。

表2 18 株菌株的胞外多糖产量
2.2 菌株鉴定 菌株Ⅱ4-01 在LB 培养基上培养24 h 后, 呈现白色不透明的单菌落, 表面粗糙皱褶,边缘不整齐,菌落直径约为3 mm。 革兰氏染色后呈阳性,芽孢染色后呈椭圆形,芽孢中生。 菌株Ⅱ4-01 可水解淀粉和纤维素,可利用柠檬酸盐,可分解色氨酸形成吲哚, 能分解葡萄糖产生乙酰甲基甲醇;对碳源的利用结果表明,菌株Ⅱ4-01 能利用葡萄糖、乳糖、麦芽糖、果糖、蔗糖、海藻糖、甘油,不能利用精氨酸(表3)。

表3 菌株Ⅱ4-01 的生理生化特征
经PCR 对16S rDNA 扩增得到片段长度约为1 450 bp 左右的序列, 测序后与NCBI 数据库进行Blast 比对。 结合菌株Ⅱ4-01 的形态学特征和生理生化鉴定结果,进一步证明菌株Ⅱ4-01 为一株地衣芽孢杆菌(Bacillus licheniformis)。
2.3 单因素实验
2.3.1 不同碳源对菌株Ⅱ4-01 EPS 产量的影响碳源是提供微生物营养所需碳元素的营养来源。除水分外,微生物需要量最大的营养物为碳源,碳源也决定微生物所产多糖的质量和数量[22]。对不同碳源的利用实验结果表明, 菌株Ⅱ4-01 对6 种碳源均可利用,不同碳源条件下胞外多糖产量为:蔗糖>淀粉>葡萄糖≈玉米粉>麦芽糖>甘油,以蔗糖为发酵培养基碳源时菌株Ⅱ4-01 的胞外多糖产量高达4.218 g/L(图2),因此确定蔗糖为最佳碳源。
2.3.2 不同氮源对菌株Ⅱ4-01 EPS 产量的影响
氮源能提供微生物生长所必须的核苷酸、维生素合成所需的营养物质。 不同氮源对菌株Ⅱ4-01 EPS 产量的影响如图2 所示,菌株Ⅱ4-01 对黄豆粉的利用能力明显高于其他氮源, 因此选择黄豆粉为最佳氮源。
2.3.3 不同无机盐对菌株Ⅱ4-01 EPS 产量的影响 无机盐是维持微生物生长代谢不可或缺的物质,其功能主要是参与菌体的构成、作为酶的组成部分、调节渗透压等[19]。 由图2 可知,向培养基中添加相同浓度的KCl、NaCl、MnCl2、CaCl2时, 菌株Ⅱ4-01 的EPS 产量并没有明显波动,而添加MgSO4时菌株Ⅱ4-01 EPS 产量明显高于添加其他4 种无机盐的产量。
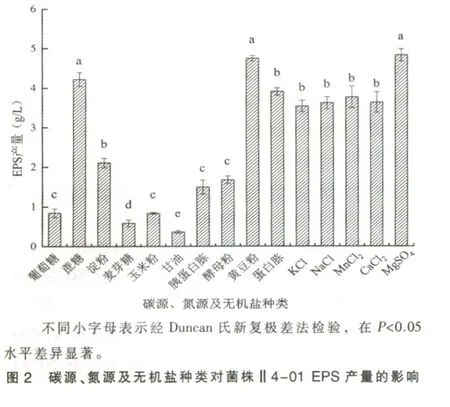
2.3.4 蔗糖浓度对菌株Ⅱ4-01 EPS 产量的影响碳源浓度对多糖产量影响较大,碳源浓度适宜时,菌株才能正常生长并产生大量代谢产物[12]。 将蔗糖浓度设置为1%、2%、3%、4%,探究碳源浓度对菌株Ⅱ4-01 EPS 产量的影响,结果如图3a 所示,随着蔗糖浓度的增加,EPS 产量逐渐升高,浓度为2%时增加明显。 考虑到经济因素,加之碳源浓度从2%~4%时,EPS 产量并未显著增加, 因此确定最佳蔗糖浓度为2%。
2.3.5 黄豆粉浓度对菌株Ⅱ4-01 EPS 产量的影响 氮源浓度对EPS 产量的影响如图3a 所示。随着氮源浓度增加,菌株Ⅱ4-01 EPS 产量呈现先升高后降低的趋势, 当氮源浓度为2%时,EPS 产量最高,达到4.801 g/L。
2.3.6 MgSO4浓度对菌株Ⅱ4-01 EPS 产量的影响将MgSO4浓度设置0.03%、0.04%、0.05%、0.06%、0.07% 5 个梯度。 由图3b 可知,随着MgSO4浓度的增加,EPS 产量先升高后降低,当MgSO4浓度为0.05%时,EPS 产量达到5.359 g/L。
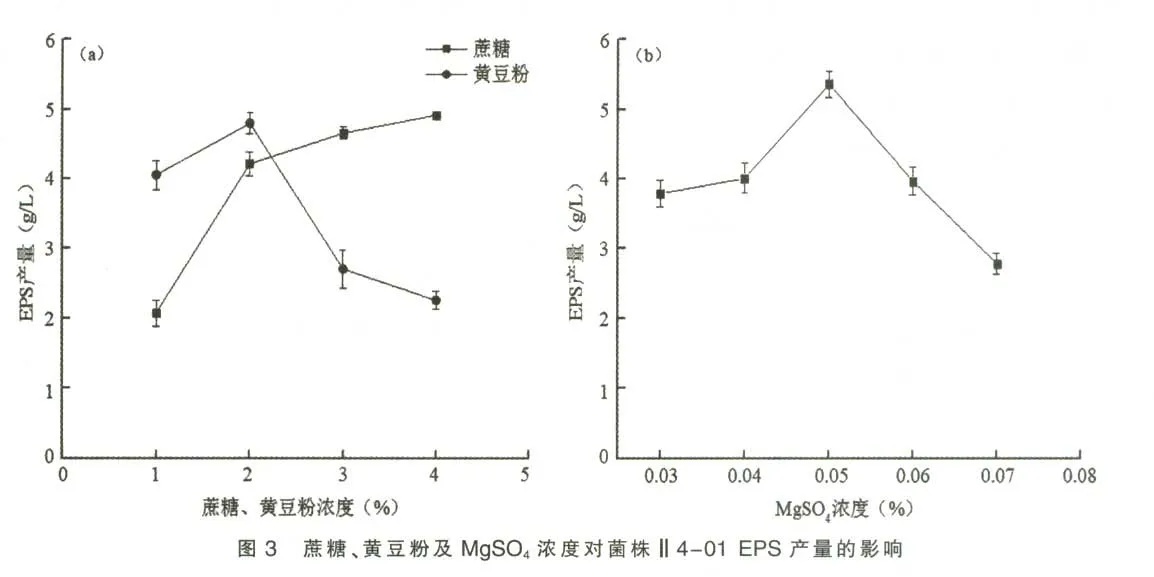
2.3.7 培养基pH 对菌株Ⅱ4-01 EPS 产量的影响 pH 对微生物生长和代谢途径都有很大影响。将上述优化发酵培养基的初始pH 调整为5.0、6.0、7.0、8.0、9.0,pH 对 菌 株Ⅱ4-01 EPS 产 量 的影响如图4 所示。 当培养基中初始pH 在5.0~8.0时, 菌株Ⅱ4-01 EPS 产量逐渐增加,pH 为8.0时,产糖量达到最大,为5.56 g/L。 当pH 超过8.0以后,产糖量逐渐下降。

2.4 正交实验 以单因素实验为基础, 设计4 个因素3 个水平,采用L9(34)进行正交实验(表4)。由极差分析可知, 对EPS 产量影响最大的因素排序为:碳源浓度(A)>pH(D)>无机盐浓度(C)>氮源浓度(B),因此,在培养条件相同的情况下,碳源浓度对菌株Ⅱ4-01 EPS 产量的贡献最大。 由表4 可知, 菌株Ⅱ4-01 EPS 产量最高的最佳培养基组合为:A3B3C2D1,即最佳培养基配方为蔗糖25.0 g/L,黄 豆 粉25.0 g/L,MgSO40.5 g/L,Na2HPO4·12H2O 2 g/L,NaH2PO4·2H2O 1 g/L,pH=7.5。
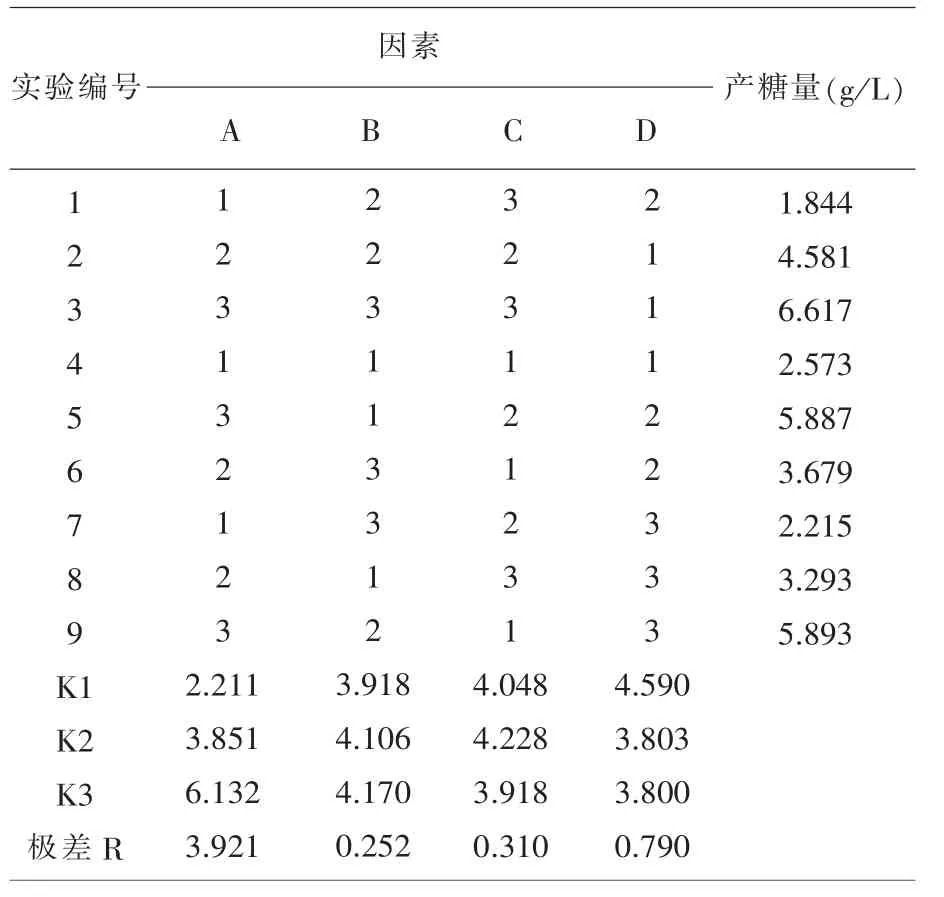
表4 正交实验结果
2.5 生长曲线分析 经优化后的发酵培养基进行摇瓶发酵,每隔12 h 取1 次样,测定EPS 产量和生物量。结果如图5 所示,菌株Ⅱ4-01 在24 h 前为对数期,24 h 后为稳定期,生物量在36 h 达到最大,此时菌株EPS 产量也达到最大,为8.594 g/L。36 h 后,菌株Ⅱ4-01 进入衰亡期,生物量和EPS 产量也逐渐下降。 由图中曲线可知,菌株Ⅱ4-01 生物量和EPS 产量基本上成正比。因此,选择36 h 为菌株Ⅱ4-01 多糖的最佳收取时间。

3 讨论
由于极端环境的微生物具有特殊的生理机能、基因类型和代谢产物,蕴藏着极大的科学和应用价值,因此成为生物学研究的热点之一[23]。从海洋、南极等地获得的胞外多糖样品是目前对极端环境下胞外多糖研究炙手可热的方向之一。 从海洋、南极等地分离得到的胞外多糖样品将有可能成为人类治疗肿瘤、心血管疾病等的重要药用资源[24]。 但是目前对盐碱土壤下的微生物胞外多糖的研究报导较少,F. Moshabaki Isfahani 等[25]在高盐环境下分离得到3 株产EPS 菌株B. aerus ATHM35,A.luteolus ATHM36 和H. eurihalina ATHM 37,其中H.eurihalina ATHM 37 产糖量最高,为0.277 g/L;Juan Antonio Mata 等[14]从西班牙南部Jaén 地区盐碱土壤中分离得到菌株H. ventosae Al12 T 和Al16,在最佳培养条件下, 其产糖量分别为0.2835 g/L和0.2895 g/L, 此外还从西班牙马拉加省的内陆湿地Fuente de Piedra 盐碱土壤中分离得到菌株H.anticariensis FP35T 和FP36,其在最优条件下其产糖量分别为0.4360 g/L 和0.5095 g/L;Amjres等[26]分离得到的一株嗜盐菌在最佳培养条件下产糖量为3.89 g/L。 与上述研究相比,菌株Ⅱ4-01EPS在产量方面优势明显,开发和应用研究价值突出。
芽孢杆菌属菌株能产生多种EPS,例如,果聚糖、β-1,3-葡聚糖和主要由中性糖组成的杂聚物, 以及糖醛酸或糖蛋白结合物等。 相关研究表明,一些分离自芽孢杆菌的EPS 显示出优异的乳化、絮凝、重金属去除能力或药物活性[27]。 王正荣等[28]从沙漠结皮中分离得到的一株芽孢杆菌所产胞外多糖具有较强的絮凝活性;袁建锋等[29]筛选得到的一株芽孢杆菌所产胞外多糖在体外抗氧化实验中显示出较强的抗氧化性, 并且对脂质过氧化有抑制作用, 是一种优良的天然抗氧化剂;Ruiz-Bravo A 等[30]研究结果表明,实验室分离得到的一株芽孢杆菌所产胞外多糖具有免疫调节特性,能在体外诱导淋巴细胞增殖。 但是,目前对于地衣芽孢杆菌的研究主要集中在微生态制剂[31]或益菌素的生产[32],对胞外多糖的研究相对较少。 彭爱铭等[33]研究了1 株产EPS 的地衣芽孢杆菌TS-01 的发酵培养基和培养条件,发现该菌株在最优条件下产糖量为3.65 mg/mL,本实验室分离得到的菌株Ⅱ4-01 在最佳培养基中,即在蔗糖25.0 g/L, 黄豆粉25.0 g/L、MgSO40.5 g/L、Na2HPO4·12H2O 2 g/L、NaH2PO4·2H2O 1 g/L、pH=7.5的培养基中发酵培养36 h 后,产糖量为8.594 g/L,明显优于菌株TS-01。此外,彭爱铭等[33]发现菌株TS-01 所产EPS 在一定浓度下清除自由基能力显著, 同时能增强T、B 淋巴细胞的增殖, 结合Chunhui Liu 等[27]从中国济南附近某果园土样中分离得到的地衣芽孢杆菌8-37-0-1 的胞外多糖能显著刺激脾淋巴细胞的增殖这一研究结果,本研究分离得到的菌株Ⅱ4-01 所产EPS 是否具有同样的免疫学活性值得深究。
与此同时这些研究也表明, 现有对盐碱环境下产糖微生物的研究主要集中在产EPS 菌株的筛选、EPS 的提取等方面,对于盐碱环境下分离得到的EPS 是否具有重要的生物功能和药用价值还需进一步研究和开发。 另外还有一些研究表明细菌EPS 能结合钠离子并降低其在土壤中的毒性[34],因此,敦煌地区分离得到的细菌EPS 能否改善土壤盐碱化程度也值得进行深入研究。
