超声辅助热水提取对铁皮石斛水溶性多糖得率和结构的影响
2019-05-23金蓉谢文华陈杰标王念晨项白雪王岳曹锦萍
金蓉,谢文华,陈杰标,王念晨,项白雪,王岳,曹锦萍*
(1.浙江大学农业农村部园艺植物生长发育与品质调控重点开放实验室,杭州 310058;2.浙江大学农业试验站,杭州 310058)
铁皮石斛(Dendrobium officinaleKimura et Migo)是我国传统的药食同源植物,其茎干常用作保健食品。铁皮石斛茎干富含水溶性多糖,可占其干质量的19.2%~58.0%[1-3]。现代医学研究表明,铁皮石斛水溶性多糖具有抗氧化损伤[4]、抗癌[5]、抗疲劳[6]和免疫调节[7-8]等功效。因此,水溶性多糖含量是铁皮石斛品质评估的重要指标之一[9]。
提取铁皮石斛水溶性多糖最常用的方法为热水回流提取,并结合乙醇沉淀[1,9]。此外,还有酶解法[10]、超声辅助提取法[11]和微波辅助提取法[12-13],可在一定程度上改善提取效率。
超声辅助提取是目前广泛使用的物质提取方法,它通过机械、热学及空化等作用加速目标成分进入溶剂,操作简便。在牛肝菌(Boletus edulis)、莴苣(Lactuca sativa)、菱角(Trapa quadrispinosa)、蚬(Corbicula fluminea)等多种动植物多糖提取研究中均发现,利用超声辅助提取可提高提取效率[14-17]。前人就多糖超声辅助提取方法优化已有大量报道,发现影响提取得率的因素主要有超声强度、超声时间和提取温度[14,16-17]。在一定范围内,多糖得率随着超声强度、时间和提取温度的升高而升高[16,18-19],但在高强度的超声条件下,多糖的结构会发生一定程度的改变。已有的研究表明,超声辅助提取会使多糖溶液黏度和颗粒大小下降[20-21],并改变多糖分子的单糖组成[22]。此外,超声处理会产生降解的多糖片段[23],并且超声处理后多糖的生物活性往往有所提高[22,24]。
目前,在铁皮石斛品质评估中对水溶性多糖含量的定量分析仍用传统的热水回流方法[9],但当样品较多时,需分批进行提取,耗时费力。尽管超声辅助提取在其他植物多糖提取中已广泛应用,但在铁皮石斛水溶性多糖提取方面仅见超声水浴辅助提取方法的优化研究[11],而对于超声热水辅助提取工艺及其对铁皮石斛水溶性多糖结构的影响尚未有报道。为此,本研究旨在比较常温和热水提取体系中超声辅助提取对铁皮石斛水溶性多糖得率和结构的影响,为超声辅助提取方法在铁皮石斛水溶性多糖提取中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
13个铁皮石斛品种的二年生植株采自浙江大学农业试验站种植基地,分别为‘浙农3号’、‘仙源种’、‘牧歌 2 号’、‘牧歌 2 号’高产型品系、‘牧歌 1号’、‘圣兰 8 号’、‘原生种’、‘浙南种’、‘牧歌 1 号’耐寒型品系、‘牧歌3号’、‘天柱峰种’、‘霍山种’和‘浙中种’。将植株茎干和叶片分别切成小块,经液氮速冻后置于-80℃冰箱中保存,待用。
3-甲基-1-苯基-2-吡唑啉-5-酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)、甘露醇、葡萄糖、半乳糖、阿拉伯糖、鼠李糖、岩藻糖、木糖、半乳糖醛酸和葡萄糖醛酸为色谱纯试剂,购自上海阿拉丁生化科技股份有限公司。色谱纯乙腈和三氟乙酸(trifluoroacetic acid,TFA)购自美国Sigma-Aldrich公司。其他分析纯试剂购自国药集团化学试剂有限公司。
1.2 多糖提取条件比较
将铁皮石斛茎干在液氮中研磨成粉末,称取约3 g,按照料液质量体积比为3∶200的比例加入室温(约14℃)或煮沸(约100℃)的蒸馏水。按照表1所示的提取参数进行提取,并用温度计测量水温。超声辅助提取仪为JY92-IID超声波细胞粉碎机(浙江宁波新芝生物科技股份有限公司),功率为20 kHz。提取液用4层纱布进行真空抽滤,滤渣再用50 mL蒸馏水冲洗和过滤。合并滤液(约250 mL),于45℃条件下减压蒸发浓缩至100 mL,向溶液中缓缓加入4倍体积经4℃预冷的95%乙醇,充分混匀后于4℃条件下静置过夜,沉淀多糖。离心收集沉淀,并依次用无水乙醇、丙酮和乙醚洗涤沉淀各2次。将沉淀物于60℃条件下烘干,得到富含多糖的水溶性组分(water-soluble fraction,WSF),称量后于4℃条件下储存,待用。每个提取方法重复3次。
1.3 多糖含量和纯度检测
多糖含量测定参照前人的苯酚-硫酸法[25]并稍作改进。将WSF溶于蒸馏水,配成0.1 mg/mL溶液,取0.06 mL多糖溶液与0.18 mL苯酚-硫酸测定液(5%苯酚溶液与98%浓硫酸按体积比1∶5混匀而成)混匀,沸水浴反应30 min后用BioTek Synergy H1酶标仪在490 nm波长下进行读数。用葡萄糖溶液制作标准曲线,所得结果以g/kg(按鲜质量计)表示。
多糖中所含的酚类杂质含量测定按Folin-Ciocalteu法[26]并稍作改进。将WSF溶于蒸馏水,配成5 mg/mL溶液,取0.1 mL该溶液,加入0.8 mL蒸馏水和0.1 mL 0.5 mol/L Folin-Ciocalteau试剂,混匀后加入0.2 mL 75 g/L Na2CO3溶液,混匀,置于30℃条件下反应2 h。反应产物用BioTek Synergy H1酶标仪在760 nm波长下进行读数。用没食子酸溶液制作标准曲线,所得结果以mg/g(按鲜质量计)表示。
多糖中所含的蛋白质杂质按照Bradford法蛋白质定量试剂盒(Bio-Rad公司,美国)说明书进行定量。
1.4 多糖相对分子质量测定
采用凝胶渗透色谱法(gel permeation chromatography,GPC)对多糖样品的相对分子质量进行测定。将样品用水溶解后配成5 mg/mL溶液,上样量为50 μL。具体色谱条件为:Waters 1525液相色谱系统;Waters 2414示差折光检测器;TSKGEL G4000 PWXL凝胶色谱柱(Tosoh公司,日本);流动相为0.2 mol/L NaCl,流速为0.5 mL/min,柱温40℃,检测器温度40℃。采用摩尔质量为6.7×105、4.1×105、2.7×105、1.5×105、0.8×105、0.5×105、0.25×105和0.12×105g/mol的葡聚糖标准品(GE公司,美国)制作标准曲线,并用于多糖相对分子质量计算。
1.5 多糖的红外光谱分析
将1 mg WSF与100 mg KBr粉末混匀后压成厚度为1 mm的薄片,在4 000~400 cm-1范围内进行红外光谱扫描,分辨率为4 cm-1,扫描次数为32。
1.6 多糖的刚果红结合试验
多糖的刚果红结合能力测试参照NIE等的方法[15]并稍作修改。将WSF溶于蒸馏水,配成1 mg/mL溶液,取1 mL该溶液与等体积的80 μmol/L刚果红溶液混合。将1 mol/L NaOH逐渐加入混合溶液中,使混合液中NaOH终浓度分别达到0.1、0.2、0.3、0.4和0.5 mol/L,室温放置5 min后用DU-8000分光光度计(Beckman公司,美国)进行全波长扫描,测定混合液的最大吸收波长。对照用蒸馏水代替多糖溶液进行反应和测定。
1.7 铁皮石斛水溶性多糖的单糖组成分析
采用柱前衍生高效液相色谱法分析单糖组成[27]。称取1 mg WSF样品,用1 mL 2 mol/L TFA溶液溶解,加入安瓿瓶中,于密闭、120℃条件下水解2h。水解产物于30℃条件下旋转蒸干后,用甲醇溶解、蒸干,重复3次,以去除TFA残留。将蒸干后的样品溶于100 μL蒸馏水中,制成10 mg/mL样品溶液,用于衍生化分析。每个样品设3个重复。
衍生化分析步骤如下:取样品或标准品溶液100 μL,加入120 μL 0.5 mol/L PMP 溶液和100 μL 0.3 mol/L NaOH溶液,于70℃水浴反应1 h,冷却至室温后加入100 μL 0.3 mol/L HCl溶液中和,然后加入1 mL二氯甲烷萃取,以1×104r/min离心5 min,取上层水相,再用二氯甲烷萃取2次,即得衍生产物,用0.22 μm滤膜过滤后用于高效液相色谱(high performance liquid chromatography,HPLC)分析。HPLC分析条件为:Water 2695-2996液相色谱系统(Waters公司,美国);Sunfire C18色谱柱(Waters公司,美国);柱温25℃;流动相为NaOH-KH2PO4缓冲液(pH 6.7)(A相)和乙腈(B相);洗脱程序为0~30 min,18%B→30~60 min,18%~25%B→60~65 min,25%~18%B;上样量10 μL;流速1 mL/min;检测波长245 nm。
1.8 品种间多糖含量比较
将13个铁皮石斛品种的茎干和叶片分别在液氮中研磨成粉,采用超声辅助热水提取法(超声频率20 kHz,功率500 W,95~100℃热水)提取3 min,提取过程参照1.2中描述的方法,对所得到的WSF称量,并计算多糖含量。每个样品设置3个重复。
1.9 数据统计分析
实验数据以平均值±标准差表示。采用SPSS 20.0软件对数据进行统计分析,并采用邓肯显著性检验方法对组间数据进行多重比较。
2 结果与讨论
2.1 不同提取参数对铁皮石斛水溶性多糖得率的影响
以铁皮石斛品种‘圣兰8号’为例,不同提取参数对其多糖WSF得率的影响见表1。可以看出,在不同提取参数下,‘圣兰8号’茎干多糖WSF提取得率为67.40~121.90 g/kg(按鲜质量计)。常温水(14℃)在不同功率超声辅助提取过程中温度会略有升高(均在20℃左右),而热水(100℃)则有所降低,为95~100℃。在常温提取体系中,超声功率低于100 W时,WSF得率随着功率升高而增加,而超声功率升至500 W时,WSF得率反而下降。该结果与前人的报道[18-19]类似,表明超声辅助提取多糖时其强度有一个最适范围。然而,在超声和热水结合的提取体系中,超声功率100 W与300 W之间差异并不显著,且均显著低于热水回流提取(对照),原因可能是超声辅助提取时间较短(3 min),而热水回流时间较长(2 h)。当热水提取体系中超声功率达到500 W时,提取效率显著升高,并接近于热水回流提取2 h的得率。在相同超声强度下,热水提取体系的得率显著高于常温提取体系。因此,超声辅助热水提取可以提高铁皮石斛多糖得率,并大大缩短提取时间。
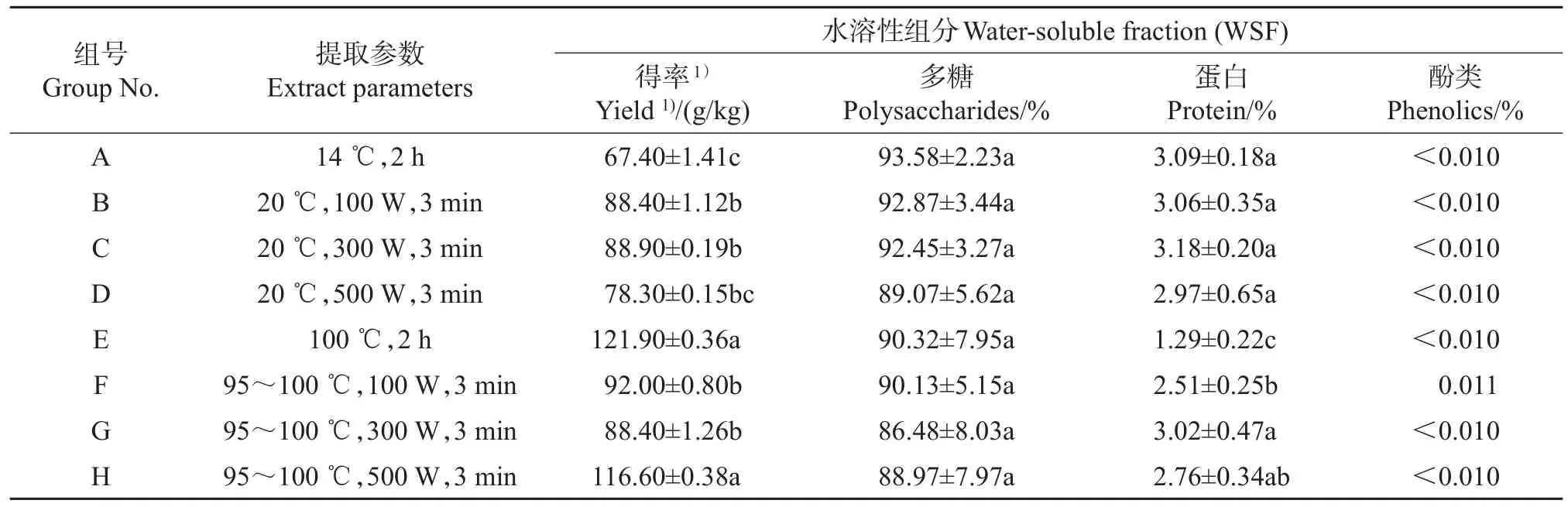
表1 在不同提取参数下‘圣兰8号’铁皮石斛水溶性多糖的得率和纯度Table 1 Yield and purity of water soluble polysaccharides from Dendrobium officinale‘Shenglan No.8’under different extract parameters
植物中提取的多糖样品常常含有酚类物质和蛋白质等杂质。如表1所示,本研究得到的WSF多糖含量为86.48%~93.58%,酚类物质含量均≤0.011%,而蛋白质杂质含量为1.29%~3.18%。总体而言,热水提取得到的WSF中蛋白质含量较冷水提取得到的WSF中的低,可能的原因是部分蛋白质在热水提取时发生变性沉淀,在过滤时被去除。在常温和热水提取系统中,WSF中的蛋白质杂质含量均表现为:前期随着超声强度的升高而升高,但当超声功率达到500 W时,蛋白质杂质含量下降。
总之,从提取用时、得率和纯度等方面综合考虑,在超声强度为500 W、水温为95~100℃、提取时间为3 min时铁皮石斛水溶性多糖的提取效率最高。
2.2 不同提取参数对铁皮石斛水溶性多糖摩尔质量的影响
GPC分析结果表明,常温搅拌提取得到的铁皮石斛水溶性多糖GPC图谱为分布较为均一的单个宽峰(图1),重均相对摩尔质量(Mw)为2.95×105g/mol,多分散度为4.74(表2)。超声辅助提取后,在小分子质量区域出现了明显的峰,其中500 W超声辅助提取最为明显(图1)。此外,超声辅助提取使铁皮石斛水溶性多糖的摩尔质量分布范围更宽,表现为多分散度(polydispersity,PDI)值明显升高,其中以500 W超声辅助提取的PDI值最高(表2)。这些结果表明,高强度超声辅助提取会造成铁皮石斛水溶性多糖链结构的破坏。
前人在植物多糖提取研究时发现,超声处理会降低多糖分子质量[21,24]。在本研究中,我们发现超声辅助提取后铁皮石斛多糖GPC图谱从均一分布的单峰变为多峰,并在低分子质量区域出峰(图1),这一结果与前人研究结果相一致。前人研究还发现,超声处理后多糖摩尔质量分布更窄[21],但本研究发现超声辅助提取得到的铁皮石斛多糖摩尔质量分布更宽,表现为PDI值增加(表2),推测可能与不同植物多糖耐降解特性不同,以及在不同研究中超声强度等具体提取参数有所差异相关。此外,由图1可知,经超声处理,尤其是经500 W处理的样品在GPC分析时提早出峰,表明大分子质量多糖的比例较高,推测超声处理对大分子质量多糖的提取可能具有促进作用。
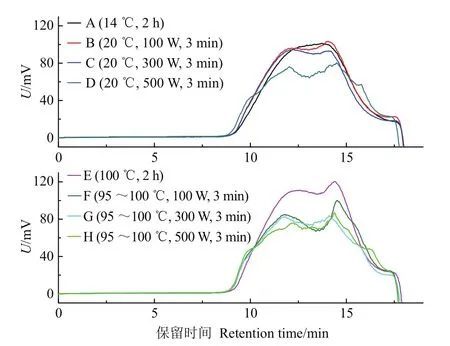
图1 不同提取参数下‘圣兰8号’铁皮石斛多糖的GPC图谱Fig.1 GPC spectrum of water soluble polysaccharides from D.officinale‘Shenglan No.8’under different extract parameters
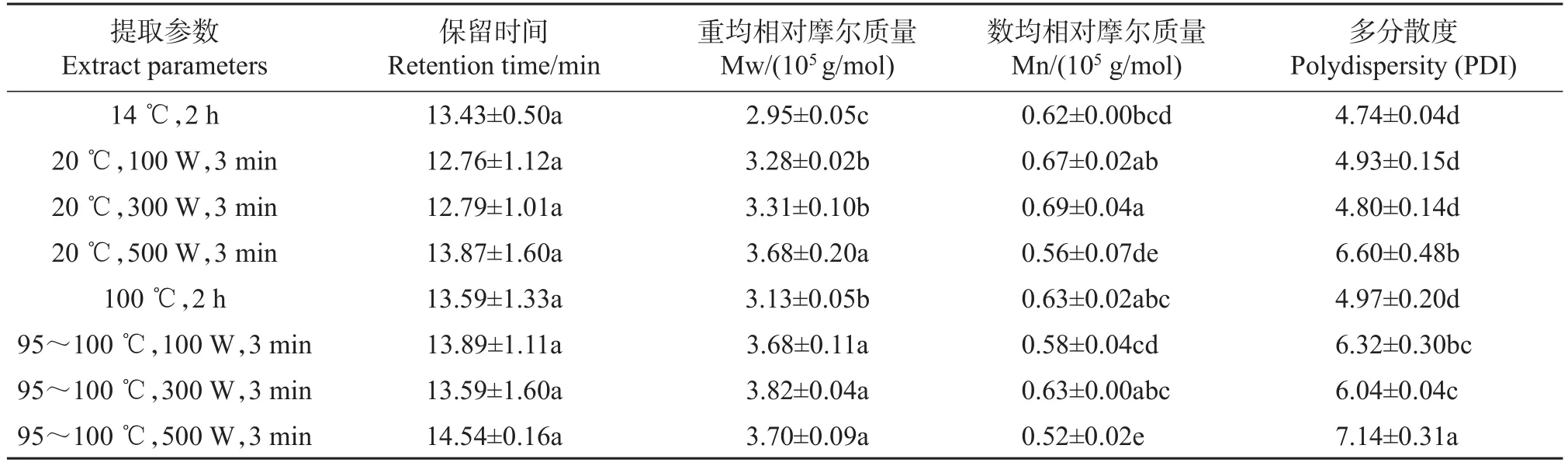
表2 不同提取参数下‘圣兰8号’铁皮石斛水溶性多糖摩尔质量Table 2 Molecular size of water soluble polysaccharides from D.officinale‘Shenglan No.8’under different extract parameters
2.3 不同提取参数对铁皮石斛水溶性多糖刚果红结合能力的影响
刚果红可与含三股螺旋链构象的多糖发生络合反应,进而使络合物的吸收发生红移,且在一定的NaOH浓度范围内呈亚稳性,呈现最大吸收波长的特征变化。本研究结果(图2)表明:铁皮石斛水溶性多糖能使刚果红溶液最大吸收波长发生红移,表明铁皮石斛多糖具有一定的刚果红结合能力,因此可能存在三股螺旋结构,这与前人的报道[8,28]相一致;在0~0.5 mol/L NaOH溶液中,在各提取参数下得到的铁皮石斛多糖与刚果红的结合能力保持稳定(最大吸收波长基本恒定),表明超声辅助提取对多糖的刚果红结合能力无明显影响,说明本研究的超声条件对三股螺旋结构无显著影响。
2.4 不同提取参数对铁皮石斛水溶性多糖红外光谱的影响
从铁皮石斛多糖红外图谱(图3)可以看出:在3 100~3 600 cm-1之间的宽峰是由O—H伸缩振动引起的;在2 920 cm-1和2 886 cm-1处为C—H伸缩振动峰;1377cm-1处为C—H变角振动峰[8,29];1730 cm-1处的吸收峰属于酯羰基C═O伸缩振动,表明分子中存在乙酰基团[8,29-30];1 644 cm-1处为结合水的特征峰[30];1 251 cm-1处的吸收峰是由O-乙酰基团的C—O伸缩振动引起的;1 031 cm-1属于糖环的特征吸收峰[8];此外,897 cm-1处的吸收峰表明多糖中存在β-糖苷键[7-8]。
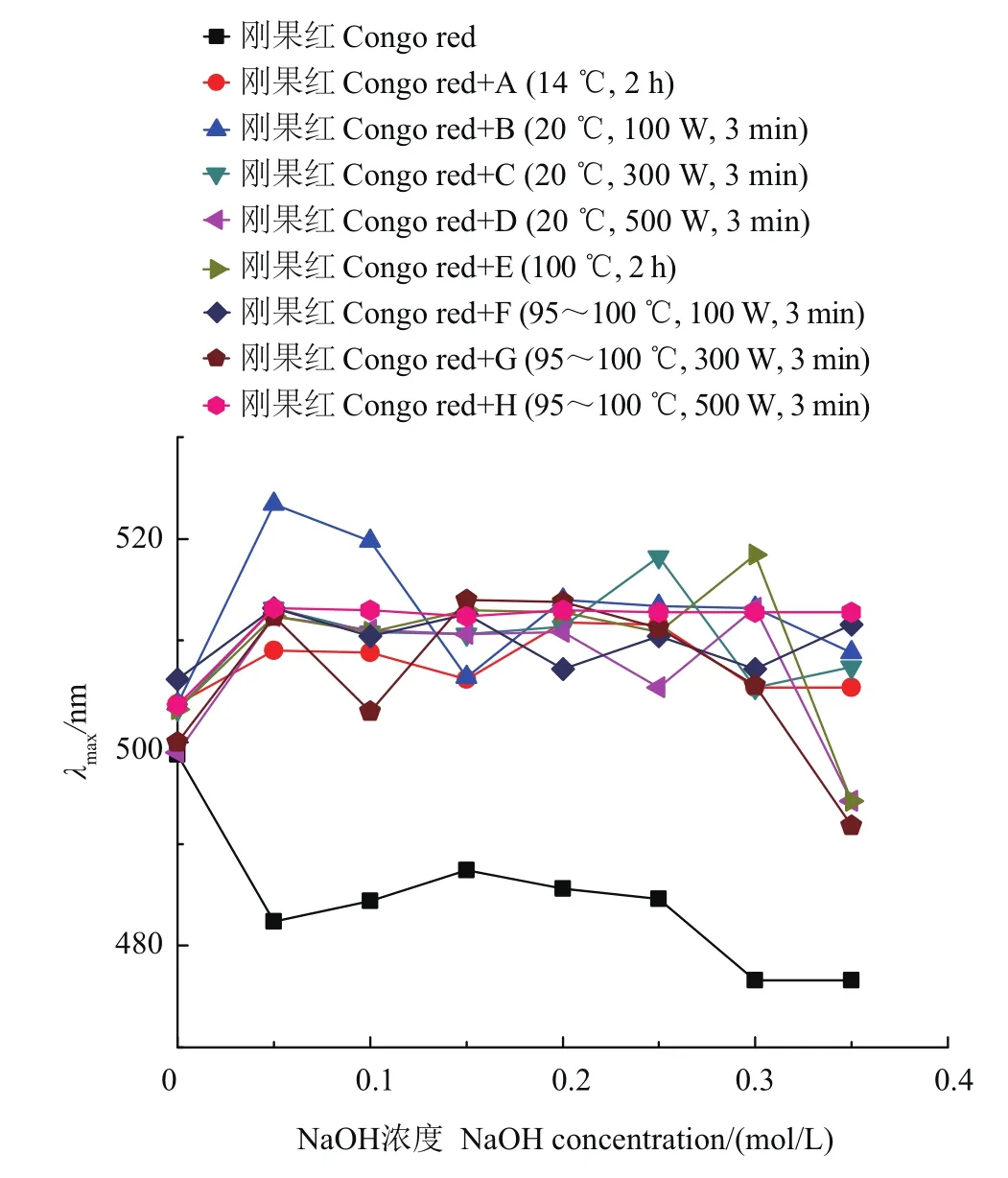
图2 不同提取参数下‘圣兰8号’铁皮石斛水溶性多糖的刚果红结合能力Fig.2 Congo red binding capacity of water soluble polysaccharidesfromD.officinale‘ShenglanNo.8’under different extract parameters
在不同提取参数下得到的铁皮石斛多糖的红外图谱相似(图3),表明超声强度对铁皮石斛多糖的一级结构没有影响。这与前人对魔芋葡甘露聚糖[20]、桑黄多糖[21]的研究结果一致。
2.5 不同提取参数对铁皮石斛水溶性多糖单糖组成的影响
从表3和图4可以看出:铁皮石斛‘圣兰8号’水溶性多糖的主要单糖成分为甘露糖和葡萄糖,在不同提取参数下甘露糖和葡萄糖的摩尔百分比分别为75.58%~79.48%和15.76%~21.02%;此外,还检出了4种中性单体(鼠李糖、阿拉伯糖、半乳糖和木糖)及2种糖醛酸(葡萄糖醛酸和半乳糖醛酸),但所占摩尔比例均不超过2%。前人研究也发现,甘露糖和葡萄糖是铁皮石斛水溶性多糖的主要单糖成分[2,7-8,29]。LUO 等[30]检测发现 ,铁皮石斛水溶性多糖除含有甘露糖和葡萄糖外,还含有阿拉伯糖和少量的半乳糖醛酸,4种单糖的摩尔比为6.2∶2.3∶2.1∶0.1;XING等[2]发现,铁皮石斛多糖中含有甘露糖、葡萄糖、半乳糖和阿拉伯糖4种单糖组分。本研究发现,鼠李糖、木糖和葡萄糖醛酸也是铁皮石斛多糖的单糖组分,这在以往文献中均没有报道。
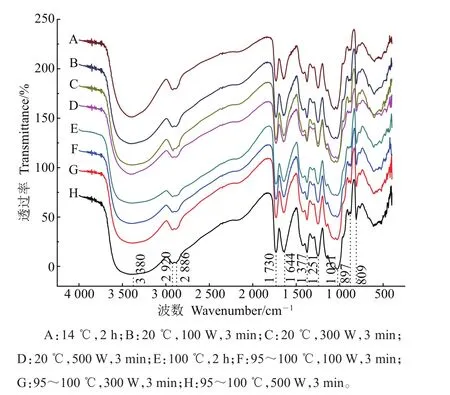
图3 不同提取参数下‘圣兰8号’铁皮石斛水溶性多糖的红外图谱Fig.3 Infrared spectrum of water soluble polysaccharides from D.officinale‘Shenglan No.8’under different extract parameters
如表3所示,在常温和热水提取体系中,超声辅助提取对于铁皮石斛多糖的单糖组成均无显著影响,这与前人在桑黄多糖中的研究结果[21]一致。因此,短时间超声辅助热水提取法适用于制备用于单糖组成分析的铁皮石斛多糖。
2.6 铁皮石斛品种间水溶性多糖含量比较
前文的研究结果表明,500 W超声辅助热水提取铁皮石斛多糖的效率最佳,得率与传统的沸水回流提取相当,因而,该方法适用于不同铁皮石斛样品间多糖含量的比较。本研究将该方法应用于13个铁皮石斛品种茎和叶片多糖含量的定量分析,结果(图5)表明:13个品种铁皮石斛二年生茎的多糖含量高于叶片,茎中为69.40~130.10 g/kg(按鲜质量计),叶片中为15.30~34.10 g/kg(按鲜质量计)。各品种间的多糖含量存在较大差异,并随组织不同而有所不同,其中:茎中多糖含量最高的品种为‘浙农3号’,最低的为‘浙中种’,前者为后者的1.87倍;叶片多糖含量最高的品种为‘浙南种’,最低的为‘天柱峰种’,前者为后者的2.23倍。

表3 不同提取参数下铁皮石斛‘圣兰8号’多糖的单糖组成Table 3 Monosaccharide composition of water soluble polysaccharides from D.officinale‘Shenglan No.8’under different extract parameters %
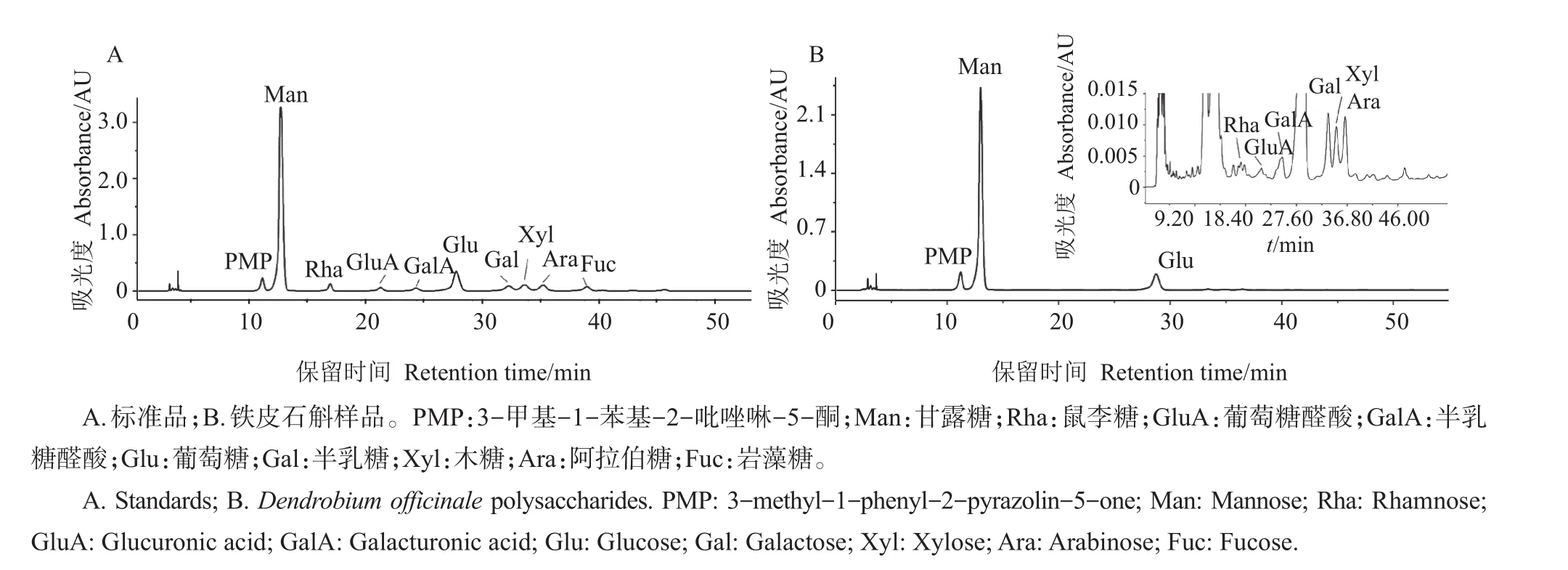
图4 铁皮石斛‘圣兰8号’水溶性多糖中单糖组成的HPLC图谱Fig.4 HPLC spectrum of monosaccharides from D.officinale‘Shenglan No.8’water soluble polysaccharides
前人研究结果表明,从广东、浙江、云南和福建等产地采收的铁皮石斛新鲜茎干中多糖质量分数为1.22%~5.59%,叶片中多糖质量分数为0.95%~1.90%[31],而铁皮石斛干样中多糖质量分数平均为58.3%[2]。本研究分析的13个铁皮石斛品种的多糖含量普遍高于前人的报道[31]。铁皮石斛水溶性多糖含量因品种、苗龄、产地和栽培管理措施等因素而异[1],这可能是造成不同研究之间其含量差异的原因。
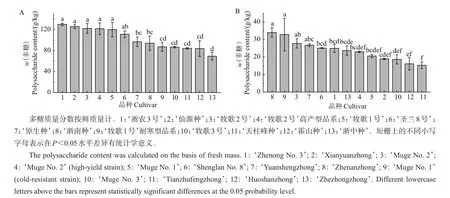
图5 不同品种二年生铁皮石斛茎(A)和叶片(B)的多糖含量Fig.5 Polysaccharide contents of stems(A)and leaves(B)from different D.officinale cultivars
3 结论
超声辅助显著提高了铁皮石斛多糖的提取效率,筛选出的最佳参数为在95~100℃条件下超声辅助(功率500 W)提取3 min。GPC分析结果表明,超声辅助提取会造成铁皮石斛多糖PDI值升高,表明超声辅助提取在一定程度上造成了水溶性多糖链结构的破坏。红外光谱、刚果红结合能力和单糖组分分析结果表明,超声提取对多糖的一级结构和螺旋结构无明显影响。本研究建立的超声辅助热水提取法高效快捷,避免了传统的热水回流方法的耗时、费力,且每次分析只能处理少量样品等缺点,可应用于铁皮石斛多糖含量和单糖组成分析等试验。对铁皮石斛13个品种的茎和叶片水溶性多糖含量进行比较发现,茎中水溶性多糖含量高于叶片,且品种间存在较大差异。
