响应面法优化提取香菜根中总黄酮的工艺研究
2019-05-22张珍杨秦肖洪史晶晶金玉成刘士健
张珍,杨秦,2,肖洪,3,4,史晶晶,金玉成,刘士健*
(1.西南大学 食品科学学院,食品科学与工程国家级实验教学示范中心(西南大学),重庆 400715; 2.西南大学 柑桔研究所,重庆 400712;3.北京正博和源科技有限公司,北京 102400; 4.北京正博和源科技有限公司重庆分公司,重庆 400716)
香菜的别称是芫荽,是伞形科植物的一种,作为一种芳香蔬菜,香菜是历史上最早被食用的,因为它具有特殊的香味,也常常被用作调味料,香菜最早被发现是在地中海沿岸及中亚地区,西汉时期被传入中国,同时对中国古代的饮食产生了很大的影响[1-4]。香菜的茎叶中具有丰富的营养素,如蛋白质、脂肪、矿物质、纤维素、钾、钙、钠、铁、维生素等。对香菜根部进行检测,发现其根部也具有多种化学成分,这些化学成分有糠醛、不饱和脂肪酸酯、萜类、黄酮等[5],同时香菜根可以作为提取天然糠醛的原料[6]。
总黄酮按结构可分为黄酮类、黄酮醇类、异黄酮类、二氢黄酮类等[7]。众多实验结果表明总黄酮具有很强的抗氧化性、抗病毒能力[8],能够抑制炎症、多种疾病甚至癌症[9],有的黄酮还具有抗心血管疾病的作用[10]。黄酮的提取方法有热水提取法、超声提取法、碱液提取法、超滤法、微波提取法等[11],其中超声提取法和微波提取法有提取时间短、提取量多、提取条件温和对总黄酮的活性影响较小等优点[12,13]。黄酮含量的测定方法有分光光度法、高效液相色谱法、薄层扫描法、毛细管电泳法等[14],毛细管电泳法前期处理样品简单,溶剂消耗少,结果准确,是值得推荐的测量方法[15]。人们习惯使用香菜茎叶,往往会将香菜根丢弃,香菜的根部含有一定量的黄酮,然而对香菜根中的提取工艺黄酮研究较少,因此本研究探索了响应面法优化提取香菜根中总黄酮的工艺,为香菜的研究提供了参考。
1 材料与方法
1.1 材料与仪器
香菜根 山东省泰安市;芦丁(Rutin)标准品 安徽合肥博美;无水乙醇、亚硝酸钠、氢氧化钠等试剂(均为分析纯);722型可见光分光光度计 上海菁华科技仪器有限公司;HH-4数显恒温水浴锅 常州澳华仪器有限公司;1580多功能离心机 基因有限公司。
1.2 试验方法
1.2.1 标准曲线的测定
精确称取0.0191 g干燥的芦丁标准品放于烧杯中,用70%的乙醇溶解,用玻璃棒引流至100 mL的容量瓶中,玻璃棒和烧杯需用70%的乙醇多次润洗,用70%乙醇定容,摇匀,得质量浓度为0.0191 g/mL的标准溶液。先用移液管分别吸取1,2,3,4,5,6 mL标准品溶液,置于6个25 mL容量瓶中,空白容量瓶中用移液管移取6 mL 70%乙醇溶液,再加入1 mL 5%亚硝酸钠溶液,摇匀,6 min后加入1 mL 10%硝酸铝溶液,摇匀,6 min后加入10 mL 4%氢氧化钠溶液,摇匀,用体积分数70%的乙醇定容至25 mL,充分摇匀,静止15 min后,于510 nm波长处测定吸光度,并绘制标准曲线[16]。标准曲线方程为y=0.4572x+0.0017;相关系数R2=0.9998。标准曲线图见图1。
1.2.2 总黄酮含量的计算
由标准曲线得到样品溶液的浓度,再根据浓度计算总黄酮的含量:
总黄酮提取量(mg/g)=C×V×n/W。
式中:C为标准曲线上获得的浓度,g/mL;V为黄酮提取液的体积,mL;n为稀释倍数;W为香菜根粉末的重量,g。
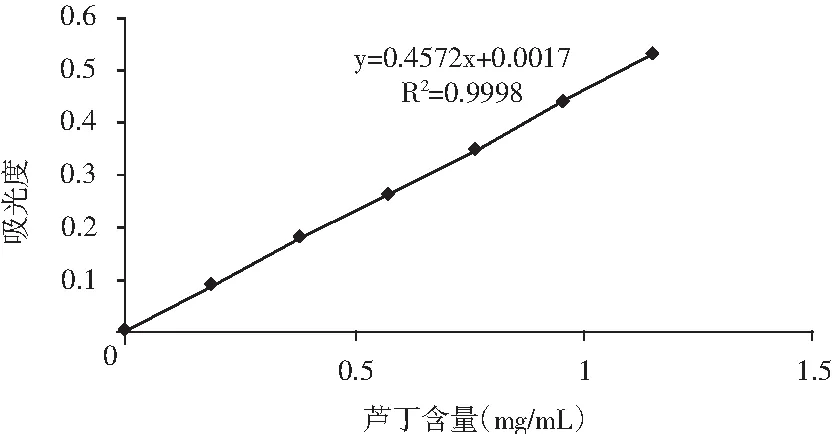
图1 芦丁溶液标准曲线图Fig.1 Standard curve of rutin solution
1.2.3 单因素试验
将购买的香菜根洗净,切成小段,放置于电热恒温干燥箱内,70 ℃干燥6 h至恒重。干燥好的香菜根用粉碎机打磨成粉,过40目筛,将过筛后的粉末装于自封袋中,并保存在干燥器内待用。
准确称取香菜根粉末1.0 g,置于具塞三角瓶中,分别以提取时间、提取温度、液料比、乙醇体积分数为单因素,研究不同单因素对香菜根总黄酮提取量的影响[17]。
1.2.3.1 确定最佳提取时间
准确称取香菜根粉末1.0 g,固定乙醇体积分数70%、液料比20∶1(mL/g)、提取温度70 ℃的条件不变,设置提取时间为3,3.5,4,4.5,5 h进行提取。
1.2.3.2 确定最佳提取温度
准确称取香菜根粉末1.0 g,固定乙醇体积分数70%、液料比20∶1(mL/g)、提取时间4.5 h的条件不变,设置提取温度为60,65,70,75,80 ℃进行提取。
1.2.3.3 确定最佳液料比
准确称取香菜根粉末1.0 g,固定乙醇体积分数70%、提取时间4.5 h、提取温度70 ℃的条件不变,设置液料比为20∶1、25∶1、30∶1、35∶1、40∶1(mL/g)进行提取。
1.2.3.4 确定最佳乙醇体积分数
准确称取香菜根粉末1.0 g,固定提取时间4.5 h、提取温度70 ℃,液料比30∶1(mL/g)的条件不变,设置乙醇体积分数为60%、65%、70%、75%、80%进行提取。
1.2.4 响应面试验设计
用Design-Expert V8.0.6 软件处理数据,依据单因素试验结果,利用Box-Behnken 中心组合试验设计原理[18],选取液料比(A)、乙醇体积分数(B)、提取温度(C)为试验因素,将总黄酮提取量作为响应值,设计试验,响应面因素水平见表1。
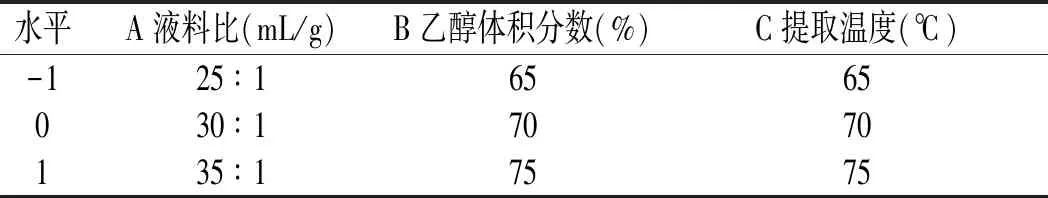
表1 响应面分析因素与水平Table 1 Factors and levels of response surface analysis
2 结果与分析
2.1 单因素试验
2.1.1 提取时间对香菜根总黄酮提取量的影响
准确称取香菜根粉末1.0 g,固定乙醇体积分数70%、液料比20∶1(mL/g)、提取温度70 ℃的条件不变,设置提取时间3,3.5,4,4.5,5 h进行提取,试验结果见图2。
由图2可知,在3~4.5 h之间,香菜根总黄酮的提取量与时间呈正相关;当提取时间达到4.5 h,后总黄酮的提取量呈下降趋势,这可能是总黄酮随着时间的增加已经基本被提取出来,4.5 h后随着时间的增加被提取出的总黄酮会被分解一小部分,从而导致曲线呈下降趋势。
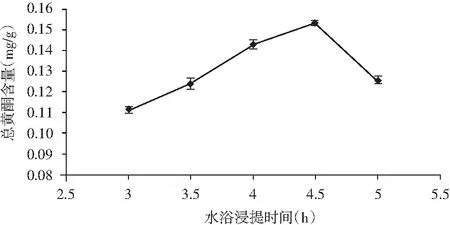
图2 提取时间对总黄酮提取量的影响Fig.2 The effect of extraction time on extraction amount of total flavonoids
2.1.2 提取温度对香菜根总黄酮提取量的影响
准确称取香菜根粉末1.0 g,固定乙醇体积分数70%、液料比20∶1(mL/g)、提取时间4.5 h的条件不变,设置提取温度为60,65,70,75,80 ℃进行提取,试验结果见图3。
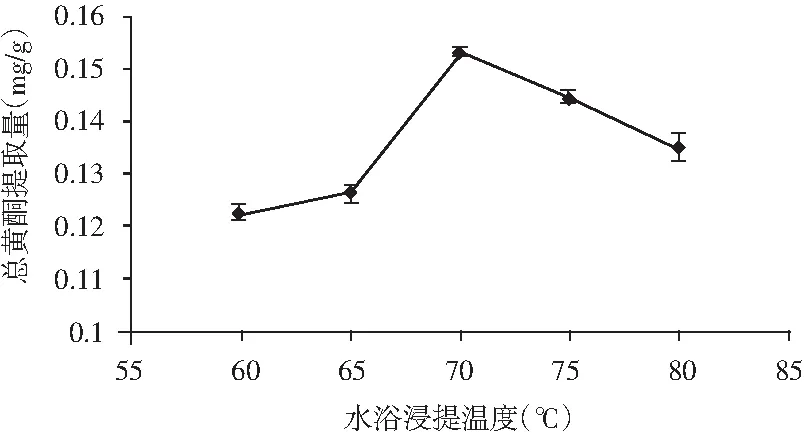
图3 提取温度对总黄酮提取量的影响Fig.3 The effect of extraction temperature on extraction amount of total flavonoids
由图3可知,香菜根总黄酮的提取量在70 ℃时达到最大。当温度低于70 ℃时,有可能由于乙醇分子与香菜根颗粒接触不够充分,导致总黄酮的提取量较少;当温度大于70 ℃时,因为温度的提高而导致乙醇挥发,使得实际的乙醇体积分数低于70%,也有可能是因为香菜根中部分黄酮物质受热易分解,所以没有70 ℃下提取量大,最终得出70 ℃是最优的提取温度。
2.1.3 液料比对香菜根总黄酮提取量的影响
准确称取香菜根粉末1.0 g,固定乙醇体积分数70%、提取时间4.5 h、提取温度70 ℃的条件不变,设置液料比为20∶1、25∶1、30∶1、35∶1、40∶1(mL/g)进行提取,试验结果见图4。
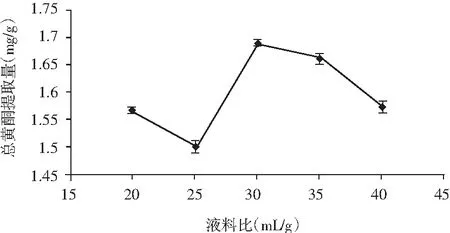
图4 液料比对总黄酮提取量的影响Fig.4 The effect of liquid-solid ratio on extraction amount of total flavonoids
由图4可知,从整体上看,液料比在20∶1~30∶1之间,总黄酮的提取量随着液料比的增加而逐渐增加;当液料比在30∶1~40∶1之间,总黄酮的提取量随着液料比的增加而减少,因此可以得到30∶1是香菜根提取总黄酮的最优液料比。
2.1.4 乙醇体积分数对香菜根总黄酮提取量的影响
准确称取香菜根粉末1.0 g,固定提取时间4.5 h、提取温度70 ℃,液料比30∶1(mL/g)的条件不变,设置乙醇体积分数60%、65%、70%、75%、80%进行提取,试验结果见图5。
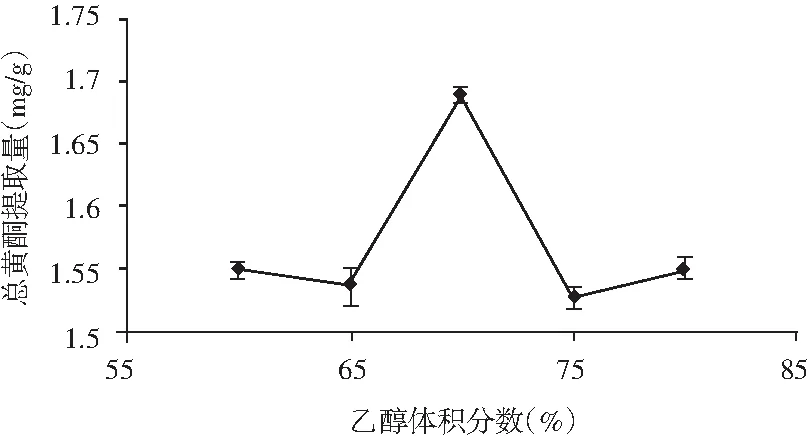
图5 乙醇体积分数对总黄酮提取量的影响Fig.5 The effect of ethanol volume fraction on extraction amount of total flavonoids
由图5可知,在乙醇体积分数为60%时,香菜根的总黄酮提取量较少。当乙醇体积分数在65%~70%之间时,乙醇体积分数与香菜根的总黄酮提取量呈正相关;当乙醇体积分数为70%时,香菜根的总黄酮提取量最大,继续增加乙醇体积分数,香菜根的总黄酮提取量有所降低;当乙醇体积分数高达80%时,香菜根的总黄酮提取量最低,这可能是因为相似相溶的原理,极性越接近,溶解度越大,在乙醇体积分数为70%时,溶剂的极性和黄酮的极性最为接近,因此70%为最优的乙醇体积分数。
2.2 响应面优化提取工艺结果
2.2.1 响应面试验设计和试验结果
利用Box-Behnken 组合设计原理,采用Design-Expert V8.0.6软件,根据单因素试验结果选取液料比(A)、乙醇体积分数(B)、提取时间(C)作为自变量,将香菜根中所提取的总黄酮量作为响应值。试验设计的方案和数据处理的结果见表2。

表2 响应面试验设计和试验结果Table 2 Design and results of response surface experiment

续 表
2.2.2 响应面分析
对试验方案设计和试验结果用Desgin-ExpertV8.0.6软件进行统计分析,可得到二次回归方程模型:
Y=+0.17+1.367×10-3A+5.468×10-3B+6.288×10-3C+5.468×10-4AB-1.093×10-3AC-1.641×10-3BC-4.703×10-3A2-0.021B2-0.022C2。

表3 回归线性分析Table 3 The linear regression analysis
注:“*”为显著(P<0.05);“**”为极显著(P<0.01)。
由表3可知:此模型显著。通过模型的回归方差分析可以得到,一次项A、B、C对总黄酮提取量的影响不显著,二次项B2和C2对试验结果影响极显著(P<0.01),A2对试验结果影响不显著,AB、AC、BC的交互效应不显著。由F值和P值可知,液料比、乙醇体积分数和提取时间会影响香菜根中总黄酮的提取量,其影响力大小为:液料比<乙醇体积分数<提取时间。液料比、乙醇体积分数、提取时间对香菜根总黄酮提取量影响的响应曲面图见图6~图8。

图6 液料比与乙醇体积分数对总黄酮提取量的影响Fig.6 Effect of liquid-solid ratio and volume concentration of ethanol on extraction amount of total flavonoids
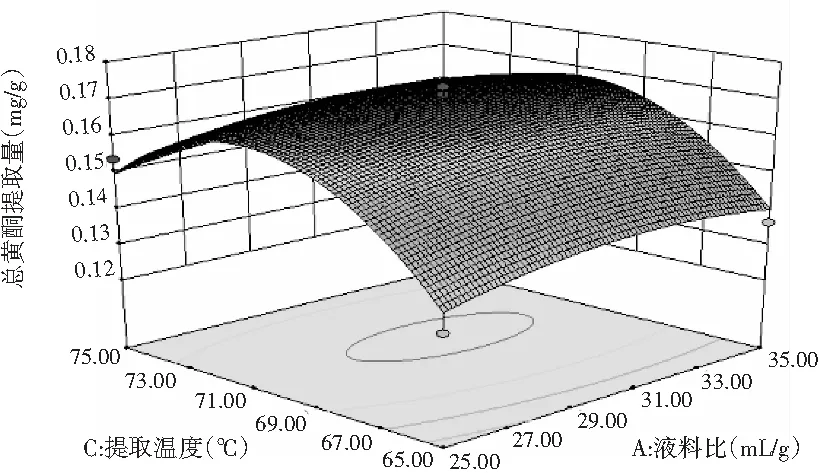
图7 液料比与提取温度对总黄酮提取量的影响Fig.7 Effect of liquid-solid ratio and extraction temperature on extraction amount of total flavonoids
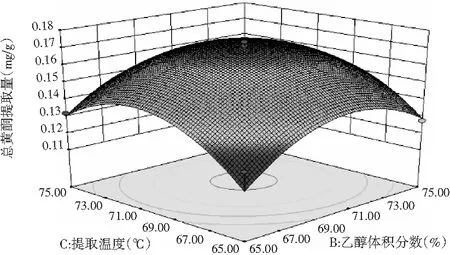
图8 乙醇体积分数与提取温度对总黄酮提取量的影响Fig.8 Effect of ethanol volume fraction and extraction temperature on extraction amount of total flavonoids
通过Design-Expert V8.0.6软件,输入试验结果可得到图6~图8的响应曲面图,非常直观地表现了两两因素间的交互作用。响应曲面图中图形坡度越小代表相互作用越小,反之则越大。由图6~图8可知,两两因素间均有一定的交互作用,但交互作用相对较弱,其中BC的交互作用比较明显,但并没有达到显著。
2.2.3 最佳工艺条件
通过响应面分析得到乙醇提取香菜根中总黄酮的最佳工艺条件:液料比为30.68∶1 (mL/g),最佳乙醇体积分数为70.65%,最佳提取温度为70.67 ℃,在的条件下,香菜根中理想的总黄酮提取量为0.1717 mg/g,由于实验室的可操作性,最终将液料比设为31∶1 (mL/g),乙醇体积分数设为71%,提取温度设为71 ℃。在此条件下再次试验,得到总黄酮的提取量为0.1691 mg/g,说明该模型的预测值与实际值之间有较好的重合性,可以用此方法预测香菜根中总黄酮的提取量。
3 结论
在单因素试验的基础上,使用Design-ExpertV8.0.6软件采用三因素三水平的响应面分析方法,对香菜根中总黄酮的提取工艺进行优化。通过试验验证,可得到最佳的工艺条件为液料比31∶1 (mL/g),乙醇体积分数71%,提取温度71 ℃,在此条件下,总黄酮的提取量约为0.1691 mg/g,该实验方法有一定的可靠性。
