基于气相色谱-质谱联用技术的不同产地藜麦中脂肪酸及小分子物质组成分析
2019-05-21卢恒谦王顺合赵建新
郭 敏,卢恒谦,王顺合,陈 卫,赵建新*
(江南大学食品学院,江苏 无锡 214122)
藜麦(Chenopodium quinoa Willd.)属藜科藜属植物,富含碳水化合物、蛋白质、脂肪及粗纤维等多种营养成分及活性物质[1-3],最早在我国西藏等地区引种实验,试种成功后逐步推广至山西、甘肃、青海、四川等高海拔山区,目前在陕西、浙江、河北、北京、内蒙古等地区都有种植[4-7]。
近年来,藜麦的营养成分分析已成为研究人员关注的焦点。国内外学者通过不同的分析方法对藜麦的营养成分进行研究,如Multari等[8]研究发现干燥温度与藜麦总酚回收率之间的相关性;Hu Yichen等[9]研究提取技术对藜麦多糖含量的影响;Reguera等[10]研究品种及栽培产地对藜麦营养成分的影响。然而脂质作为维持人体健康所必需的营养物质之一,在表征藜麦的营养价值方面具有重要作用。但是国内外学者对不同产地藜麦中脂肪酸的研究报道相对较少。其次,随着藜麦种植地在全球范围内的不断扩大,消费者对藜麦来源的关注程度与日俱增,藜麦的产地溯源问题也越来越引起人们的重视。目前利用代谢组学的方法,以小分子物质为研究对象,通过气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用检测和数据处理,进行信息整合、生物标记物的鉴定从而识别食品的来源,该方法也成为食品产地溯源的技术方法之一,萨日娜等[11]基于GC-MS代谢组学方法探讨甘肃不同产地当归中挥发性成分与药材生长环境的关系。冯雪[12]采用GC-MS技术建立稻米的代谢组学分析方法,并将其应用于产地溯源。然而利用该方法用于藜麦产地溯源鲜见报道。
本研究着眼于藜麦中的脂肪酸及小分子代谢物,采用GC-MS对不同产地藜麦进行分析,并结合无监督模式的主成分分析(principal component analysis,PCA)和有监督模式的正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)对产地与小分子代谢物之间的相关性进行分析,寻找不同产地间的差异化合物。旨在为进一步研究国内引种种植藜麦的营养价值及藜麦产地溯源技术提供数据支撑。
1 材料与方法
1.1 材料与试剂
藜麦样品:9 批不同产地不同品种的藜麦样品由青海高远锦禾生态农牧科技有限公司提供,样品于40 ℃烘干24 h后,密封置于4 ℃冰箱中备用。样品来源信息见表1。
正己烷、甲醇(均为色谱纯) 德国默克公司;氢氧化钠(分析纯) 国药集团化学试剂有限公司;N-甲基-N-三甲基硅三氟乙酰胺(N-methyl-N-(trimethylsilyl)trifluoroacetamide,MSTFA)、14%三氟化硼-甲醇溶液美国西格玛公司;甲基叔丁基醚(methyl tert-butyl ether,MTBE)(色谱纯) 美国天地公司;无水吡啶、盐酸甲氧胺 北京百灵威科技有限公司。

表 1 样品来源信息Table 1 Information about quinoa samples
1.2 仪器与设备
QP2010 Ultra GC-MS联用仪 岛津企业管理(中国)有限公司;Rtx-Wax(0.25 mm×30 m,0.25 μm)、Rtx-5 MS毛细管色谱柱(0.25 mm×30 m,0.25 μm)美国瑞思泰康公司;Trace1310-TSQ 8000 Evo GC-MS联用仪、LEGEND MICRO 17离心机 美国赛默飞公司;QGC-24T氮吹仪 上海泉岛公司;Milli-Q8超纯水发生器 美国密理博公司。
1.3 方法
1.3.1 小分子物质提取
藜麦研磨成粉,准确称取10 mg藜麦粉转移到提脂瓶中,采用MTBE法[13-14],样品加入高纯水40 μL,涡旋振荡30 s后加入甲醇300 μL,涡旋振荡30 s后再加入MTBE 1 000 μL,再涡旋振荡30 s后置于室温下,于振荡器60 r/min孵育1 h。孵育后加入高纯水250 μL,涡旋振荡30 s后在室温下静置10 min,3 600 r/min离心10 min,将上层溶剂加入到新的提脂瓶中,然后按照甲醇∶MTBE∶H2O=1∶3∶2.5体积比混合,静置后取混合液的上层溶剂1 000 μL再萃取1 次,合并2 次萃取液,用氮气吹干,即得到脂质粗提物。取下层溶液用氮气吹干,即得到样品中的小分子物质。
1.3.2 脂质甲酯化
向脂质粗提取物中加入0.5 mol/L NaOH-甲醇溶液1 mL,混匀后充氮气于95 ℃加热5 min,冷却至室温后加入14%三氟化硼-甲醇溶液1 mL,充氮气于95 ℃加热5 min,冷却至室温后加入饱和NaCl溶液1 mL,混匀后再加入正己烷1 mL,混匀,2 000 r/min离心10 min,取上层溶液,如此重复提取1 次,混合2 次提取的上层有机相,氮气吹干,用200 μL正己烷复溶,装入1.5 mL进样小瓶,用于GC-MS分析。
1.3.3 衍生化
向干燥后的小分子物质中加入10%甲氧胺盐酸盐-吡啶100 μL,37 ℃金属浴90 min;然后加入MSTFA 40 μL 37 ℃金属浴60 min;反应完毕后12 000×g离心20 min,吸取上清液100 μL至GC瓶中用于GC-MS分析。
1.3.4 脂肪酸分析
使用QP2010 Ultra GC-MS联用仪,GC条件:色谱柱:Rtx-Wax石英毛细管色谱柱(0.25 mm×30 m,0.25 μm);升温程序:150 ℃保持2 min,以10 ℃/min升至190 ℃,保持5 min,以5 ℃/min升至220 ℃,保持16 min;载气(He)流速1.5 mL/min,进样量1 µL;分流比10∶1。MS条件:电子电离源;电子能量70 eV;接口温度250 ℃;离子源温度220 ℃;扫描方式为全扫描;质量扫描范围m/z 50~550。
1.3.5 极性小分子物质分析
使用Trace1310-TSQ 8000 Evo GC-MS联用仪,GC条件:色谱柱:Rtx-5MS石英毛细管色谱柱(0.25 mm×30 m,0.25 μm);升温程序:70 ℃保持1 min,以5 ℃/min升至150 ℃,以10 ℃/min升至200 ℃,以70 ℃/min升至320 ℃,保持8 min;载气(He)流速1.5 mL/min,压力2.4 kPa,进样量1 µL;分流比10∶1。MS条件:电子电离源;电子能量70 eV;接口温度280 ℃;离子源温度300 ℃;扫描方式为全扫描;质量扫描范围m/z 33~600。1.4 数据处理
应用SPSS 17.0统计软件进行差异显著性分析;应用基于R代码的XCMS软件分析进行谱峰基线校正、峰识别和匹配、消除噪音等预处理;应用SIMCA 14.1分析软件进行PCA和OPLS-DA,用NIST 11标准谱库进行差异化合物的检索与鉴定。
2 结果与分析
2.1 不同产地藜麦中脂肪酸的测定结果
采用GC-MS分析不同产地藜麦样品中的脂质提取物,通过脂肪酸甲酯特征离子的提取,经NIST标准谱库对比、标样验证后,确定藜麦脂肪酸组成及含量,结果见表2和图1。

表 2 不同产地藜麦脂质提取物的脂肪酸组成及含量Table 2 Fatty acid composition and contents in quinoa samples from different regions
由表2可知,不同产地藜麦中的脂肪酸组成相似,但含量有显著差异,其中亚油酸(C18:2)相对含量最高,均在50%左右。张婷婷[15]分析产自云南香格里拉藜麦的主要成分,发现香格里拉藜麦中含有大量的不饱和脂肪酸,主要是亚油酸,这一结果与本研究一致。
不同产地的藜麦脂肪酸含量存在显著差异(P<0.05)。表2结果表明,不同产地藜麦中脂肪酸含量显著性差异最高的是油酸(C18:1)。样品S01的亚油酸(C18:2)相对含量最高,样品S07的油酸(C18:1)相对含量最高,样品S08的α-亚麻酸(C18:3)相对含量最高。由图1可知,藜麦中脂肪酸组成主要是不饱和脂肪酸,占总脂肪酸80%以上,碳链为14~22,以常规的偶数碳脂肪酸为主。其中样品S09的不饱和脂肪酸相对含量最高,占总脂肪酸83.16%,同王黎明等[16]在分析藜麦营养价值时发现藜麦中的主要脂肪酸为不饱和脂肪酸的结果一致,且主要不饱和脂肪酸比例结果也与本研究相似;此外,由图1可知,产于青海S09和S05藜麦样品的不饱和脂肪酸含量要高于其他产地的藜麦。周海涛等[17]在研究藜麦在张家口地区的试种表现时发现,适宜的生态条件有利于藜麦产量及营养成分的提升,所以在本研究中产于青海的藜麦样品S09和S05不饱和脂肪酸含量高于其他样品,可能是因为青海产地整体的海拔、气候、土壤等自然条件比较适合S09、S05藜麦品种的生长。

2.2 不同产地藜麦中小分子物质的测定结果
对表1中9 种藜麦样品进行GC-MS分析,采集到的数据经过基于R代码的XCMS软件进行谱峰基线校正、峰识别和匹配、消除噪音等预处理后得到2 753 个质谱碎片。然后采用SIMCA-P14.1软件对质谱碎片进行PCA和OPLS-DA[18-20],从而得到具有差异性的52 个质谱碎片,最后通过NIST 11标准谱库进行检索,经鉴定得出4 种差异化合物。
2.2.1 PCA
通过PCA得分图上散点位置的分布可以比较直观地展现样品或组别之间的差异[21-23]。对不同产地藜麦样品的GC-MS数据进行无监督PCA,从整体上观察各组分离趋势及组间空间上的分布情况,结果见图2。

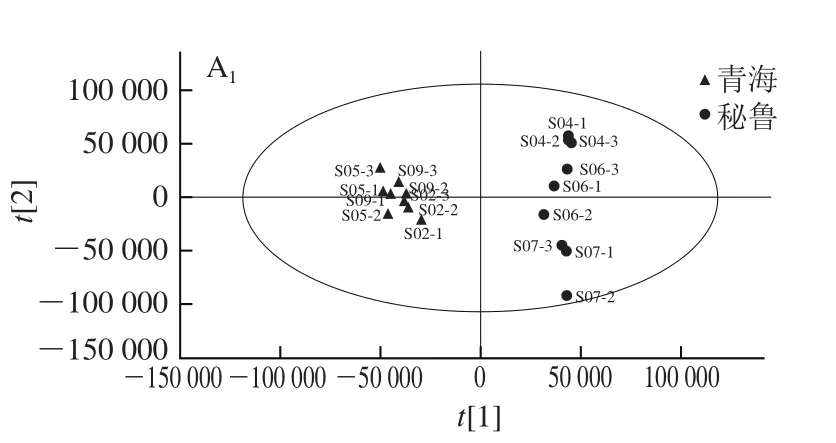
图 2 不同产地藜麦样品的PCA得分图Fig. 2 PCA score plots for quinoa samples from different regions
由图2可知,9 批藜麦样品分散在A、B、C 3 个区域,其中A区域包括的样品S04、S06和S07均来自于秘鲁,B区域包括的样品S01、S03和S08均来自于云南,C区域包括的样品S02、S05和S09均来自于青海,说明同一产地藜麦样品中小分子物质含量具有相似性;B、C区域的样本聚合度较好,说明来自云南和秘鲁的藜麦种间差异较小;A区域S07与S04和S06的位置相对分散,说明S07号样品与S04、S06号样品有差异。
2.2.2 OPLS-DA
为进一步验证各样本之间的分离情况,从中识别有效的差异化合物,采用有监督模式OPLS-DA,对不同产地的藜麦样品按照产地进行分组,对藜麦中小分子物质与产地之间的相关性进行分析[24-25]。将9 批样品分成3 组(青海、云南、秘鲁),每两组数据进行OPLS-DA,其得分图及S-plots见图3。
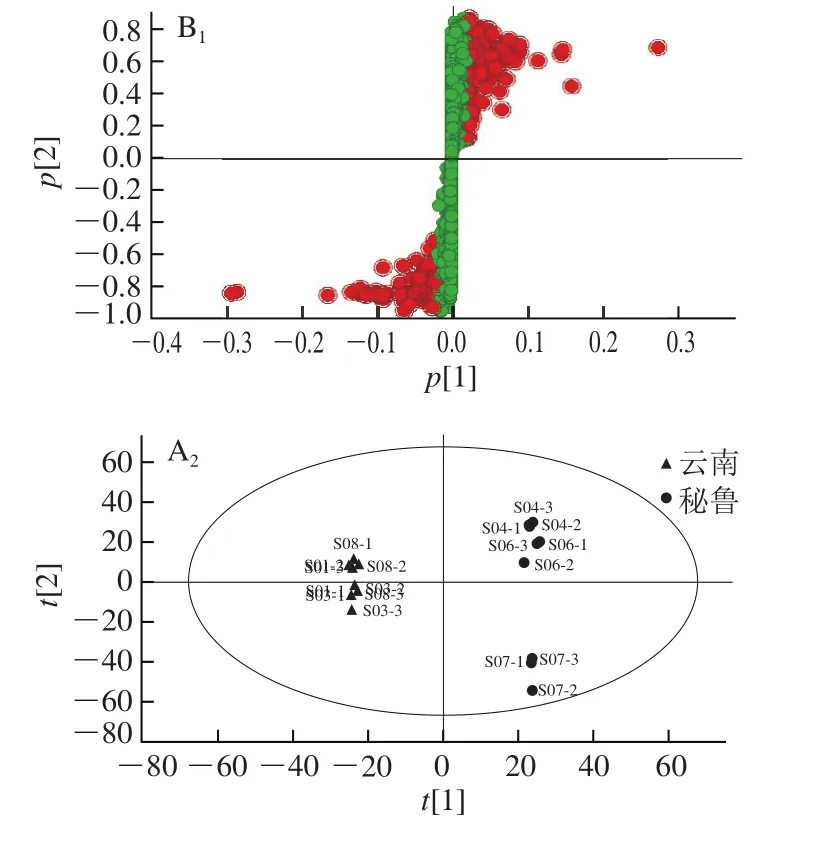
从图3A可以看出,藜麦样品根据产地分离情况良好,说明不同产地的藜麦样品中的小分子物质组成存在明显的差异。由图3B可知,S-plots图中距离中心点越远(标红的点)说明此因子对产地分类的贡献系数越大,是潜在的差异化合物。
2.2.3 差异性化合物的筛选及鉴定分析
通过OPLS-DA过滤不相关的正交信号,获得更加可靠的差异物信息。选取各组间OPLS-DA模型第1主成分的变量投影重要性(variable important for the projection,VIP)值(VIP>2)进行3 组之间共同差异物的筛选(图4),并结合One-Way ANOVA方差分析(P<0.05)寻找差异性化合物,结果见表3。

图 4 差异化合物筛选结果Fig. 4 Screening for differential compounds
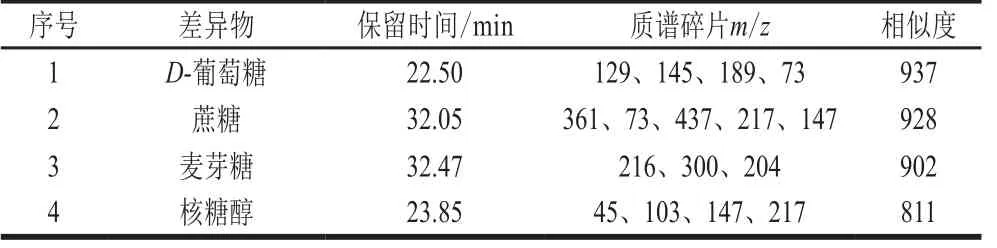
表 3 差异化合物鉴定Table 3 Identification of differential compounds
由图4和表3可知,筛选出的52 个质谱碎片,经与NIST 11数据库检索对比,鉴定出4 种差异性化合物,分别为D-葡萄糖、蔗糖、麦芽糖和核糖醇。可能是因为糖类作为藜麦的内源性代谢物,当其生长的环境在发生变化时,糖类含量也随之变化,最终导致不同产地藜麦营养成分产生显著性差异。
3 结论与讨论
本研究采用GC-MS联用技术同时提取测定不同产地藜麦中脂肪酸及小分子物质组成。结果表明,不同产地藜麦中的脂肪酸组成相似,且不同产地脂肪酸含量存在显著性差异;其中亚油酸相对含量最高,均在50%左右。上述结果揭示不同产地藜麦脂肪酸组成存在相似性和差异性。结合PCA和POLS-DA法,对不同产地藜麦小分子物质进行分析,结果显示小分子物质与产地具有相关性,D-葡萄糖、蔗糖、麦芽糖和核糖醇是藜麦样品中的差异性化合物。
本研究通过对不同产地藜麦中脂肪酸含量测定及小分子物质差异性比较,以期对进一步研究国内引种种植藜麦的营养价值及藜麦产地溯源技术提供物质基础。本研究表明不同产地脂肪酸含量存在显著差异;其中亚油酸含量最高,均在50%左右;这与张婷婷[15]对藜麦的报道相一致。糖类是不同产地藜麦小分子物质的差异性化合物,冯雪[12]研究也发现蔗糖、麦芽糖、海藻糖为稻米的差异性标志物,这与本研究结果相似。但是本研究仅对不同产地藜麦中营养成分及产地溯源方法进行探索,今后可以通过扩大采样范围及采样品种的方法,获取更多的样本信息进行分析,从而通过建立产地判别模型,筛选出更有效的产地溯源标志物,为进一步研究国内引种种植的藜麦的营养价值及产地归属提供物质基础[26-28]。
