花青素与大豆分离蛋白的不同共价交联法对蛋白结构的影响
2019-05-21刘英杰隋晓楠赵思明刘贵辰孙红波齐宝坤江连洲
刘英杰,隋晓楠,黄 国,赵思明,徐 悦,刘贵辰,孙红波,齐宝坤,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
大豆分离蛋白(soy protein isolate,SPI)是一种全价植物蛋白,富含人体必需氨基酸。其营养丰富,不含胆固醇,是植物蛋白中为数不多的可替代动物蛋白的品种之一,目前被人类广泛应用于不同食品加工领域中[1-2]。据报道,SPI可以与其他某些食物成分发生相互作用,多酚就是其中一种[3]。多酚是一类广泛存在于植物体内且具有多元酚结构的次生代谢物,根据其碳骨架的特征,可分为酚酸类、黄酮类、少见的芪类和木脂素类。而花青素就属于一种常见的水溶性黄酮类化合物,普遍存在于水果和蔬菜中[4-5]。其具有抗氧化、抗炎等生物学活性;并对肥胖症、糖尿病、胸膜炎等疾病患者的治疗起重要作用[6-7]。目前科学研究表明,花青素作为一种小分子物质,其结构具有独特的理化性质,在食品加工及生产过程中,能与多种化合物发生交互作用,其中蛋白质是最主要的化合物[8]。
研究表明蛋白质与多酚相互作用主要通过两种方式:可逆的非共价作用和不可逆的共价交联[5]。其中蛋白与多酚的非共价作用通过形成氢键、范德华力、π键、疏水作用和离子相互作用实现[9-11]。而共价交联则主要分为生物共价交联法和化学共价交联法,其原理为酚类物质在有多酚氧化酶或碱性(pH 9)条件下,可以被酶或氧气分子氧化从而形成醌类物质,其醌类物质可以与蛋白质多肽链上的氨基酸和巯基形成C—N键和C—S键,从而完成两者的共价交联[12-13]。
本课题组研究发现,SPI与花青素可以形成非共价键及共价键,并就两者在碱性条件下发生的共价交联作用对蛋白结构及界面蛋白性质的影响进行剖析[14-15]。Chung等[16]研究发现在多酚氧化酶(漆酶)存在条件下,儿茶素可以被氧化形成醌类物质,从而与明胶发生共价交联。Ali等[12]分别利用化学碱法和生物酶法对β-乳球蛋白与绿原酸进行共价交联处理,结果表明两种共价交联方式都使β-乳球蛋白的结构发生改变,且化学碱法对β-乳球蛋白产生的影响大于生物酶法。但是目前在探究蛋白质与多酚相互作用的文献中,两者之间共价交联的研究相对较少[13]且多数局限于单一共价交联方法,关于生物共价交联法和化学共价交联法在同一食品基质中对蛋白结构产生的影响差异解析不够明确,尤其是花青素与SPI。
由此,为更加明确地了解SPI与花青素共价交联对蛋白结构的影响,本实验选用两种常见的共价交联机制——生物酶法和化学碱法对不同质量浓度花青素与SPI进行共价处理,并就两种共价交联方式对SPI结构产生的影响进行比较,同时探究添加不同质量浓度花青素后对SPI结构的改变。旨在为SPI与花青素共价交联作用的研究提供重要指导意义,这些研究的积极成果将使人们更加直观及深入地了解生物酶法与化学碱法对蛋白结构产生的影响,为SPI在食品中的合理应用提供理论支持。
1 材料与方法
1.1 材料与试剂
大豆 市售;SPI由实验室自制;花青素黑米提取物陕西天之润生物科技有限公司;乙腈、甲酸(均为色谱纯) 美国Sigma-Aldrich公司;漆酶 河北仟盛生物科技有限公司;盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠 北京新光化工试剂厂;正己烷、乙酸乙酯、甲醇 天津北科化学品有限责任公司;其他化学试剂均为分析纯。
1.2 仪器与设备
GL-25MS超速高速冷冻离心机 上海盛析仪器设备有限公司;WAT023635高效液相色谱仪、SunFire C18反向色谱柱(250 mm×4.6 mm)美国Waters公司;傅里叶红外光谱仪 美国尼高丽公司;Tecan Infinite 200 Pro酶标仪 瑞士帝肯公司。
1.3 方法
1.3.1 SPI的制备
参考Petruccelli等[17]的制备方法。大豆去皮粉碎后过60 目筛网,用豆粉-正己烷(1∶3(g/mL))对筛选后的豆粉进行3 次脱脂。得到的脱脂豆粉与去离子水(1∶20(g/mL))混合后,用NaOH溶液(2 mol/L)将混合溶液的pH值调节至8,在室温搅拌2 h,将其悬浮液在4 ℃、10 000×g离心20 min,取其上清液用盐酸溶液(2 mol/L)调节pH值至4.5后静置1 h,在4 ℃、6 000×g离心20 min,得到蛋白沉淀物,将蛋白沉淀物用去离子水水洗3次后溶解,用NaOH溶液(2 mol/L)调节蛋白溶液pH 7,将此蛋白溶液冻干并研磨,即可得到SPI。
1.3.2 花青素的提纯与定量分析
参考Rodriguez-Saona等[18]的方法对黑米提取物进行提纯,用去离子水溶解黑米提取物后,将其抽滤。将滤液通过固相萃取柱以吸附花青素,后用2 倍柱体积的酸化水洗脱样品中不溶性成分,用2 倍柱体积的乙酸乙酯溶液洗脱样品中除花青素外的多酚类杂质,最后用酸化的甲醇溶液洗脱吸附于柱上的花青素。将此溶液旋转蒸发以去除甲醇,即可得到花青素提纯物。采用高效液相色谱法对纯化后的花青素进行定量分析[19],取花青素提纯物过0.45 µm滤膜后用C18色谱柱联合高效液相色谱设备进行分析,流量1 mL/min,温度25 ℃,进样体积50 µL,检测器波长520 nm,梯度洗脱条件根据Sui Xiaonan[19]的方法,同时为方便计算,本实验统一使用矢车菊素-3-葡萄糖苷(黑米提取物中花青素主要成分)质量浓度为花青素质量浓度做近似处理。
1.3.3 SPI与花青素共价聚合物的制备
参考Prigent等[20]的方法并稍作修改。用0.01 mol/L磷酸盐缓冲溶液(phosphate buffered saline,PBS)配制质量浓度为10 g/L的SPI溶液,分别加入不同质量浓度(0.17、0.25、0.5 g/L)的花青素后,加入漆酶溶液(10 U)避光搅拌24 h。参照Rohn等[21]的方法,用0.01 mol/L PBS配制质量浓度为10 g/L的SPI溶液,分别加入不同质量浓度(0.17、0.25、0.5 g/L)的花青素后,调节溶液pH 9.0后避光搅拌24 h。将6 组反应后的样品透析48 h(截留分子质量8~10 kDa),每隔8 h换水一次以确保未反应的游离多酚完全透析出去。将透析液冻干,即可得到共价交联聚合样品。
1.3.4 共价结合率的测定
花青素与SPI的共价结合率及共价交联花青素含量的测定参考本课题组之前的研究[15]方法并稍作修改,将所有未经透析的SPI-花青素共价聚合物样品放入分子截留量为8~10 kDa的透析袋中,并将透析袋放入蒸馏水中在4 ℃透析24 h,后取其透析液用高效液相色谱测定透析液中游离花青素的含量,测定方法与上述花青素定量方法一致。花青素与SPI的共价结合率及共价交联花青素含量(以SPI计)的计算公式如下:

1.3.5 游离巯基含量的测定
参考Beveridge等[22]的方法并稍作修改。将75 mg样品溶解于10 mL含有1 mmol/L EDTA和1% SDS的PBS中(0.1 mol/L,pH 8.0),取3 mL样品溶液加入3 mL上述PBS,再加入0.1 mL Ellman's试剂,混匀后于25 ℃条件下水浴1 h,将其混合物在10 000×g离心30 min,取上清液在412 nm波长处测定吸光度。其中以不加Ellman's试剂的混合液为空白。用公式(3)计算巯基的含量:
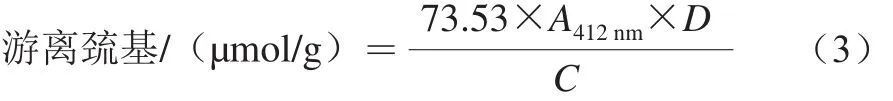
式中:A412nm为在412 nm波长处的吸光度;C为样品质量浓度/(mg/mL);D为稀释倍数;73.53=106/(1.36×104),其中 1.36×104为摩尔吸光系数。
1.3.6 傅里叶变换红外光谱分析
参考刘勤勤等[23]的方法,将样品粉末与溴化钾粉末按1∶100的比例混合后压片,在分辨率为4 cm-1条件下扫描64 次,600~4 000 cm-1波数谱段范围内记录红外光谱。
1.3.7 紫外-可见光谱分析
参考刘勤勤等[23]的方法稍作修改。用PBS(0.01 mol/L,pH 7)溶解样品使蛋白质量浓度为0.5 mg/mL,取200 μL样品溶液置于96 孔板中,用紫外-可见分光光度计扫描260~350 nm波长范围内的吸收光谱。
1.3.8 荧光光谱分析
根据Roy等[10]的方法稍加修改。用PBS(0.01 mol/L,pH 7)溶解样品使蛋白质量浓度0.2 mg/mL,取200 μL样品溶液置于96 孔板中用酶标仪进行荧光测定。其中,起始激发波长为280 nm,扫描波长为310~500 nm,发射光带宽20 nm,激发光带宽10 nm。
1.4 数据统计及分析
实验每组数据重复3次,利用Origin 8.0软件处理数据作图。利用SPSS V17.0软件进行ANOVA差异显著性分析及相关性分析,P<0.05,差异显著。
2 结果与分析
2.1 共价结合率分析

图 1 生物酶法和化学碱法条件下花青素与SPI的共价相互作用分析图Fig. 1 Analysis of covalent interaction betweenanthocyanin and SPI under enzymatic and alkaline conditions
应用反相高效液相色谱法测定花青素与SPI共价聚合物中游离花青素的含量,进而对两种共价交联方式下的花青素-SPI共价聚合物中共价交联花青素含量及两者的共价结合率进行评估。如图1所示,在漆酶氧化条件下,花青素与SPI的共价结合率在97.0%~98.0%之间,比碱性条件下(pH 9)共价交联的花青素与SPI的共价结合率(93.0%~95.5%)高(P<0.05)。但总体来看,无论是在生物酶法氧化还是化学碱法氧化条件下,多酚与蛋白的共价结合率都相对较高(93.0%~98.0%),这主要是因为酚类化合物在多酚氧化酶或碱性条件下,容易被氧气分子氧化从而形成相应的醌类物质,所得醌类可与亲核试剂(蛋白质上的侧链基团)发生亲核反应以形成比较强而且稳定的共价键[24-25],进而使花青素醌牢牢绑定SPI。
由图1可知,在同一共价交联方式下,共价交联花青素含量随花青素质量浓度升高而升高,这主要是因为同一共价处理条件下,不同质量浓度花青素与SPI的共价结合率几乎相同(生物酶法:97.0%~98.0%;化学碱法:93.0%~95.5%),所以共价聚合物中花青素的质量浓度越高,共价交联花青素含量越高。而且,图1表明LC1共价交联花青素含量高于AC1 3.87%,LC2高于AC2 2.58%,LC3高于AC3 4.43%。上述结果表明在漆酶氧化条件下,花青素与SPI可以发生更强的共价相互作用。由此,推测其原因是在氧气存在的情况下,多酚氧化酶(漆酶)可以更完全地氧化花青素形成相应的花青素醌。
2.2 游离巯基含量分析

图 2 生物酶法和化学碱法条件下花青素与SPI的共价相互作用对蛋白游离巯基含量的影响
蛋白质中的巯基基团具有很高的反应活性,对蛋白质的结构和功能特性有重要影响[26]。如图2所示,使用生物酶法与化学碱法共价交联花青素与SPI后,明显降低了SPI的游离巯基含量(P<0.05)。同时,随着花青素质量浓度升高,所有样品的游离巯基基团含量呈现持续降低趋势。尤其是在多酚氧化酶(漆酶)存在的条件下,当花青素质量浓度为0.5 g/L时,相比较于天然SPI,样品的游离巯基含量降低了66.73%,并且其降低程度明显高于同质量浓度花青素在碱性条件下对SPI游离巯基含量的影响(P<0.05)。这是因为在生物酶法氧化(pH 7)和化学碱法氧化(pH 9)条件下,花青素容易被氧化为相应的醌,其醌类物质能够与SPI侧链的游离巯基基团发生亲核反应,从而形成C—S键,进而使SPI的游离巯基基团的含量降低[27],而且在生物酶法条件下,花青素能够更加完全地被氧化成相应的醌,从而与SPI发生更强的共价交联,更大程度地降低了SPI的游离巯基含量。
2.3 傅里叶变换红外光谱分析

图 3 花青素与SPI共价聚合物的傅里叶红外光谱图Fig. 3 FT-IR spectra of for the covalent conjugates of anthocyanin and SPI
傅里叶变换红外光谱法是一种研究蛋白质二级结构构象变化的常用技术[28],其中酰胺I带(1 700~1 600 cm-1)红外吸收峰的变化可以反映蛋白质二级结构的变化。研究文献表明,蛋白质二级结构与各子峰间波数的对应关系为:α-螺旋:1 646~1 664 cm-1;β-折叠:1 615~1 637 cm-1和1 682~1 700 cm-1;β-转角:1 664~1 681 cm-1;无规卷曲:1 637~1 645 cm-1。图3显示了天然SPI以及不同质量浓度花青素-SPI共价聚合物的傅里叶红外光谱图,如图3A和图3B所示,不同质量浓度花青素的添加都降低了SPI酰胺I带的吸光度,并且致使SPI酰胺I带的红外吸收峰发生不同程度的蓝移,这表明不同质量浓度花青素对SPI的共价交联作用不同程度地改变了蛋白质的二级结构[29]。当花青素质量浓度为0.5 g/L时,将生物酶法和化学碱法两种共价交联方式下的花青素-SPI共价聚合物与天然SPI的傅里叶红外光谱图进行比较。如图3C所示,在添加同质量浓度(0.5 g/L)的花青素条件下,不同共价交联方式处理花青素与SPI致使天然SPI酰胺I带的红外吸收峰发生蓝移的程度也不同(生物酶法:1 634.38 cm-1蓝移至1 631.97 cm-1;化学碱法:1 634.38 cm-1蓝移至1 632.93 cm-1),这表明不同共价交联方式可以不同程度地改变蛋白质的二级结构。
同时利用peakfit对蛋白的酰胺I带进行去卷积,二阶求导,采用Gauss面积法拟合曲线并计算得出蛋白质二级结构的种类与含量[29],计算结果见表1。

表 1 花青素-SPI共价聚合物中蛋白的二级结构含量Table 1 Contents of protein secondary structures in the covalent conjugates of anthocyanin and SPI %
如表1所示,与天然SPI相比,所有添加花青素样品的SPI的二级结构含量都发生了改变,其中α-螺旋和β-折叠含量降低,β-转角和无规卷曲含量明显升高(P<0.05),这可能是由于蛋白质的α-螺旋和β-折叠逐渐转换为β-转角和无规卷曲。这与之前的研究[30]结果一致。在添加同质量浓度花青素条件下,生物酶法交联得到的花青素-SPI共价聚合物比化学碱法交联得到的聚合物增加β-转角和无规卷曲含量的趋势更加明显(P<0.05),这表明生物酶法共价交联作用比化学碱法共价交联作用解折叠蛋白质二级结构的能力更强,可以更大程度地使部分蛋白结构展开[15]。
2.4 紫外-可见光谱分析

图 4 生物酶法和化学碱法条件下花青素与SPI共价聚合物的紫外-可见吸收光谱图Fig. 4 UV-Vis absorption spectra of the covalent conjugates of anthocyanin and SPI under enzymatic and alkaline conditions
蛋白质的吸收光谱在290 nm左右处有一个主要的吸收峰,代表蛋白质的芳香族氨基酸π-π*跃迁[31]。如图3所示,花青素的添加使SPI的紫外-可见吸收光谱峰值升高,且在同一种共价交联方式条件下,SPI的吸收光谱峰值随花青素的质量浓度升高而增加。但在同一质量浓度花青素条件下,生物酶法交联的花青素-SPI共价聚合物比化学碱法交联的聚合物峰值高。值得注意的是,花青素的添加不仅改变了SPI吸收光谱的峰值,而且使得SPI的紫外吸收光谱在290 nm波长处的峰位发生了蓝移,尤其在花青素质量浓度为0.5 g/L,生物酶法交联的聚合物峰位蓝移最为明显,由波长290 nm蓝移至287 nm。
研究表明,蛋白质吸收峰峰值的大小主要反映了蛋白质分子与其他小分子的相互作用的强弱,而蛋白质吸收峰峰位的改变主要是由于蛋白质微环境的疏水性发生改变所引起的,并且蛋白质微环境疏水性的改变会引起蛋白质构象的变化[13]。根据图4结果可知,花青素使SPI芳香族氨基酸处的微环境发生了改变,进而诱导SPI多肽链伸展,发生解折叠。同一共价交联方式下,随着花青素质量浓度升高,花青素与SPI的共价相互作用越强;而同一质量浓度花青素条件下,生物酶法交联比化学碱法交联更能促进花青素与SPI的共价相互作用。
2.5 荧光光谱分析
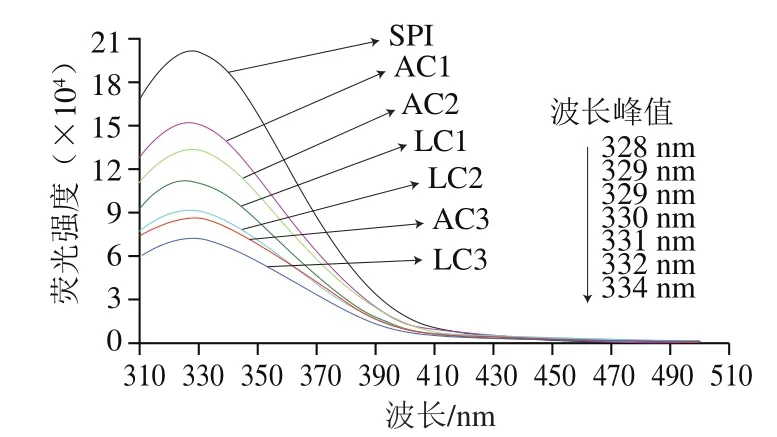
图 5 生物酶法和化学碱法条件下花青素与SPI共价聚合物的荧光光谱图Fig. 5 Emission fluorescence spectra of the covalent conjugates of anthocyanin and SPI under enzymatic and alkaline conditions
蛋白质被认为具有固有的发射荧光,主要是由于它们的色氨酸、酪氨酸和苯丙氨酸残基。激发波长为280 nm时,苯丙氨酸可以忽略,当这些芳香族残基暴露于不同的溶剂条件下时,荧光发射光谱特征会改变[13]。如图5所示,花青素与SPI的共价交联使得SPI的荧光强度发生了猝灭现象,并且花青素质量浓度越高,SPI的荧光强度猝灭现象越明显。同一花青素质量浓度,生物酶法条件下花青素对SPI荧光强度的猝灭程度高于化学碱法条件。这说明生物酶法条件下和化学碱法条件下花青素与SPI发生了相互作用,可能是因为花青素氧化形成的醌类物质上的C与SPI芳香族氨基酸的自由氨基(—NH2)的N发生亲核反应形成C—N键,从而导致蛋白发色基团的减少,使得SPI的荧光强度下降,并且两者在生物酶法条件下的相互作用强于在化学碱法条件下的反应。而且不同质量浓度花青素对SPI的交联使得SPI的λmax发生不同程度的红移,使其从328 nm红移至334 nm,这表明花青素与SPI的共价相互作用诱导蛋白的三级结构发生解折叠,并且使得SPI的主要发色基团色氨酸暴露于较为亲水环境中[32]。
3 结 论
本实验采用生物酶法和化学碱法共价交联花青素与SPI,运用不同的色谱和光谱手段探究两种共价交联方式对SPI结构的影响。研究得出以下结论:1)加入同质量浓度花青素,相较于化学碱法来说,生物酶法共价处理使花青素与SPI的结合率更高。2)花青素对SPI的共价交联降低了蛋白质中的游离巯基含量,且花青素质量浓度越高,样品中游离巯基含量越少;生物酶法交联的花青素-SPI共价聚合物比化学碱法交联的聚合物巯基含量少。3)傅里叶变换红外光谱表明共价交联处理下,随着花青素质量浓度升高,蛋白α-螺旋和β-折叠含量逐渐降低,β-转角和无规卷曲含量逐渐升高,花青素进而诱导蛋白质解折叠,而生物酶法处理的样品中蛋白质二级结构含量的改变比化学碱法更明显。4)紫外-可见吸收光谱和荧光光谱表明花青素对SPI的共价交联使得SPI的紫外吸收值升高,荧光强度下降、最大吸收波长发生改变,而上述趋势,生物酶法交联的花青素-SPI共价聚合物展现的更为显著,这表明花青素可以改变SPI芳香族氨基酸残基的微环境,使SPI多肽链解折叠,进而使其三级结构构象发生改变,而同质量浓度花青素下,生物酶法较化学碱法使得花青素与SPI共价相互作用更强,花青素能更大程度地改变蛋白质的三级结构。
以上结果为生物酶法和化学碱法处理花青素与SPI对蛋白结构产生影响的差异提供了部分参考,使多酚与蛋白复合食品的合理应用有一定的理论依据。
