乳酸菌饮料中嗜酸乳杆菌的实时荧光定量PCR检测方法
2019-05-21张娜娜窦同海段文锋翁史昱
张娜娜,刘 洋,*,俞 漪,赵 渝,窦同海,徐 琼,段文锋,翁史昱
(1.上海市质量监督检验技术研究院,国家食品质量监督检验中心(上海),上海 200233;2.上海师范大学生命与环境科学学院,上海 200234;3.复旦大学生命科学学院,上海 200438;4.上海市质量管理科学研究院(上海),上海 200050)
嗜酸乳杆菌是重要的益生菌,被大量应用在食品中[1]。研究表明嗜酸乳杆菌能在乳制品中产生乳酸,并能通过氨基酸代谢增加风味[2-3]。嗜酸乳杆菌主要作用有降低pH值、产生抗菌素(如嗜酸菌素和乳酸杀菌素等),在一定程度上抑制肠道中有害微生物的有害作用[4-6]。有研究[7-9]发现嗜酸乳杆菌对大肠杆菌、腹泻致病菌等均有抑制作用;大量的嗜酸乳杆菌还可阻碍胆固醇的合成,降低血浆中胆固醇含量[10];另外对于乳糖不耐症也有一定的疗效[11-12]。嗜酸乳杆菌对肠道菌群的平衡和对微生态的调节也证明其对健康具有促进的作用[13-14]。在我国,饮料中添加益生菌特别是嗜酸乳杆菌成为新的发展趋势[15-16]。
关于益生菌的使用我国发布了一系列的法律法规,2016年,卫计委关于印发《可用于食用的菌种名单》的通知(卫办监督发[2010]65号)[17],规定食品中允许使用的菌种。2013年卫生部发布关于食品中使用菌种标签标识有关问题的复函(卫办监督函[2013]367号)[18]中明确指出,预包装食品中使用了上述菌种的,应当按照GB 7718—2011《预包装食品标签通则》[19]的要求标注其菌种名称,企业可同时在预包装食品上标注相应的菌株名、菌株号和活菌量。2016年制定了关于乳酸菌检测方法的标准GB 4789.35—2016《食品微生物学检验 乳酸菌检验》并在GB 7101—2015《饮料》规定乳酸菌饮料产品标签应标明活菌或非活菌,标识活菌的其活菌数至少要达到1×106CFU/mL[20-21]。标准检测方法操作复杂、结果判读时间长,很难满足市场快速检测的要求。为防止市场上出现滥竽充数的情况,建立基于分子水平的菌种特异性鉴定方法十分重要[22]。
目前在DNA水平上的分子检测方法越来越多,其检测方法快速方便、灵敏、省时被广泛应用到物种检测中[23]。其中实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)技术因其高特异性、高灵敏度、无污染等优点,在食品检测中备受青睐。本研究建立基于嗜酸乳杆菌SPIDR保守区域的序列结合实时荧光定量PCR方法定量检测饮料中的嗜酸乳杆菌,以保障食品安全监管顺利进行。
1 材料与方法
1.1 材料与试剂
据2016年卫计委发布,卫办监督发《可用于食品的菌种名单》[7]与市场上常见的乳酸菌菌株及可能存在的致病菌,本研究所选菌株为嗜酸乳杆菌4 株,非嗜酸乳杆菌共17 株,其中包括乳杆菌14 株,嗜热链球菌、大肠杆菌以及沙门氏菌各1 株。菌株样本见表1。菌种购买后均由上海市质量监督检验技术研究院自行保存。

表 1 标准菌种名称及其编号Table 1 Information about standard strains used in this study
1.2 仪器与设备
5430R振荡水浴槽 德国艾本德有限公司;电热恒温培养箱 美国Shellab公司;ESCO LA2-4A1生物安全柜 新加坡艺思高公司;7500 Fast荧光定量PCR仪美国ABI公司。
1.3 方法
1.3.1 标准菌株及乳酸菌饮料中嗜酸乳杆菌的培养
按照GB 4789.35—2016方法进行培养[21]。
1.3.2 乳酸菌核酸提取
改良的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)法提取核酸[24]。
标准菌株核酸提取:用无菌棉签沾取培养基上的菌株,在装有无菌水的2 mL离心管中洗脱,离心,加入400 µL溶菌酶(50 ng/µL),37 ℃孵育2 h,再加入40 µL蛋白酶K(20 mg/mL)和400 µL SDS,56 ℃水浴2 h,后按照核酸提取的步骤提取核酸。
乳酸菌饮料及模拟样品中核酸提取:样品混匀,取2 mL加入离心管中,2 000×g离心5 min,上清液移至新的离心管中,加入5 mL无菌水,混匀,沸水中放置10 min,2 000×g离心5 min,上清液移至新的离心管中,再次9 000×g离心10 min,去上清液,沉淀加入400 µL溶菌酶(50 ng/µL),37 ℃孵育2 h,再加入40 µL蛋白酶K(20 mg/mL)和400 µL SDS,56 ℃水浴2 h,后按照核酸提取的步骤提取核酸。
1.3.3 引物、探针设计
在NCBI网站上(http://www.ncbi.nlm.nih.gov/nucleotide/)下载嗜酸乳杆菌NCFM基因组,利用SPIDR的保守区域序列,借助ClustalW 软件对此序列进行比对,然后使用Primer Express 3 软件设计引物、探针(NCFM F:5’-GTGATCTTTCCTTCACTGCGT-3’;NCFM R:5’-TCCTCGATGGTAACTCTGTAGC-3’;NCFM P:5’-FAM-TGTGCTTCAGGGTTACCTCCACTTTCABQH-3’)用于嗜酸乳杆菌的鉴定,扩增片段为213 bp,在NCBI网站上使用BLAST数据库比对引物和探针的理论特异性。乳杆菌通用引物序列(ST16s F:5’-AGAGTTTGATCCTGGCTCAG-3’;ST 1495 R:5’-CTACGGCTACCTTGTTACGA-3’)用于扩增提取的DNA,检验提取物中含有核酸,作为对照。引物和探针均由英潍捷基生物公司合成。
1.3.4 PCR条件及检测
普通PCR采用20 µL体系进行PCR扩增,其中包括10 µL TaKaRa Ex Taq mix,上、下游引物(5 μmol/L)各1 µL,探针(5 μmol/L)0.5 µL,2 µL DNA模板,去离子水补足至20 µL。
普通PCR条件:94 ℃预变性5 min;94 ℃变性30 s,退火温度依次为56、58、60、62、64、60 s,72 ℃退火40 s,38 个循环;72 ℃延伸10 min。
PCR产物检测方法:取 5 µL PCR产物,在 1.0%琼脂糖凝胶和0.5% TE缓冲液中电泳28 min(120 V),然后采用凝胶成像系统拍照存档。
1.3.5 实时荧光定量PCR
实时荧光定量PCR体系为20 µL,包含TaKaRa Prober Taq mix 10 µL,上、下游引物(5 μmol/L)各1 µL,探针(5 μmol/L)0.5 µL,2.0 µL DNA 模板,去离子水补足至20 µL。采用实时荧光定量PCR系统进行扩增。反应参数:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火35 s,40 个循环。
1.3.6 检测方法的特异性、灵敏度和重复性测试
特异性测试:采用4 株嗜酸乳杆菌菌株,14 株近缘乳杆菌,以及3 株其他细菌的核酸为模板,采用建立的实时荧光定量PCR体系进行检测。
灵敏度测试:包括相对灵敏度和绝对灵敏度的检测。绝对灵敏度测试选取4 株嗜酸乳杆菌,分别将提取的核酸溶液进行稀释,核酸质量浓度依次为58、5.8、0.58、0.058、0.005 8、0.000 58、0.000 058 ng/µL,进行荧光扩增。相对灵敏度测试将嗜酸乳杆菌ATCC4356培养液进行稀释提取的核酸为模板,采用建立的实时荧光定量PCR体系进行检测。灵敏度的检测每个质量浓度设置6 个平行,实验重复3 次,最终满足不小于96%置信区间的要求。
重复性测试:采用嗜酸乳杆菌ATCC4356标准菌株核酸的6 个质量浓度的梯度稀释液进行扩增,每个质量浓度4 个平行,计算Ct值的标准偏差(standard deviation,SD)和相对标准偏差(relative standard deviation,RSD)。
1.3.7 实时荧光定量PCR体系的抗干扰能力检测
对建立的实时荧光定量PCR体系抗干扰能力测试包括培养物水平抗干扰能力检测和核酸水平抗干扰能力检测。核酸水平是将提取的嗜酸乳杆菌ATCC4356核酸稀释至58、5.8、0.58、0.058、0.0058、0.000 58 ng/µL,分别添加300 pg/µL、3 ng/µL、30 ng/µL的大肠杆菌ATCC25922核酸,对制备的混合核酸模板进行实时荧光定量PCR扩增;培养物水平是将嗜酸乳杆菌ATCC4356培养至108CFU/mL后依次稀释至10 CFU/mL,然后添加浓度为104CFU/mL和106CFU/mL的大肠杆菌ATCC25922,并提取核酸。每个浓度2 个平行,每个样品重复3 次。
1.3.8 模拟样品检测
利用建立好的实时荧光定量PCR技术对模拟样品进行检测,模拟样品的制作:嗜酸乳杆菌ATCC4356培养至109CFU/mL,以市场上购买不含嗜酸乳杆菌的乳酸菌饮料作为基质,进行梯度稀释,最终将稀释液进行核酸提取,以该核酸为模板扩增。每个浓度进行5 个平行。
1.3.9 实际样品检测
市场上随机购买样品共11 份,其中5 份样品的标签标记不含嗜酸乳杆菌,6 份样品标记含有嗜酸乳杆菌,按建立的实时荧光定量PCR方法对样品进行检测。每个样品3 个平行。
1.4 数据与图像处理
实验使用的仪器自带软件7500 Fast System Software v1.3.2在扩增过程中自动进行分析并得出Ct值,统计学分析则借助SPSS 14.0进行。
2 结果与分析
2.1 普通PCR的温度优化
利用普通PCR进行温度优化,扩增温度分别选择56、58、60、62、64 ℃几个梯度,结果如图1所示,扩增效率最高的是60 ℃,后续实验选择60 ℃为体系的扩增温度。

图 1 普通PCR扩增温度优化Fig. 1 Optimization of amplification temperature through traditional PCR
2.2 实时荧光定量PCR方法的特异性

图 2 实时荧光定量PCR特异性Fig. 2 Specificity of real-time fluorescence quantitative PCR
如图2A所示,所有嗜酸乳杆菌的标准菌株均有明显扩增,且Ct值在16~18之间,其他菌株均无明显的扩增;如图2B所示,采用乳杆菌通用引物对所有菌株进行扩增时,可见到清晰的扩增条目。证明本研究建立的实时荧光定量PCR检测方法对于嗜酸乳杆菌有较好的特异性。
2.3 检测方法的灵敏度
2.3.1 实时荧光定量PCR方法的绝对灵敏度

表 2 实时荧光定量PCR检测的绝对灵敏度Table 2 Aabsolute sensitivity of real-time fluorescence quantitative PCR
如表2所示,嗜酸乳杆菌ATCC4356、CICC6082、NCFM、La-14可稳定检测的最低质量浓度为0.000 58 ng/µL。每个模板添加4 µL,即检测限在3 pg左右,本研究的实时荧光定量PCR体系的绝对灵敏度达到3 pg。
2.3.2 实时荧光定量PCR的相对灵敏度
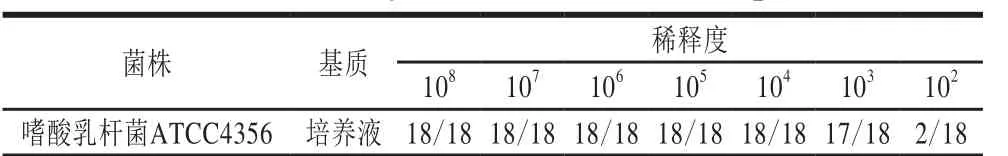
表 3 实时荧光定量PCR的相对灵敏度Table 3 Relative sensitivity of real-time fluorescence quantitative PCR
相对灵敏度检测是将嗜酸乳杆菌ATCC4356的培养液按照10 倍梯度稀释法从108~102CFU/mL各浓度取1 mL提取核酸,然后进行实时荧光定量PCR扩增。由表3可以看出,嗜酸乳杆菌ATCC4356的绝对灵敏度可稳定检出的最低浓度为103CFU/mL。根据绝对灵敏度和相对灵敏度的检测可得出实时荧光定量PCR的检测限为103CFU/mL。
2.4 实时荧光定量PCR方法的重复性检测结果

表 4 实时荧光定量PCR的重复性检测Table 4 Rrepeatability of real-time quantitative PCR
如表4所示,嗜酸乳杆菌ATCC4356不同的核酸浓度扩增,每个质量浓度6 个平行,最终实验结果Ct值的SD介于0.14~0.56之间,RSD介于0.862%~2.55%之间,均在可接受范围内。证明建立的实时荧光定量PCR方法重复性较好。
2.5 实时荧光定量PCR方法的抗干扰能力

表 5 实时荧光定量PCR在培养物水平上的抗干扰能力Table 5 Anti-interference ability of real-time fluorescence quantitative PCR against E. coli culture

表 6 实时荧光定量PCR纯基因水平上的抗干扰能力(Ct值)Table 6 Anti-interference ability of real-time fluorescence quantitative PCR against E. coli genome
在实际检测中,样品中的菌株一般是目标菌和其他菌株的混合物,因此在培养物水平进行检测可以排除样品中或在提取过程中混入杂菌的可能性;在纯基因水平进行抗干扰能力的检测可以排除在扩增过程中出现交叉污染的情况。由表5可以看出,在样品中混入103、106CFU/mL的杂菌对实时荧光定量PCR的扩增是没有干扰的,且检出限仍为103CFU/mL;由表6可以看出,在不同浓度的嗜酸乳杆菌ATCC4356的核酸中添加300 pg/µL、3 ng/µL、30 ng/µL的大肠杆菌ATCC25922的核酸提取物,各浓度梯度核酸检出的Ct值均未受影响,证明建立的实时荧光定量PCR扩增体系抗干扰能力强。
2.6 模拟样品的检测及标准曲线
为验证建立的方法是否可以在实际样品中进行检测,在进行实样检测之前,利用模拟样品对该方法进行验证。这样不仅可以节约时间,且节省成本在不含嗜酸乳杆菌的乳酸菌饮料为基质的模拟样品检测中,以Ct值为纵坐标,以嗜酸乳杆菌标准株已知的不同稀释菌数对数值(lg(CFU/g))为横坐标建立标准曲线,得出线性方程为y=-3.312 4x+38.939,R2=0.987,检测结果的线性较好且检测限仍为103CFU/mL。说明本实验建立的实时荧光定量PCR的检测方法可行,且检测的结果与实际添加量是一致的。
2.7 实际样品检测结果
对市售的11 份样品采用建立的实时荧光定量PCR方法进行检测,利用乳杆菌通用引物进行扩增,样品核酸全部扩增出目的条带,表明样品中已提出可扩增的DNA;采用嗜酸乳杆菌属的特异性引物、探针扩增,含有嗜酸乳杆菌的6 份乳酸菌饮料全部扩增出目标条带,定量检测结果表7所示。

表 7 实际样品的实时荧光定量PCR检测结果Table 7 Detection of actual samples by real-time fluorescence quantitative PCR
由表7可以看出,11 份样品中,6 份样品检测出含有嗜酸乳杆菌,编号分别为B1、B4、B6、B7、B8、B9,这与购买样品的便签信息一致。检测结果可以看出,嗜酸乳杆菌的含量在5.83×102~3.68×104CFU/mL之间,建立的实时荧光定量PCR方法可以用砸乳酸菌饮料中对嗜酸乳杆菌进行定量。
3 讨论与结论
乳酸菌饮料中添加嗜酸乳杆菌的产品越来越多,且价格较高,利益驱使下可能会出现“滥竽充数”的现象,值得监管部门重视。我国卫生部曾发布相关标准规定:乳酸菌饮料中益生菌活菌的添加量要不低于106CFU/mL。目前对于乳酸菌饮料特别是非活菌饮料中益生菌的菌种鉴定、益生菌定量检测缺少快速、准确、特异性、高通量的检测方法。
传统方法一般依赖于国家标准对嗜酸乳杆菌进行检测,即基于培养法,耗时耗力,结果受操作者经验影响较大,难以满足市场精确鉴定和定量的要求。利用分子生物法进行检测的手段已在食品微生物检测中得到应用[25-28]。Guo Zihao[29]和包秋华[30]等研究了发酵食品中嗜酸乳杆菌的检测技术,有研究表明利用荧光定量PCR方法对发酵乳中的乳酸菌或双歧杆菌进行检测,并与平板计数法进行比较,结果显示PCR法与平板法技术结果相符[31-33]。这些均证明实时荧光定量PCR可以在乳酸菌饮料的检测中应用,且具有快速、通量高、重复性高等优点。目前,国内外对嗜酸乳杆菌的定性定量检测研究报道较少。本实验建立乳酸菌饮料中添加嗜酸乳杆菌的定性定量检测方法,对方法的特异性、灵敏度、重复性、抗干扰能力等多方面参数进行研究,结果表明该方法具有很强的实用性。
本研究利用设计的嗜酸乳杆菌属的特异性引物建立实时荧光定量PCR方法在乳酸菌饮料中的检测应用。结果证明,该方法的特异性好,检测限低,纯基因水平检测限在3 pg左右,绝对灵敏度检测达到103CFU/mL,且重复性较好;在纯基因水平与培养物水平的抗干扰能力都很强;模拟样品检测中其检测限未改变,重复性较好,证明适合在市场检测中使用;实际样品检测结果与标签信息一致。并得出嗜酸乳杆菌相应的添加量,只是嗜酸乳杆菌的含量有所不同。这一研究证明该方法可应用在乳酸菌饮料中嗜酸乳杆菌的快速检测。
