人肝癌细胞株中PTPRD表达变化及其对HuH-7细胞增殖、迁移的影响和机制
2019-05-21田婧蒙秋华董敏
田婧,蒙秋华,董敏
(广西医科大学药学院,南宁530021)
肝癌(HCC)是常见的恶性肿瘤之一,发病率和病死率逐年升高[1]。虽然HCC的早期诊断和治疗取得了重大进展,但总体治疗效果仍不理想[1,2]。蛋白酪氨酸磷酸酶D(PTPRD)基因是蛋白酪氨酸家族(PTPs)的重要成员[3,4]。PTPs可调节细胞的生长、代谢、免疫应答和重要的细胞信号通路转导[4]。越来越多的研究表明,PTPRD基因可作为一种抑癌基因,与多种恶性肿瘤的发生发展有关[5~7]。有文献报道[8],PTPRD基因在肝癌细胞中表达缺失或失活,PTPRD基因高表达可明显抑制肝癌细胞的生长,但具体机制尚不明确。近年来有研究表明,肝癌的发生发展涉及多种信号通路转导异常[9,10],如磷脂酰肌醇3(PI3K)-蛋白激酶B(PKB/Akt)-雷帕霉素靶蛋白(mTOR)信号通路。但关于PTPRD基因是否可以调控PI3K-Akt-mTOR信号通路对肝癌发生发展产生影响,目前尚未见文献报道。2017年12月~2018年8月,本研究观察了上调PTPRD基因表达对肝癌细胞增殖、迁移的影响,并基于PI3K-Akt-mTOR信号通路蛋白表达变化探索相关机制。现报告如下。
1 材料与方法
1.1 细胞与主要实验材料 正常肝细胞LO2购于武汉普诺赛生命科技有限公司,肝癌细胞株HepG2购于上海美轩公司,肝癌细胞株HuH-7购于中科院上海细胞库。DMEM高糖培养基购于美国Gibco公司。胎牛血清购于以色列BI公司。四甲基偶氮唑盐试剂购北京索莱宝公司。PTPRD过表达和阴性对照腺病毒购于上海吉凯基因化学技术有限公司。PTPRD和GAPDH引物序列购于上海英潍捷基公司。RNA提取试剂盒、逆转录试剂盒和PCR扩增试剂盒均购于日本TaKaRa公司。PTPRD、mTOR、p-mTOR、GAPDH抗体均购于美国Abcam公司。Akt和p-Akt抗体购于美国Cell Signaling Technology试剂公司。BSA粉末购于上海碧云天公司。ECL显影液购于美国Millipore公司。
1.2 LO2、HepG2、HuH-7细胞中PTPRD mRNA及蛋白表达观察
1.2.1 PTPRD mRNA检测 采用过柱法提取各组细胞总RNA,逆转录成cDNA,并进行PCR反应。PTPRD上游引物序列为5′-TTTACACGAACACCCGTTGA-3′,下游引物序列为5′-CGGAGTCCGTAAGGGTTGTA-3′。内参GAPDH上游引物序列为5′-CAGCCTCAAGATCATCAGCA-3′,下游引物序列为5′-TGTGGTCATGAGTCCTTCCA-3′。PCR反应体系为20 μL。以2-ΔΔCt表示PTPRD mRNA相对表达量。
1.2.2 PTPRD蛋白检测 RIPA裂解液提取各组细胞总蛋白,用BCA试剂盒检测蛋白浓度。分别取各组适量总蛋白加入4×上样缓冲液,100 ℃水浴加热8 min;配置8%分离胶+5%浓缩胶进行SDS-PAGE电泳,电泳后转印至PVDF膜;用含5% BSA的TBST溶液室温摇床封闭PVDF膜1 h,TBST洗涤3次,每次5 min;将PVDF膜分别放入一抗稀释液中,4 ℃冰箱孵育过夜;从孵育盒中取出PVDF膜,TBST洗涤3次,每次5 min;放入二抗中室温孵育1 h,TBST洗涤3次,每次5 min;ECL显影,用Image J软件分析蛋白条带灰度值。以目的蛋白条带灰度值与内参GAPDH蛋白条带灰度值的比值表示目的蛋白的相对表达量。
1.3 上调PTPRD基因表达对HuH-7细胞增殖、迁移的影响观察
1.3.1 PTPRD基因表达上调的HuH-7细胞构建 将处于对数生长期的HuH-7细胞消化,以3×105/孔接种于6孔板中,将细胞分为PTPRD上调组和阴性对照组,放置于37 ℃、5% CO2培养箱中培育24 h。根据腺病毒转染说明书分别转染PTPRD过表达腺病毒和阴性对照腺病毒,转染10 h后更换新的培养基继续培养。转染48 h后,使用荧光显微镜观察各组荧光表达情况并拍照,各组转染效率>95%。采用实时荧光定量PCR法检测两组细胞中的PTPRD mRNA,采用Western blotting法检测PTPRD蛋白。PTPRD上调组和阴性对照组PTPRD mRNA相对表达量分别为 8.94±0.13和1,PTPRD蛋白相对表达量分别为1.48±0.02、1.30±0.03,PTPRD上调组PTPRD mRNA及蛋白相对表达量均高于阴性对照组(P均<0.01)。PTPRD过表达细胞模型构建成功。
1.3.2 HuH-7细胞增殖能力检测 两组细胞消化后分别以5×103/孔接种于96孔板中,24 h后更换无血清培养基继续培养实现同步生长,分别于0、24、48、72 h后避光,在每孔中加入20 μL的MTT试剂,继续放置于培养箱中培养,4 h后去培养基,每孔加入150 μL的DMSO溶液,在37 ℃摇床上混匀15 min,检测490 nm波长处的光密度(OD)值,以PTPRD上调组与阴性对照组OD值的比值表示细胞增殖能力。
1.3.3 HuH-7细胞迁移能力检测 转染48 h后,将PTPRD过表达组和阴性对照组的细胞分别消化,以1×105/孔接种于48孔板中,24 h后细胞贴壁,吸出原有培养基,用200 μL的枪头垂直于孔板底部划“1”,用PBS冲洗细胞碎片2次后加入无血清培养基继续培养,并分别于划痕0、48 h后用显微镜观察、拍照记录各组转染细胞的迁移情况。细胞迁移率=(划痕后0 h的划痕面积-划痕后48 h的划痕面积)/划痕后0 h的划痕面积。
1.4 HuH-7细胞中Akt、p-Akt、mTOR、p-mTOR蛋白检测 采用Western blotting法检测两组细胞中的Akt、p-Akt、mTOR、p-mTOR蛋白,方法参照“1.2.2”。

2 结果
2.1 LO2、HepG2、HuH-7细胞中PTPRD mRNA及蛋白表达比较 LO2、HepG2、HuH-7细胞中PTPRD mRNA相对表达量分别为1、0.002±0.001、0.000 069 4±0.000 012 3,PTPRD蛋白相对表达量分别为1.73±0.15、0.80±0.12、0.70±0.06,HepG2细胞、HuH-7细胞中PTPRD mRNA及蛋白相对表达量均低于LO2细胞(P均<0.05)。选取PTPRD mRNA和蛋白相对表达量最低的HuH-7细胞进行后续实验。
2.2 两组HuH-7细胞增殖能力比较 PTPRD上调组细胞贴壁0、24、48、72 h时细胞增殖能力分别为0.17 ±0.01、0.28±0.01、0.58±0.02、0.86±0.02,阴性对照组分别为0.19±0.01、0.38±0.03、0.82±0.01、1.30±0.04,PTPRD上调组细胞贴壁24、48、72 h时细胞增殖能力低于阴性对照组(P均<0.05)。见图1。
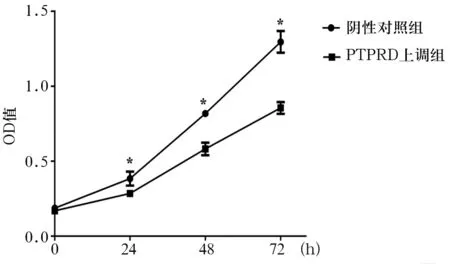
注:与PTPRD上调组相比,*P<0.05。
2.3 两组HuH-7细胞迁移率比较 划痕48 h后, PTPRD上调组和阴性对照组细胞迁移率分别为0.09±0.01、0.23±0.01,PTPRD上调组细胞迁移率低于阴性对照组(P<0.01)。见图2。
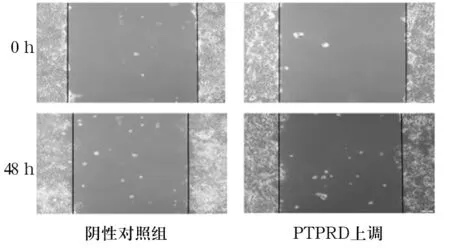
图2 两组HuH-7细胞划痕后0、48 h细胞迁移情况
2.4 两组HuH-7细胞中Akt、p-Akt、mTOR、p-mTOR蛋白表达比较 PTPRD组上调组细胞中Akt、mTOR蛋白相对表达量分别为1.01±0.04、0.96±0.02,p-Akt/Akt、p-mTOR/mTOR分别为0.65±0.02、0.72± 0.03;阴性对照组分别为1.22±0.12、1.11±0.08、1.02±0.01、1.32±0.09。PTPRD上调组细胞p-Akt/Akt、p-mTOR/mTOR均低于阴性对照组(P均<0.01)。
3 讨论
肝癌恶性程度高、预后极差。虽然近年来肝癌的相关基础研究和临床研究取得了巨大进展,但由于肝癌的发生发展机制尚不明确,肝癌的预防、诊断和治疗仍面临重重阻碍。此外,由于肝癌的恶性程度高、侵袭性极强及治疗后复发率、转移率高,导致患者的总体预后普遍较差,5年生存率不足10%[11,12]。因此,进一步阐明肝癌的发病机制,寻找新的基因治疗靶点,对肝癌的预防、早期诊断、治疗水平的提高、改善患者生存质量等方面具有重要意义。
PTPRD基因位于9p23-p24.3,其基因编码的蛋白包含1 912个氨基酸,在正常脑、肝脏、胰脏、脂肪组织等组织中高表达[3,4]。随着对PTPRD基因的研究不断深入,越来越多的研究显示,PTPRD基因在肝癌、神经母细胞瘤、肺癌和黑色素瘤等多种恶性肿瘤中均存在表达缺失或表观遗传学变化,并且诱导PTPRD基因过表达后可明显抑制肿瘤细胞的生长[5~8]。以上研究结果提示,PTPRD基因与肝癌细胞的生长有关,但其机制尚不清楚。我们通过初步实验发现,PTPRD mRNA及蛋白在人正常肝细胞株LO2和肝癌细胞株HepG2、HuH-7中的表达水平有显著性差异,且HuH-7细胞中PTPRD表达低于HepG2细胞,提示PTPRD表达缺失可能与肝癌的发病有关。对不同肝癌细胞系同一基因表达的差异进行深入研究,可能会对不同病因所引起的肝癌的治疗和预后评估有重要指导意义。我们成功构建了PTPRD基因过表达的HuH-7细胞,发现PTPRD基因过表达后可明显抑制肝癌细胞的增殖和迁移。以上研究结果均表明,PTPRD基因在人肝癌细胞中低表达,可作为一种抑癌基因参与肝癌的发生发展过程。
研究表明PTPs家族成员在细胞内均具有两个磷酸酶活性的结构域D1和D2,可以与酪氨酸激酶共同调节细胞内的酪氨酸磷酸化和去磷酸化过程,参与调节细胞信号转导通路[4]。此外,有文献报道,一些PTPs家族成员可负性调控PI3K-Akt-mTOR信号通路,抑制肿瘤细胞的生长,如蛋白酪氨酸磷酸酶(SHP-1)[13]、磷酸酶及张力蛋白同源的基因(PTEN)等[14]。PI3k-Akt-mTOR信号通路是体内一条重要的信号转导通路,能够调控细胞的增殖、迁移和侵袭[15,16]。研究[16~19]发现,该信号通路在肝癌、胃癌、乳腺癌、神经母细胞瘤等多种恶性肿瘤细胞中均存在功能异常,与肿瘤细胞的增殖、分化和凋亡有关。PTPRD基因作为PTPs家族的重要成员之一,其能否调控PI3k-Akt-mTOR信号通路,影响肝癌细胞的增殖与迁移尚无相关文献报道。本研究检测了两组HuH-7细胞中PI3k-Akt-mTOR信号通路的关键蛋白Akt、p-Akt、TOR、p-mTOR,结果发现,PTPRD基因过表达可降低肝癌细胞中p-Akt、p-mTOR蛋白的表达水平,抑制PI3k-Akt-mTOR信号通路激活,提示PTPRD基因可能参与负性调控PI3k-Akt-mTOR信号通路,抑制肝癌细胞的增殖与迁移。
综上所述,PTPRD可能通过调控PI3K-Akt-mTOR信号通路,抑制肝癌细胞的增殖和迁移,其有望作为潜在的肝癌治疗靶点。但由于现阶段相关研究较少,且体内的信号通路转导错综复杂,仅凭细胞水平实验研究无法全面阐述PTPRD表达上调后对肝癌细胞的作用效应。因此,今后可以从表观遗传学、动物实验及临床试验等方面展开更深入的研究和探讨,为肝癌的治疗提供新思路。
