基于学科核心素养的化学概念教学
——以“离子反应”第一课时为例
2019-05-21袁君亚
袁君亚
(江苏省江阴长泾中学,江苏 无锡 214411)
化学概念是中学化学最基础、最关键、最核心的内容,是学生学好化学知识的首要前提,它是人们对化学研究最本质的概括和认识,深刻反映了过程中最本质的化学特征。[1]
一、教学内容分析
“离子反应”是人教版化学必修1第二章第二节内容,是中学化学重要的基础概念之一。《普通高中化学课程标准(2017年)》中对本节内容的要求是:认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。此前,在九年级化学教学中介绍了常见的酸、碱、盐的组成及其性质,并且学习了复分解反应,知道复分解反应的条件是生成沉淀、气体和水,这是对水溶液中复分解反应的宏观认识,但是,学生对电解质在水溶液中的存在状态及行为还缺乏足够的理解和认识,对水溶液中物质的认识还没有深入到微观这一层面,对复分解反应的微观实质还不太清楚,不能从微观的角度分析离子的存在以及离子之间的相互作用,欠缺研究微观问题的方法和思路。因此本节内容在此基础之上,由宏观到微观,揭示酸、碱、盐在水溶液中的变化本质——电离,从微观粒子作用观的角度剖析复分解反应的实质,从微粒的存在到离子之间的相互作用再到离子之间相互作用的结果,深刻理解水溶液中物质发生复分解反应的微观实质,建立研究水溶液中物质反应的新思路和新视角。
二、基于化学核心素养的教学目标分析
高中化学学科核心素养包括“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”5个方面:
1.通过“电离理论”化学史的学习,了解酸、碱、盐电离成自由移动离子的过程。
2.通过概括总结,形成酸、碱、盐及电解质的概念,从能否电离的角度对化合物进行分类。
3.通过手持技术实验探究了解复分解型离子反应的微观本质是离子浓度的减少。
这些教学目标与核心素养的关系具体定位如图1所示。

图1 核心素养目标转化为课时教学目标
三、基于化学核心素养的教学过程
(一)通过“电离理论”化学史的学习,了解酸、碱、盐在水溶液中的电离

播放视频,人在剧烈运动之后需要喝运动饮料,运动饮料中含有电解质,揭示电解质在人体内的作用,在细胞内外靠电解质维持渗透压,如图2所示。

图2 电解质在人体内维持渗透压示意图
师:电解质在人体内发挥巨大的作用,与我们人体的健康息息相关,那么什么是电解质呢?下面我们一起来加以研究。
师:刚才视频中提到我们最熟悉的食盐,在人体内产生离子。氯化钠晶体中有离子,氯化钠溶液中也有离子,它们都能导电吗?为什么?
师:在化学发展过程中存在两种观点,观点1:法拉第认为溶液中的离子是在通电的条件下产生的。
链接史料:1832—1834年,法拉第首次假定电流能使盐溶液产生带电物质,这种物质可使溶液导电。就把这种能输送电流的带电物质称为离子,即法拉第认为溶液中的离子是通电后产生的。
师:观点2:阿累尼乌斯认为导电性溶液的溶质在水的作用下自行解离为自由移动的离子。到底谁的观点是正确的呢?
链接史料:1882—1883年期间,瑞典化学家阿累尼乌斯发现“水”是将电解质离解成阴、阳离子的因素。阿累尼乌斯形成了“电离理论”的基本观点。这一学说与当时化学界所认同的法拉第的观点(“通电后产生离子”)截然不同。
实验:测定NaCl固体、水和NaCl溶液的导电性。
用电导率便携式传感器测定NaCl 固体和NaCl 溶液的导电性如表1所示。

表1 不同物质的电导率
师:从表中可以看出,氯化钠固体虽然含有离子但不导电;氯化钠溶液很容易导电,而且随着氯化钠固体的不断加入,电导率在不断升高。有人怀疑,是否是水在导电呢?经过测定,水几乎不导电。充分说明是水将氯化钠离解成阴阳离子。
师:我们通过实验获得的宏观证据,还需要从微观角度获得解释,请看动画。
动画:模拟氯化钠溶于水的电离过程。
师:有没有其他方法使氯化钠导电?
链接史料:1807年,英国化学家戴维尝试用电解法从苛性钾(KOH)中分离出钾。但是存在这样一个化学事实,金属钾遇水就会强烈地反应,同时生成氢氧化钾和氢气。他改用电解熔融态苛性钾的方法制得活泼金属钾。
结论:物质(化合物)能导电是因为电离而产生自由移动的离子。
师:归纳一下,什么是电离?
生:物质在水溶液中或熔融状态下自行解离为离子的过程。
(二)用化学符号表征电离的过程
师:请大家根据氯化钠的电离过程,推测硫酸、氢氧化钠、氯酸钾、氢氧化钡、氯化铵、硫酸氢钠和硫酸铁在水溶液中的存在形式,并写出它们的电离方程式。
学生书写电离方程式,同一学习小组的同学相互纠错。
师:书写电离方程式必须遵循质量守恒,电离方程式的两端原子个数必须相等;必须遵循电荷守恒,右侧的离子电荷总数应该为零。
师:结合上面的分析,如何从电离角度重新认识酸、碱、盐?
生:酸:电离时,生成的阳离子全部是H+的化合物。碱:电离时,生成的阴离子全部是OH-的化合物。盐:电离时,生成金属阳离子(或NH4+)和酸根离子的化合物。
设计意图:本节课从化学史中阿累尼乌斯与法拉第观点的不同入手,激发学生探究的兴趣。以电导率传感器测定出的实验数据作为证据推理说明水使Na-Cl发生电离,微观模拟NaCl的电离过程帮助学生加深理解。根据学生的电离方程式典型错误进行适当的讲解和说明,强化质量守恒定律和电荷守恒原理。

师:酸碱盐是电解质,如何定义电解质?
生:电解质:在水溶液中或熔融状态下能导电的化合物。
师:根据电导率数据可以发现,水也能极其微弱地电离,所以水也是一种电解质。
师:相同体积、相同浓度的不同电解质溶液的导电能力都相同吗?以等浓度、等体积的HCl、CH3COOH溶液为例。
实验:用便携式电导率传感器测定HCl 和CH3COOH溶液的电导率。
师:根据电导率的差异请大家猜测其中可能的原因。
生:两种溶液中离子浓度大小不同,HCl中离子浓度比较大,CH3COOH中离子浓度比较小。
师:通过微观模拟HCl 和CH3COOH 的电离过程,如图3所示,从中可以得出什么结论?
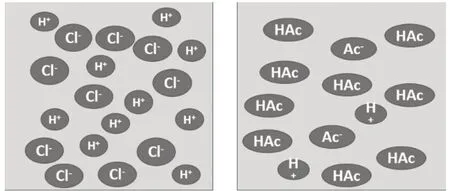
图3 HCl与CH3COOH电离情况示意图
生:HCl 完全电离,CH3COOH 部分电离,CH3COOH分子和H+和CH3COO-共存。
设计意图:根据酸碱盐的定义,由学生归纳总结出电解质的定义,促使学生将概念内化,深刻理解化学的核心概念。通过测定相同浓度的HCl 和CH3COOH 的电导率,让学生了解HCl 完全电离,CH3COOH 部分电离,目的不是要讲强弱电解质,而是为后面离子方程式中物质是否拆解成离子埋下伏笔。
(三)离子反应的本质

教师与学生活动
师:我们已经知道酸和碱等电解质能在水溶液中发生电离,如果将酸和碱混合将会发生复分解反应(中和反应),那么复分解反应的微观实质是什么呢?我们以HCl和Ba(OH)2溶液的反应来探究。
师:以你的知识,设计实验说明二者发生了反应?
生:向氢氧化钡溶液中滴加酚酞,然后逐滴滴加盐酸,观察溶液颜色的变化。
学生实验:液体量取1~2 mL;不要将滴管伸入试管内,边加边振荡。
演示实验:利用电导率传感器探究中和反应的微观实质。如图4所示。

图4 HCL和Ba(OH)2溶液反应情况示意图
师:思考问题:1.BC 段是在加入比原溶液离子浓度大的溶液,为什么离子浓度不升反降?用化学方程式表示其原理。2.C点为什么不为0,且远大于纯水的电导率300us/cm?
生:BC 段说明离子之间在发生反应,导致离子浓度减小;H++OH-=H2O;C 点时溶液中仍然存在大量离子,所以其电导率远大于纯水的电导率300us/cm。
师:由上述实验我们清楚地“看到”:盐酸和氢氧化钡在水溶液中混合所发生的复分解反应的实质就是:盐酸电离生成的H+和氢氧化钡电离生成的OH-结合生成水的反应,而Cl-和Ba2+并没有参与反应,所以这个反应可表示为:H++OH-=H2O。
师:像这样的离子之间的反应我们称之为:离子反应。
师:我们可以按照本实验的思路,探究其他复分解反应的实质(如:AgNO3与NaCl,Na2CO3与HCl),不难得出:复分解反应的实质就是离子之间的反应,而这类离子反应所发生的条件是:生成沉淀、气体和水。
师:其实复分解型的离子反应的发生条件可以归为一点就是使溶液中的离子浓度减小。
师:龙江河发生镉污染,镉元素以Cd2+的形式存在,镉离子有毒,严重影响广大人民群众的安全。
师:学习了离子反应,请你们帮他们想想办法,如何处理镉污染。
生:让镉离子沉淀下来。
资料:镉离子沉淀所需的pH。
生:投放烧碱或石灰,提高河水的pH 值让水呈弱碱性,使Cd2+形成Cd(OH)2沉淀不溶于水并从水中分离。
视频:实际处理过程,除沉淀法外还采用聚合氯化铝产生氢氧化铝胶体吸附Cd(OH)2。
师:大家提到化学不要谈虎色变,其实化学不是产生问题,学好化学可以帮助人们解决问题。
设计意图:离子反应的传统实验教学中,教师往往是引导学生通过肉眼观察沉淀、气体等的生成来反推溶液中离子数目的减少。在教学中引入手持技术,学生除了直接观察以外,还可以通过手持技术实验系统观察到溶液其他数据的变化,比如导电率、pH等,且手持技术实验系统还可以直接形成图像,可以更直观地表征化学反应的进程。在曲线表征方面,手持技术实验比传统实验的可观察角度更多、更全面,也更细致。通过龙江河的污染治理,让学生知道学有所用,能够解决生产、生活中的实际问题,让学生产生责任感和使命感,学习化学知识必须为人类、为社会服务。
抽象的概念离不开感性材料的支撑,通过创设真实合理的问题情境提出问题,利用实验手段让学生观察、感受、分析、推理,从微观角度进行分析,解释宏观现象,最后抽象概括而引出概念。
