β-细辛醚减少美多芭在PD 模型大鼠中的使用剂量
2019-05-20宁百乐张芹欣邓敏贞王南卜方永奇
宁百乐, 张芹欣, 邓敏贞, 王南卜, 方永奇
(1.广东省中医院、广州中医药大学第二临床医学院、广东省中医药科学院,广东广州 510120;2.广州中医药大学,广东广州 510405;3.广州中医药大学第一附属医院,广东广州 510405)
帕金森病(Parkinson's disease,PD)是一种常见的神经系统退行性疾病,其患病率为神经系统退行性疾病的第2位,全球患病率为400~1 900/10万[1,2]。我国65岁以上人群的患病率为1 700/10万,并随年龄增长而升高,给家庭和社会带来沉重的负担[3]。该病的主要病理改变为黑质致密部多巴胺能神经元丢失和α-突触核蛋白(alpha-synuclein,α-syn)异常积聚形成路易小体,其主要生化改变为纹状体区多巴胺(dopamine,DA)等神经递质降低,临床症状包括静止性震颤、肌强直、运动迟缓和姿势平衡障碍等运动症状及嗅觉减退、睡眠障碍、便秘和抑郁等非运动症状。目前PD的发病机制仍没有明确,使探寻治疗PD疗法的道路困难重重。
目前,治疗本病的方法和手段包括药物治疗、手术治疗、运动疗法、心理疏导及照料护理等。药物治疗为首选,且是整个治疗过程中的主要治疗手段。手术治疗则是药物治疗的一种有效补充。药物治疗虽可暂时缓解症状,但不良反应亦较明显,并易产生耐药[4]。幸运的是,中医药治疗PD可持续改善症状,减轻西药不良反应,降低耐药性,与西药合用可提高疗效。石菖蒲作为醒脑开窍的代表药物被用于PD的治疗,它具有开窍豁痰、醒神益智、化湿辟秽的功效。现代研究表明,石菖蒲挥发油的主要有效成分为β-细辛醚,它分子量小,亲脂性高,在体内吸收快、分布快[5],能快速通过血脑屏障,在脑组织内分布广泛[6,7]。我们前期发现β-细辛醚能够改善6-羟基多巴胺(6-OHDA)诱导的PD模型大鼠的行为学,升高纹状体内高香草酸(HVA)、DA及5-羟基吲哚乙酸(5-HIAA)的含量,还可以降低α-syn的含量,同时促进脑内的酪氨酸羟化酶(TH)的表达[8];此外,β-细辛醚能够促进左旋多巴(L-DOPA)入脑,升高脑内DA的含量[9]。美多芭是临床上治疗PD的常用药物,能够有效改善PD的临床症状,但是随着应用时间的延长,多会出现疗效减低和不随意运动等副作用。如何延长美多芭的应用时间,减轻美多芭引起的副作用,是当前研究的热点问题。因此,本研究观察β-细辛醚联合低剂量美多芭对6-OHDA诱导的PD模型大鼠的行为学、DA等神经递质、DA合成酶及肝肾功能和组织病理学的影响,探讨联合用药后,能否减少美多芭的使用剂量,疗效是否与单独使用美多芭相当,是否能减轻肝肾功能的损害。现将研究结果报道如下。
1 材料与方法
1.1实验动物健康成年SPF级SD大鼠70只,雌雄各半,220~250 g,广州中医药大学实验动物中心提供,动物许可证号:SCXK(粤)2013-0034。实验方案经过广州中医药大学第一附属医院实验动物伦理委员会同意(TCMF1-2015024)。
1.2药物与试剂石菖蒲,购于广州中医药大学第一附属医院,产地四川,经鉴定为天南星科植物石菖蒲(Acorus tatarinowii Schott)的干燥根茎,批号:150501;美多芭,上海罗氏制药有限公司,批号:SH2244。阿扑吗啡(APO)标准品,上海瑞齐生物科技有限公司,批号:100839-201212;维生素C片,广东华南药业集团有限公司,批号:150105;6-OHDA,上海源叶生物科技有限公司,货号:YY12246;水合氯醛,天津市福晨化学试剂厂,批号:20140512;Anti-tyrosine hydroxylase antibody,美国Abcam公司,货号:ab137869;Goat anti-rabbit IgG,FITC conjugated,北京康为世纪生物科技有限公司,货号:CW0114;DA标准品,上海源叶生物科技有限公司,CAS:62-31-7;左旋多巴标准品,中国食品药品检定研究院,货号:100170-200303;高香草酸标准品,成都曼斯特生物科技有限公司,货号:must-12122301;5-羟色胺标准品,成都曼斯特生物科技有限公司,货号:Must-12122605;3,4-二羟苯乙酸标准品,美国Sigma-Alorich公司,货号:1451791V;多巴脱羧酶(DDC)酶联免疫吸附分析(ELISA)(血清)试剂盒,加拿大Elixir医药公司,批号:D085SC;DDC ELISA(组织)试剂盒,加拿大ELIXIR医药公司,批号:D085FC;磷酸二氢钾,广州化学试剂厂,批号:20150123;甲醇(色谱纯),德国Merck公司,CAS:67-56-1;乙腈(色谱纯),德国Merck公司,CAS:75-05-8;4%多聚甲醛,北京康为世纪生物科技有限公司,货号:DF0135;丙氨酸氨基转移酶(ALT)的ELISA(血清)试剂盒(批号:C009-2)、天冬氨酸氨基转移酶(AST)的ELISA(血清)试剂盒(批号:C010-2)、肌酐(Cr)的ELISA(血清)试剂盒,(批号:C011-2)、血尿素氮(BUN)的ELISA(血清)试剂盒(批号:C013-2)、总胆红素(TBIL)ELISA(血清)试剂盒(批号:C019-1),南京建成生物工程研究所。
1.3仪器脑立体定位仪,美国STOELTING公司;疲劳转棒仪,成都泰盟科技有限公司,型号:ZB-200;旷场箱,自制;高效液相色谱仪,美国Waters公司,型号:Waters-2695;Symmetry色谱柱(150 mm×4.6 mm),美国 Waters公司,Lot NO.0291351623;针筒式微孔滤膜过滤器,天津市腾达过滤器厂,规格:直径25 mm,孔径0.45 μm;Multiskan MK3酶标仪,美国Thermo Scientific公司;电子分析天平,梅特勒-托利多仪器(上海)有限公司,型号:AE-200;3K30低温高速离心机,美国Sigma公司;ARATHON牙科钻,SAEYANG公司;流式细胞仪,Beckman公司,型号:FC 500。
1.4药物制备石菖蒲挥发油的制备:按照2010年版《中华人民共和国药典》一部附录挥发油的提取方法提取挥发油。称取石菖蒲,加8倍量的水,煎煮8 h,收集挥发油备用。β-细辛醚单体的制备:取石菖蒲挥发油,采用冷冻结晶法进行纯化和分离得白色晶体。β-细辛醚单体纯度的检测:用气质联用法证实其纯度为99%以上[10]。
1.5 PD模型制备在给予大鼠100 g/L水合氯醛(剂量为350 mg/kg)麻醉的状态下,于左侧前脑内侧束内,单点注射6 μL(质量浓度为4 g/L)的6-OHDA, 坐 标 为 tooth bar: -2.3 mm, antero-Posterior: -4.4 mm,medio-lateral:1.2 mm,dorsoventral:-7.8 mm[11]。假手术组 10 只大鼠注射 6 μL的0.2 g/L维生素C生理盐水。造模1个月后,将腹腔内注射剂量为0.5 mg/kg的阿扑吗啡(APO),且出现在水平地面转圈,向健侧旋转圈数大于7圈/min的大鼠判断为成功PD模型。
1.6分组与给药将造模成功的大鼠随机分为6组,每组10只,分别为模型组(蒸馏水,剂量为1 mL/100 g)、美多芭组(美多芭,剂量为75 mg/kg)、β-细辛醚组(β-细辛醚,剂量为15 mg/kg)、β-细辛醚+1/4美多芭组(β-细辛醚15 mg/kg+美多芭18.75 mg/kg)、β-细辛醚+1/2美多芭组(β-细辛醚15 mg/kg+美多芭37.5 mg/kg)和β-细辛醚+美多芭组(β-细辛醚15 mg/kg+美多芭75 mg/kg)。每天分2次灌胃给药,给药30 d。本课题组研究β-细辛醚多年,认为15 mg/kg的β-细辛醚最为合理。
1.7行为学检测各组大鼠在给药第28天进行自主运动功能测试(旷场实验)、平衡能力与协调性测试(转棒实验)和感觉运动整合功能测试(前肢实验)的适应性实验。在给药第29、30天进行正式的行为学检测。检测前,每只大鼠要适应5 min。旷场实验:自制60 cm×60 cm×40 cm的木箱,底部以10 cm×10 cm划分,将大鼠放在中央格内,记录大鼠的移动格子数,站立次数和中央停留时间;转棒试验:将大鼠放在疲劳转棒仪上,记录大鼠在转棒上的停留时间;前肢实验:记录右前肢的启动时间。
1.8取材第31天,将各组大鼠用100 g/L水合氯醛(剂量为350 mg/kg)腹腔注射麻醉后,打开大鼠的胸腹腔,腹主动脉取血,用9.0 g/L生理盐水心脏灌注(直到大鼠的肺完全变白为止),取肝肾,随后开颅取脑,分离纹状体和中脑,称质量记录,放入相应编号的离心管,纹状体置于-80℃备用。
1.9观察指标与方法
1.9.1 高效液相色谱(HPLC)法测定纹状体内单胺类神经递质L-DOPA、DA、3,4-二羟基苯乙酸(DOPAC)、5-羟色胺(5-HT)、5-HIAA、HVA的含量 将纹状体按1 mg∶5 μL加入5%高氯酸,电动匀浆,离心(12 000 g,4℃)10 min后将上清液过滤放置于相应编号的样品瓶中,置于4℃待测。色谱条件:流动相0.1 mol/L KH2PO4∶甲醇=80∶20,Waters Symmetry色谱柱(150 mm ×4.6 mm),柱温30℃,流速1 mL/min,激发波长280 nm,发射波长330 nm,进样量20 μL。
1.9.2 HPLC测定血清单胺类神经递质DA的含量 取血清500 μL于相应编号的离心管中,按1∶1(v/v)加入500 μL 5%高氯酸,涡旋混匀,离心(12 000 g,4℃)10 min后将上清液过滤放置于相应编号的样品瓶中,置于4℃待测。色谱条件:流动 相 0.1 mol/L KH2PO4∶甲 醇 =80∶20, Waters Symmetry色谱柱(150 mm×4.6 mm),柱温30℃,流速1 mL/min,激发波长280 nm,发射波长330 nm,进样量20 μL。
1.9.3 ELISA检测血清和中脑内DDC的含量 取血清和中脑组织,严格按照试剂盒说明书操作步骤,检测DDC的含量。
1.9.4 流式细胞术测定中脑内TH的表达率 取各组新鲜中脑组织加入PBS 1 mL,用小剪刀剪碎组织(约100次),用吸管吹匀(约50次),用吸管吸出上液于100目筛网上;滤液用300目滤网过滤到流式管,离心(1 140 r/min,5 min),去上清液,加入PBS 1 mL,离心,去上清液,再加入PBS 1 mL,重复上述操作1次,根据指标加入2 mL的PBS。
取单细胞悬液(1×106/mL)加入封闭液(含体积分数2%胎牛血清的PBS液)2 mL,摇匀后室温放置15 min,摇匀后均分到各个指定的指标管中。离心去上清液,加入固定剂A 100 μL,摇匀后室温固定15 min,加入1 mL封闭液洗1次。离心去上清液,加入破膜剂B 100 μL,一抗100 μL,摇匀后室温避光孵育30 min,PAB洗1次。离心去上清液,加入二抗100 μL,摇匀后避光孵育20 min,PBS洗1次,离心去上清液,加入10 g/L多聚甲醛1 mL固定,封口待测。
1.9.5 肝肾功能检测 取各组大鼠的血清,严格按照ELISA试剂盒说明书的操作步骤,对ALT、AST、Cr、BUN和总胆红素进行检测。
1.9.6 肝肾病理学检测 取各组大鼠的肝肾组织,脱水,进行苏木素—伊红(HE)染色,封片,在显微镜下进行病理学观察。
1.10统计方法采用SPSS 17.0统计软件进行数据分析,数据采用均数±标准差()表示,各组
别之间数据比较采用单因素方差分析(One-Way ANOVA)进行统计学检验,若方差齐性检验P>0.05,两两之间比较采用LSD,否则两两之间比较采用Dunnett's test,以P<0.05为差异有统计学意义。
2 结果
2.1行为学结果表1结果显示:与假手术组比较,模型组大鼠移动格子数、站立次数和转棒停留时间明显减少(P<0.05),中央格停留时间和右前肢启动时间明显增加(P<0.05),表明造模成功。与模型组比较,各治疗组移动格子数、站立次数和转棒停留时间均增加,中央格停留时间和右前肢启动时间明显减少,除β-细辛醚组移动格子数、站立次数,β-细辛醚+1/4美多芭组站立次数差异无统计学意义(P>0.05)外,各治疗组其余指标差异均有统计学意义(P<0.05)。与美多芭组比较,β-细辛醚+1/2美多芭组、β-细辛醚+美多芭组大鼠的移动格子数,β-细辛醚+美多芭组大鼠的中央格停留时间,β-细辛醚+1/4美多芭组、β-细辛醚+1/2美多芭组和β-细辛醚+美多芭组的大鼠站立次数转棒停留时间、右前肢启动时间差异均无统计学意义(P>0.05)。表明β-细辛醚联合小剂量美多芭对PD模型大鼠的行为异常有改善作用,且疗效与常规剂量美多芭疗效相当。
2.2 β-细辛醚联合美多芭对6-OHDA诱导的PD模型大鼠纹状体内神经递质的影响表2结果显示:与假手术组比较,模型组大鼠的DA、DOPAC和5-HT含量明显减少(P<0.05);与模型组比较,美多芭组、β-细辛醚+1/2美多芭组和β-细辛醚+美多芭组大鼠L-DOPA含量明显增加(P<0.05),美多芭组、β-细辛醚+1/4美多芭组、β-细辛醚+1/2美多芭组和β-细辛醚+美多芭组大鼠的DA和DOPAC含量明显增加(P<0.05),β-细辛醚+1/4美多芭组和β-细辛醚+1/2美多芭组大鼠的5-HT含量明显增加(P<0.05);与美多芭组大鼠比较,β-细辛醚+1/2美多芭组大鼠的L-DOPA含量,β-细辛醚组、β-细辛醚+1/4美多芭组和β-细辛醚+美多芭组大鼠的DA含量,β-细辛醚+1/4美多芭组、β-细辛醚+1/2美多芭组和β-细辛醚+美多芭组大鼠的DOPAC含量,β-细辛醚组、β-细辛醚+1/2美多芭组和β-细辛醚组+美多芭组大鼠的5-HT含量,β-细辛醚组、β-细辛醚+1/4美多芭组、β-细辛醚+1/2美多芭组和β-细辛醚+美多芭组大鼠的5-HIAA和HVA含量均无明显差异(P>0.05)。表明PD模型大鼠纹状体内神经递质含量减少,β-细辛醚联合不同剂量美多芭能够增加PD模型大鼠纹状体内神经递质含量,且β-细辛醚+1/2美多芭组与美多芭组纹状体内神经递质含量相当。
表1 行为学实验结果Table 1 .Results for behavioral tests ()

表1 行为学实验结果Table 1 .Results for behavioral tests ()
①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与美多芭组比较
组别假手术组模型组美多芭组β-细辛醚组β-细辛醚+1/4美多芭组β-细辛醚+1/2美多芭组β-细辛醚+美多芭组右前肢启动时间(t/s)5.3±1.2&15.9±4.5①6.2±1.7②8.6± 2.6②③6.6±2.2②6.5±1.8②6.8±2.0②N 10 10 10 10 10 10 10移动格子数(n/个)98.8±13.0 41.6±11.3①76.5±11.1②52.0±12.5③61.2± 13.1②③69.9±14.4②84.0±12.4②站立次数(n/次)17.8±4.2 4.6±1.6①8.6±2.7②5.3±1.8③6.6±2.4 7.4±2.2②10.2±3.0②中央格停留时间(t/s)1.9±0.7 7.7±2.0①2.5±1.0②5.2± 1.9②③5.2± 1.8②③4.5± 1.5②③1.8±0.8②转棒停留时间(t/s)40.8±9.8 11.5±2.8①22.1±4.1②17.5 ± 4.4②③17.6±3.3②19.1±4.3②19.2±3.1②
表2 各组纹状体中神经递质含量比较Table 2 Comparison of the contents of neurotransmitters in the striatum of various groups ()
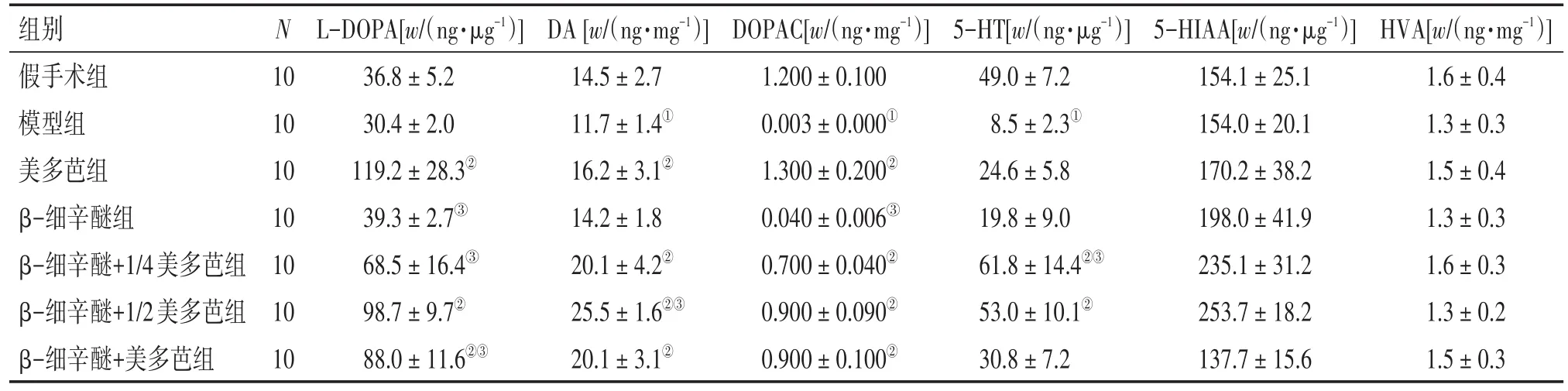
表2 各组纹状体中神经递质含量比较Table 2 Comparison of the contents of neurotransmitters in the striatum of various groups ()
①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与美多芭组比较
组别假手术组模型组美多芭组β-细辛醚组β-细辛醚+1/4美多芭组β-细辛醚+1/2美多芭组β-细辛醚+美多芭组HVA[w/(ng·mg-1)]1.6±0.4 1.3±0.3 1.5±0.4 1.3±0.3 1.6±0.3 1.3±0.2 1.5±0.3 N 10 10 10 10 10 10 10 L-DOPA[w/(ng·μg-1)]36.8±5.2 30.4±2.0 119.2±28.3②39.3±2.7③68.5±16.4③98.7±9.7②88.0± 11.6②③DA[w/(ng·mg-1)]14.5±2.7 11.7±1.4①16.2±3.1②14.2±1.8 20.1±4.2②25.5±1.6②③20.1±3.1②DOPAC[w/(ng·mg-1)]1.200±0.100 0.003±0.000①1.300±0.200②0.040±0.006③0.700±0.040②0.900±0.090②0.900±0.100②5-HT[w/(ng·μg-1)]49.0±7.2 8.5±2.3①24.6±5.8 19.8±9.0 61.8±14.4②③53.0±10.1②30.8±7.2 5-HIAA[w/(ng·μg-1)]154.1±25.1 154.0±20.1 170.2±38.2 198.0±41.9 235.1±31.2 253.7±18.2 137.7±15.6
2.3 β-细辛醚联合美多芭对6-OHDA诱导的PD模型大鼠血清中神经递质的影响表3结果显示:与假手术组比较,模型组大鼠DA含量无明显差异(P>0.05);与模型组比较,美多芭组、β-细辛醚+1/2美多芭组及β-细辛醚+美多芭组大鼠DA含量明显增高(P<0.05);与美多芭组比较,β-细辛醚+1/4美多芭组、β-细辛醚+1/2美多芭组、β-细辛醚+美多芭组大鼠的DA含量差异无统计学意义(P>0.05)。表明β-细辛醚联合使用减少剂量的美多芭后,对血清DA含量无明显影响。
2.4 β-细辛醚联合美多芭对6-OHDA诱导的PD模型大鼠相关酶的影响表4结果显示:与假手术组比较,模型组大鼠中脑酪氨酸羟化酶(TH)表达率明显下降(P<0.05);与模型组比较,美多芭组和β-细辛醚+1/2美多芭组大鼠的TH表达率明显增高(P<0.05)。表明PD模型TH减少,美多芭和β-细辛醚+1/2美多芭均能够升高中脑TH的含量。
表3 各组血清DA含量比较Table 3 Comparison of the serum content of DA in various groups ()

表3 各组血清DA含量比较Table 3 Comparison of the serum content of DA in various groups ()
①P<0.05,与模型组比较;②P<0.05,与美多芭组比较
组别假手术组模型组美多芭组β-细辛醚组β-细辛醚+1/4美多芭组β-细辛醚+1/2美多芭组β-细辛醚+美多芭组DA[ρ/(μg·mL-1)]129.04±41.68 152.61±44.73 296.06±43.22①169.70±42.03②209.83±68.15 289.90±55.45①273.43±51.40①N 10 10 10 10 10 10 10
与假手术组比较,模型组血清中DDC含量无明显变化(P>0.05);与模型组比较,美多芭组、β-细辛醚、β-细辛醚+1/4美多芭组、β-细辛醚+1/2美多芭组和β-细辛醚+美多芭组的大鼠的血清中DDC的含量明显下降(P<0.05)。表明美多芭、β-细辛醚、β-细辛醚+1/4美多芭、β-细辛醚+1/2美多芭和β-细辛醚+美多芭均能够抑制血清DDC含量。
各组中脑内DDC含量比较,差异均无统计学意义(P>0.05)。表明PD大鼠中脑DDC无明显变化,美多芭、β-细辛醚单独用药或联合用药治疗亦对中脑DDC无明显影响。
2.5 β-细辛醚联合美多芭对6-OHDA诱导的PD模型大鼠肝肾功能的影响表5结果显示:与假手术组比较,模型组大鼠的ALT、AST、Cr、BUN和TBIL的含量无明显差异(P>0.05)。与模型组比较,美多芭组、β-细辛醚+1/2美多芭组和β-细辛醚+美多芭组大鼠的ALT和BUN含量明显增加(P<0.05),美多芭组、β-细辛醚+1/4美多芭组、β-细辛醚+1/2美多芭组、β-细辛醚+美多芭组大鼠CR含量明显增加(P<0.05),各治疗组AST、TBIL无明显差异(P>0.05)。表明PD模型肝肾功能无损害,应用美多芭后,肝肾功能指标明显升高。
表4 各组中脑TH表达率,血清、中脑内DDC含量比较Table 4 Comparison of the expression rate of DDC in the mesocerebrum and the content of DDC in the serum and mesocerebrum of various groups ()

表4 各组中脑TH表达率,血清、中脑内DDC含量比较Table 4 Comparison of the expression rate of DDC in the mesocerebrum and the content of DDC in the serum and mesocerebrum of various groups ()
①P<0.05,与假手术组比较;②P<0.05,与模型组比较
组别假手术组模型组美多芭组β-细辛醚组β-细辛醚+1/4美多芭组β-细辛醚+1/2美多芭组β-细辛醚+美多芭组DDC中脑[w/(ng·g-1)]5.1±1.5 4.0±1.1 4.1±2.0 5.5±2.7 4.3±1.7 3.4±2.0 3.4±1.6 N 10 10 10 10 10 10 10中脑TH表达率(p/%)10.4±1.7 7.5±1.9①9.0±0.8②8.9±1.6 8.5±2.6 10.5±2.6②7.0±1.5血清[ρ/(ng·mL-1)]13.9±2.5 12.7±2.5 7.5±1.1②9.4±1.0②9.7±3.0②9.5±1.1②8.1±0.9②
2.6 β-细辛醚联合美多芭对6-OHDA诱导的PD模型大鼠肝肾病理变化的影响图1结果显示:假手术组、模型组和β-细辛醚组大鼠的肝组织结构正常,肝细胞排列整齐,边界清晰,形态完整,未见脂肪空泡,汇管区未见炎性细胞浸润。肾皮质和髓质结构清晰,肾小球未见增生或萎缩、毛细血管袢未见坏死,肾小球毛细血管未见扩张充血、管壁未见增厚,肾间质未见炎细胞浸润。美多芭组的大鼠的肝组织汇管区较多炎细胞浸润。肾间质小片状炎性细胞浸润。联合用药组大鼠的肝组织结构正常,肝细胞排列整齐,边界清晰,形态完整,未见脂肪空泡,汇管区可见不同程度炎细胞浸润,且以β-细辛醚+1/4美多芭组大鼠的汇管区炎性细胞最少。β-细辛醚+美多芭组大鼠的肾间质内小灶状炎性细胞浸润,β-细辛醚+1/2美多芭组大鼠的肾间质内炎细胞逐渐减少,β-细辛醚+1/4美多芭组大鼠的肾间质内炎性细胞最少。
表5 各组肝肾功能比较Table 5 Comparison of the hepatic-renal function in various groups ()

表5 各组肝肾功能比较Table 5 Comparison of the hepatic-renal function in various groups ()
①P<0.05,与模型组比较
组别假手术组模型组美多芭组β-细辛醚组β-细辛醚+1/4美多芭组β-细辛醚+1/2美多芭组β-细辛醚+美多芭组TBIL[c/(μmol·L-1)]4.2±1.0 4.0±1.3 3.7±1.9 4.5±1.8 4.8±1.5 3.9±1.2 4.0±1.6 N 10 10 10 10 10 10 10 ALT[J/(U·L-1)]11.3±3.0 10.6±2.5 17.4±4.3①10.8±3.1 12.3±1.5 14.8±2.2①18.5±2.2①AST[J/(U·L-1)]13.9±3.1 14.7±3.5 13.4±3.8 14.2±4.2 12.7±4.5 14.4±4.5 15.6±4.3 Cr[c/(μmol·L-1)]17.5±3.3 22.0±6.6 43.5±10.2①23.6±4.8 29.1±5.8①36.6±7.3①42.7±6.3①BUN[c/(mmol·L-1)]61.7±12.7 65.0±16.1 100.0±30.2①70.0±5.6 79.6±21.5 93.5±18.1①100.4±20.1①
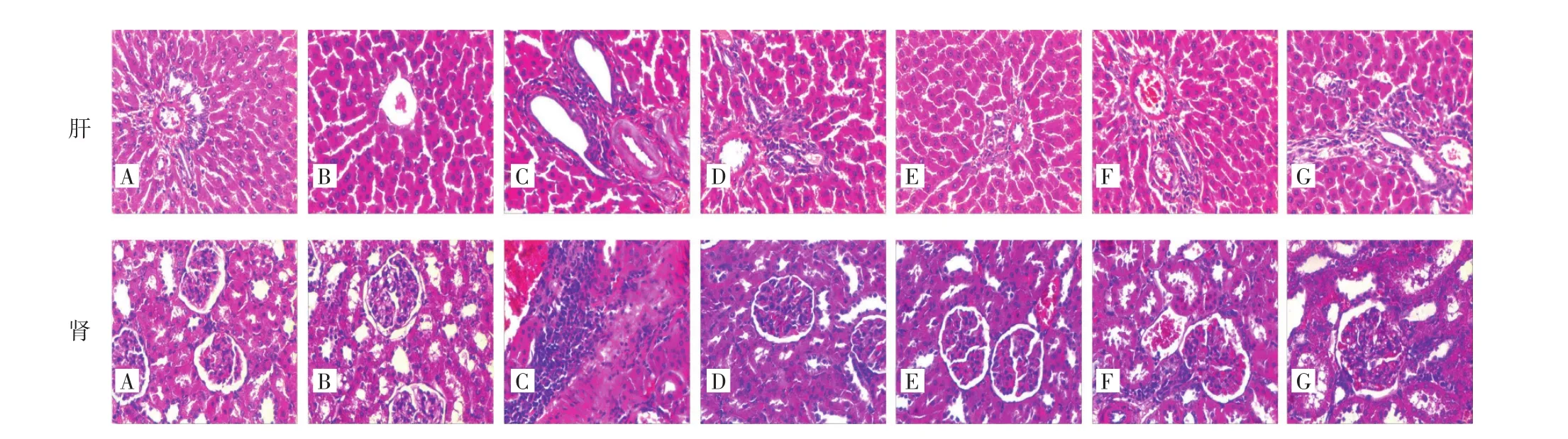
图1 各组肝肾组织病理变化比较(n=3,HE染色,×200)Figure 1 Comparison of the pathological changes of liver and kidney tissues in vaious groups(n=3,by HE staining,×200)
3 讨论
PD属于中医学的颤证,亦称“颤振”、“振掉”、“震颤”等,是神经系统退行性疾病。病理特征为多巴胺能神经元减少及神经元内路易小体的形成。临床症状主要表现为静止性震颤、运动迟缓、肌肉僵直及姿势步态异常等。美多芭是临床上治疗PD的常用药物,能够有效改善PD的临床症状,但随着应用时间的延长,多会出现疗效减低和不随意运动等副作用。本研究观察β-细辛醚联合美多芭对6-OHDA诱导的PD模型大鼠的行为学、DA等神经递质、促进DA合成的相关酶及肝肾功能和组织病理学的影响,结果显示β-细辛醚联合1/2或1/4剂量美多芭,疗效与单独使用美多芭相当,可减轻血清肝肾功能和肝肾病理的损害,从而达到减少美多芭的使用剂量的目的,这样可以延长美多芭的应用时间,减轻美多芭引起的肝肾功能损害。
本研究观察到β-细辛醚联合小剂量美多芭能够改善6-OHDA诱导的PD模型大鼠的自主运动功能、平衡能力与协调性及感觉运动整合功能,减轻肝肾功能损害。这与我们的前期研究结果一致,β-细辛醚能够明显改善PD模型大鼠的自主活动次数、滚轴运动能力,使PD模型大鼠平衡能力明显增高[12];联合L-DOPA能够改善PD模型大鼠的行为学,并能够减少肝肾功能损害[9]。说明β-细辛醚联合小剂量美多芭的疗效与单独使用常规剂量的美多芭疗效相当。
DA是脑内的一种神经递质,PD患者的黑质纹状体中DA的含量不足导致PD的运动障碍。L-DOPA是合成DA的中间产物,是DA的前体,在L-DOPA转化为DA的限速酶DDC的作用下生成DA。L-DOPA可以通过血脑屏障,而DA本身则不能,因此L-DOPA被用作治疗PD的药物来增加DA的水平。L-DOPA在脑外以及大脑组织中发生快速脱羧反应生成DA,使得大多数L-DOPA不能到达脑内,而外周产生的DA常会引起不良反应。因此,抑制脑外组织中L-DOPA的脱羧反应是十分必要的。L-DOPA与外周脱羧酶抑制剂苄丝肼同时给药即可达到这一目的。美多芭是L-DOPA与苄丝肼按4∶1制成的复方制剂,在临床试验和治疗应用中已证明这一比例具有最佳疗效,与单独给予大剂量L-DOPA的效果相当。本实验结果观察到:联合用药可以增加纹状体内L-DOPA、DA、DOPAC和5-HT的含量,增加血清内DA的含量,同时抑制血清中的DDC。β-细辛醚可能通过抑制血清DDC,从而减少L-DOPA在脑外脱羧转化为DA,这能够减轻L-DOPA在脑外转化为DA所产生的副作用,并提高脑内DA的含量。
TH是酪氨酸转化为L-DOPA的限速酶,本实验结果观察到:美多芭组和β-细辛醚+1/2美多芭组的大鼠的TH的表达率明显增高。这一结果表明,联合用药能够增加脑内L-DOPA的生成量,有利于DA的生成。
本研究观察到应用美多芭后,肝肾功能血液及病理变化指标比没有应用美多芭组有明显升高,说明美多芭对肝肾功能有影响。故减少美多芭的使用剂量,可以减轻美多芭引起的肝肾功能损害。
综上所述,β-细辛醚联合低剂量美多芭,疗效与单独使用美多芭相当,且可减轻对肝肾功能和肝肾病理的损害,从而达到减少美多芭的使用剂量的目的,这样可以延长美多芭的应用时间,减轻美多芭引起的肝肾功能损害。其原因可能是通过提高脑组织内TH含量,抑制血清内DDC的含量来增加脑组织内单胺类神经递质的含量。本研究为临床治疗PD提供了新的思路。
