丙烯酰胺改性果胶-Fe3O4磁性微球的制备及对水和海产品中Cu2+的吸附性能
2019-05-18马占玲李宁宁万俊菲贲楚璇励建荣
陈 思 马占玲 李宁宁 万俊菲 贲楚璇 励建荣
(渤海大学化学化工与食品安全学院 辽宁省食品安全重点实验室 辽宁锦州121013)
铜是人体必需的微量元素,同其它重金属一样,过量的铜对人体有潜在的毒性。例如,持续吸入含铜喷雾剂,增加了工人们罹患肺癌的几率[1]。也有研究表明,铜容易使β-淀粉蛋白团聚,在患者的大脑中产生氧化强压,是导致Alzheimer 综合的主要元凶[2]。近年来,重金属污染情况日益严重,随着含有重金属的废水的排放,其中所含的重金属以不同形式进入水体、土壤和大气中,并通过食物链进入水生动物、植物,进而对人类造成严重的危害[3],尤其是在贝类等水产品中铜超标的现象屡见不鲜[4-8]。研究去除废水中的铜2+和海产品中超量铜具有深远的意义。
果胶是一类具有共同特性的寡糖和多聚糖的混合物,其主要成分是D-半乳糖醛酸,还含有部分中性糖组分,如鼠李糖、阿拉伯糖和半乳糖等[9]。其含有大量的-OH 基,对金属离子具有螯合作用,可以去除水溶液中金属离子,尤其是果胶结合磁性材料后具有高吸附性,具有良好分离特性等特性,是一种经济绿色型的重金属吸附剂。近年来,关于果胶-Fe3O4微球作为吸附剂已有报道[10-14],然而,有关改性果胶磁性微球的研究不多。本文基于半乳糖醛酸的C2或C3可被乙酰化,以硫酸铈铵为引发剂,将丙烯酰胺在果胶上进行接枝反应,用氯化钙进行胶联,合成果胶磁性微球,并将此材料用于吸附水和海产品中铜。与单纯果胶-Fe3O4磁性微球对比,增加了-C=O 基和-NH2,提高了对水中铜的单位吸附量,效果良好。
1 试验部分
1.1 试验试剂和仪器
试剂:氯化铁,氯化亚铁,无水碳酸钠,氯化钙,十二烷基苯磺酸钠,丙烯酰胺,硫酸铈铵,低酯果胶,以上试剂均为分析纯,国药集团化学试剂有限公司。
仪器:AA320N 原子吸收分光光度计,上海精密科学仪器有限公司;Rigaku Ultima IV 型X 射线粉末衍射仪,日本理学公司;S4800 冷场发射扫描电子显微镜,日本日立公司;超声波清洗器(SK6210HP),上海科导超声仪器有限公司;Scimitar 2000 Near FT-IR Spectrometer 傅里叶变换红外光谱仪,美国安捷伦公司;pH 计(FE20K),上海梅特勒-托利仪器有限公司。
海产品:鲜海螺、香螺,购于锦州市林西路海鲜批发市场。
1.2 改性果胶磁性微球的制备
采用化学共沉淀法[17]制备纳米Fe3O4。称取适量的FeCl3·6H2O 和FeCl2·6H2O 以2 ∶1 的比例分别溶于超纯水,并分别置于磁力搅拌器上60 ℃加热搅拌使其充分溶解。将溶解好的二价铁盐和三价铁盐溶液同时倒入通N2的250 mL 三颈烧瓶中,65 ℃水浴加热30 min 后,加入一定量的氨水,高速搅拌进行沉淀,然后将沉淀洗涤、磁分离、干燥、烘干,研磨,制得Fe3O4磁性颗粒。另取一定量果胶加入NaOH 溶液,并用磁力搅拌器于50 ℃下快速搅拌使其充分溶解,皂化1 h 后,加入一定量丙烯酰胺和3.5 mmol/L 硫酸铈铵溶液,加热改性反应30 min。
取上述制备好的一定量的纳米Fe3O4颗粒置于超纯水中并用超声波进行分散20 min。将分散好的纳米Fe3O4颗粒与上述改性果胶溶液混合,在40~50 ℃的水浴中缓慢滴加0.4 mol/L 的CaCl2溶液15 mL,加入少量十二烷基苯磺酸钠(SDBC)和无水碳酸钠,再用超声波分散30 min,再于磁力搅拌器上40~60 ℃加热反应4 h。冷却至室温,用超纯水洗涤数次,磁分离,于50 ℃真空干燥,研磨成粉。
1.3 试验方法
1.3.1 吸附水溶液中铜试验 在一系列50 mL 的离心管中,分别加入一定量的改性果胶磁性微球和10 mL 一定初始浓度、初始pH 的铜溶液,在一定温度下以一定转速振荡规定时间。过滤,取上清液,并测定其残留铜离子浓度。按式(1)计算Cu2+的去除率,按式(2)计算Cu2+离子的吸附量(mg/g)。
M=1 000(C0-C)V/m
式中,M——单位吸附量(mg/g);C0,C 分别为Cu2+的初始质量浓度和平衡质量浓度(mg/L);V——Cu2+溶液体积(L);m——改性果胶-Fe3O4磁性微球的质量(g)
1.3.2 去除海产品中铜试验 称取50 g 研碎的新鲜海鲜,去壳,洗净,用高速均质搅拌机搅拌,调节溶液pH 为2,加胃蛋白酶3 g,定容到250 mL。酶解液过滤取滤液,放置冰箱。取一定量酶解液于离心管中,加入制备的改性果胶磁性微球,在适当条件下吸附,用磁铁分离转移出上清液。将未经吸附和吸附之后酶解液消化处理后测其Cu2+离子浓度,计算Cu2+去除率。
2 结果与讨论
2.1 表征
2.1.1 改性果胶磁性微球吸附剂的红外光谱分析改性果胶磁性微球吸附剂的红外光谱分析,结果见图1。图1中a,b,c 分别是Fe3O4,果胶四氧化三铁磁性微粒,丙烯酰胺改性的果胶四氧化三铁磁性微粒的红外光谱图。其中a 中的571 cm-1处为Fe3O4的特征吸收峰,是由Fe3O4中Fe-O-Fe 的伸缩振动产生的,3 453 cm-1处的宽峰是四氧化三铁表面的-OH 伸缩振动峰。果胶-四氧化三铁微球图谱b 中,游离果胶中的酯键(-COOR)中C=O 基伸缩振动峰消失,这是由于-COO-与Ca2+交联生成-COO-Ca,从而出现了1 631 cm-1羧酸盐中离子化的羧基(-COO-)的不对称伸缩振动峰,1 393 cm-1可能为离子化的羧基(-COO-)的对称伸缩振动,1 080 cm-1是C-O 的伸缩振动峰。丙烯酰胺改性后的果胶磁性颗粒光谱图c 中与纯果胶磁性微球对比,1 619 cm-1处的吸收峰明显增强、变宽,这是由于丙烯酰胺中的C=O 与N 原子的共轭作用,以及与缔合状态的酰胺中N-H 基团的面内摇摆吸收峰的重合所产生的宽带强吸收峰,这是CONH2特征吸收峰。同时酰胺中的C-N 的反对称伸缩振动应该在1 400 cm-1,所以谱图中1 405 cm-1处吸收峰仍然存在,且加强,1 080 cm-1,889 cm-1出现C-O-C 和C-O 的特征吸收峰来自果胶,从而说明二者发生了接枝共聚。
2.1.2 物相分析——X-射线衍射 (XRD)图2中a 是Fe3O4纳米粒子的XRD 图,b 是丙烯酰胺改性果胶-Fe3O4磁性微球的XRD 图。由图2可以看出,二者衍射峰的峰2θ 角都出现在30.24°,35.44°,43.21°,53.60°,57.13°,62.58°处,基本没有发生变化,说明改性果胶包覆Fe3O4的过程中并没有改变Fe3O4纳米粒子的尖晶石结构。
2.1.3 扫描电镜(SEM)测试 图3为丙烯酰胺改性的磁性果胶颗粒。由图可见磁性离子粒子呈不规则形状分散状态存在,平均粒径为3.2 μm。
2.2 丙烯酰胺改性果胶磁性微球对吸附Cu2+的试验条件探究
2.2.1 吸附剂用量的影响 室温下,分别称取不同量的改性果胶磁性微球加入到10 mL 100 μg/mL 的Cu2+溶液中,振荡吸附2 h 后,取上清液测量Cu2+的残留浓度,计算改性磁性果胶颗粒的单位吸附量和去除率,试验结果见图4,由图可知,随着果胶磁性微球用量的增加,铜离子的吸附量呈下降趋势,在20 mg 的位置,吸附剂的单位吸附量达到42.8 mg/g,120 mg 时,降为8.6 mg/g,这是因为增加了果胶磁性微球的用量,能增添吸附剂的吸附点位,铜离子浓度相同时,吸附剂的单位吸附量会降低。铜离子的去除率在吸附剂的添加量为20~30 mg,去除率呈上升趋势,30 mg 后去除率缓慢增加,当吸附剂用量为50 mg 时,铜离子已被吸附完全,去除率达到99.2%,吸附剂的用量确定为30 mg。
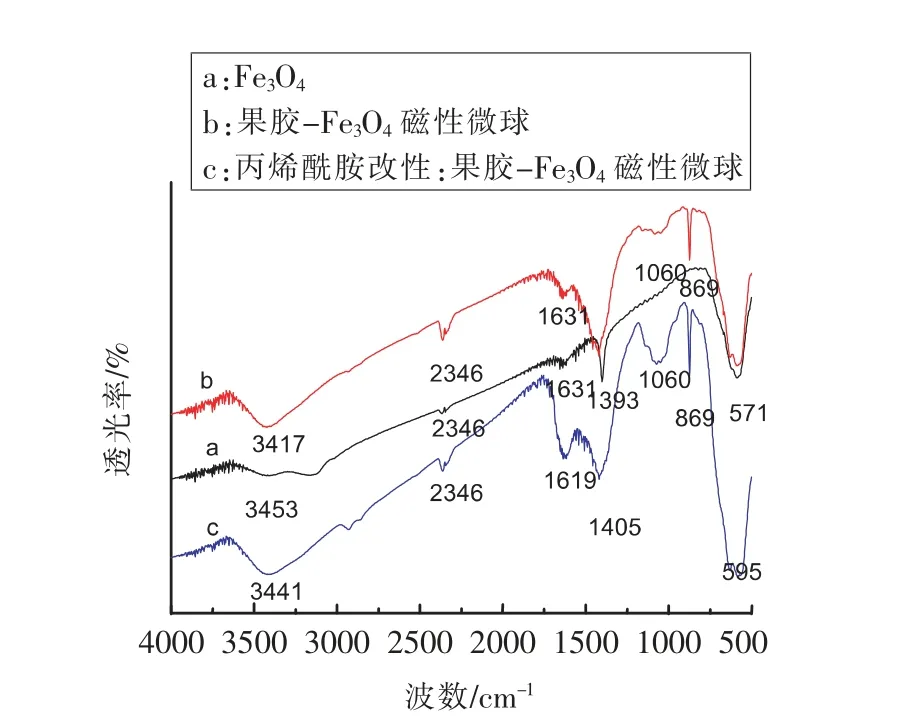
图1 果胶磁性微球和改性果胶磁性微球红外光谱图Fig.1 FT-IR spectrum of pectin-Fe3O4 and modified pectin-Fe3O4

图2 Fe3O4 和改性果胶磁性微球的XRD 谱图Fig.2 The XRD patterns of Fe3O4 and modified pectin-Fe3O4

图3 改性磁性果胶微球的SEM 图Fig.3 The SEM of the modified pectin-Fe3O4

图4 吸附剂用量对改性果胶磁性微球吸附剂吸附Cu2+的影响Fig.4 Effect of amount of adsorbent on the adsorption of Cu2+
2.2.2 时间的影响 取10 mL 100 μg/mL 的Cu2+溶液,加入20 mg 吸附剂,进行振荡吸附,考查时间对Cu2+去除率和吸附剂吸附量的影响,结果见图5。由图可见,在0~5 h 内,去除率和单位吸附量都随时间的延长而上升,5 h 后变化缓慢,基本达到吸附平衡,到5 h 时铜离子的去除率已达到94%,单位吸附量达到48 mg/g。5~66 h,二者均呈缓慢上升趋势。到66 h 时,吸附剂的单位吸附量达到53 mg/g,去除率达到98.6%。综合考虑吸附时间选择3 h。
2.2.3 pH 的影响 其它条件固定,考查pH 对铜离子的去除率和吸附剂吸附量的影响,结果见图6。由图6可见在pH 为1~6 范围内,随着pH 的增加,铜离子的去除率和吸附剂的单位吸附量呈上升趋势,pH 在6~9 范围内,二者略有下降。根据氢氧化铜的溶度积可知,100 μg/mL 的Cu2+溶液的铜离子溶液在pH 为4 时开始生成氢氧化铜沉淀,所以本试验的pH 控制在4。
2.2.4 温度的影响 其它条件固定,改变温度,考察吸附温度对去除率和吸附量的影响,由图7可见,在10~30 ℃范围内,去除率和吸附量均变化不大,30~80 ℃范围内,二者均呈缓慢上升趋势。综合考虑温度选为25 ℃。
2.2.5 Cu2+初始质量浓度的影响 在其他条件相同的前提下,考查Cu2+初始质量浓度对铜离子的去除率和吸附剂吸附量的影响,结果见图8,从图8中可以看出果胶磁性微球对Cu2+的吸附随着初始质量浓度增加,吸附量也逐渐增加,当Cu2+的质量浓度为500 mg/mL 时,果胶磁性微球的吸附量可达105 mg/g。但随着Cu2+初始质量浓度的增加,果胶磁性微球对Cu2+的去除率先逐渐降低,后又缓慢上升。
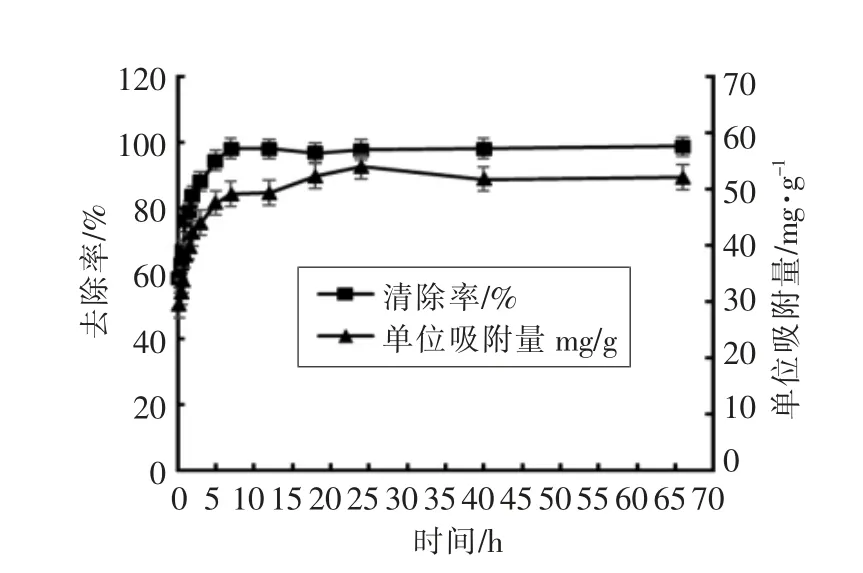
图5 吸附时间对改性果胶磁性微球吸附剂吸附Cu2+的影响Fig.5 Effect of adsorption time on the adsorption of Cu2+

图6 pH 对改性果胶磁性微球吸附剂吸附Cu2+的影响Fig.6 Effect of pH on the adsorption of Cu2+

图7 温度对改性果胶磁性微球吸附剂吸附Cu2+的影响Fig.7 Effect of temperature on the adsorption of Cu2+
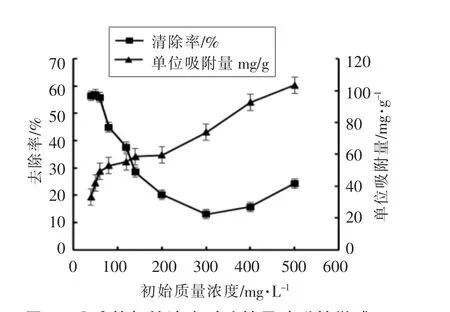
图8 Cu2+的初始浓度对改性果胶磁性微球吸附剂吸附Cu2+的影响Fig.8 Effect of different concentrations of Cu2+solution on the adsorption of Cu2+
2.3 样品的测定
首先,将香螺、海螺和黄蚬子去皮取肉,经消解处理后直接测其铜元素的含量。然后再分别取一定量的肉,按1.3.2 节的方法进行酶解处理后,3种酶解液各取10 mL,分解加入30 mg 改性果胶磁性微球,在室温下,振荡吸附3 h,测其吸附前后铜离子的浓度,计算去除率,试验结果见表1。
由试验结果可见,3 种海产品的香螺中铜含量最高,达到90.1 g/mg,其次是海螺,铜含量为54.5 g/mg,黄蚬子中最低。其中香螺和海螺中铜的含量均超过国家标准50 g/mg。三者的酶解液,经吸附剂吸附后,铜离子的含量都明显下降,去除率分别为79%,80.4%和81.4%,效果良好。

表1 样品中Cu2+的去除率Table 1 The removal rate of Cu2+ in samples
3 结论
以过硫酸铵为引发剂,丙烯酰胺在果胶上进行接枝反应后,用氯化钙进行胶联,合成果胶磁性微球,分别用红外光谱、扫描电镜、X-射线粉末衍射对吸附剂进行表征,结果表明制备的丙烯酰胺改性果胶性微球中Fe3O4为尖晶石结构,磁性微球的平均粒径约为3.2 μm。并将此材料用于吸附水和海产品中铜,吸附剂的吸附量在Cu2+的质量浓度为500 mg/mL 时,可达105 mg/g,效果良好。这是因为丙烯酰胺与果胶上的羟基接枝后,微球上增加了大量的-NH2基C=O 基,有利于与Cu2+络合,因此吸附剂的单位吸附量增加。氯化钙在合成磁性微球时起着胶联作用,这是由于Ca2+能与果胶羧基结合形成网络结构,产生桥联作用,有利于果胶分子的有序结合,使黏度增加,从而使果胶和Fe3O4磁性微球较好地胶联在一起。同时对香螺、海螺和黄蚬子的酶解液进行了去除试验,去除率均在80%左右,效果良好。
