氮源对蚜虫拟酵母生物合成新型乳化剂
——甘露糖赤藓糖醇脂的影响
2019-05-18牛永武吴嘉南陈启和
牛永武 吴嘉南 顾 頔 陈启和
(浙江大学食品科学与营养系 杭州310058)
甘露糖赤藓糖醇脂(Mannosylerythritol lipids,MELs)是一种糖脂类生物表面活性剂,主要由霉菌和酵母发酵获得。MELs 的结构主要以4-O-β-D-吡喃甘露糖-内消旋-赤藓糖醇为亲水基部分,以脂肪链或糖基上的乙酰基为疏水部分,根据乙酰基的数量和位置,分为A、B、C、D 4 个构型[1-2],见图1。在上个世纪50年代被发现[3],自90年代以来受到越来越多的研究者关注。目前,MELs 相关报道集中于表面活性有良好的乳化性,生物降解性,较低的临界胶束浓度等[4],还具有特殊的生理学活性,如抑制微生物生长[5-6],诱导细胞变异[7-9],提高基因转染效率[10-11],与糖蛋白有较强的配位能力[12]等,在石油化工、化妆品、医药[13]等方面具有广泛应用价值。
在国内,相对于鼠李糖脂、槐糖脂而言,围绕MELs 的研究和关注较少。而国内外用于发酵合成MELs 的主要有南极假丝酵母 (Candida antarctica)、玉米黑粉菌(Ustilago maydis)、南极拟 酵母(Pseudozyma rantarctica)、蚜虫拟酵母(Pseudozyma aphidis)等菌株。大量研究发现,培养基中氮源是否充足对微生物合成MELs 有显著影响,在氮源限制条件下,玉米黑粉菌、蚜虫拟酵母和湖北拟酵母(Pseudozyma hubeiensis)能够 合成MELs 和纤维二糖脂(CLs)两种糖脂[14]。目前有关氮源种类的研究较少。Rau 等[15]对发酵液中的氮源、碳源和碳氮比进行初步研究,然而未涉及有机氮源。本文主要对比不同种类氮源对MELs 产量的影响,对选出的较优氮源进行复配,获得合适的复配比例和添加量,探究氮源对产物的表面活性的影响。
1 试验方法
1.1 菌株、试剂及材料
蚜虫拟酵母,购于德国菌种保藏中心。
乙酸乙酯、甲醇、氯仿,均为分析纯;大豆油,金龙鱼精炼一级,上海嘉里食品工业有限公司;考马斯亮蓝染液、牛血清蛋白等。

图1 MELs 的化学结构Fig.1 Structure of MELs
LHR-250 生化培养箱,上海一恒科学仪器有限公司;HYG-II 回转式恒温调速摇床,上海新蕊自动化设备有限公司;旋转蒸发仪,RV8-HB10,IKA;SP-756 紫外分光光度计,上海光谱;Thermo酶标仪,美国;全自动表面张力仪,QBZY-2,上海方瑞仪器有限公司。
1.2 培养基及培养方法
活化培养基(g/L):酵母提取物3.0,麦芽汁提取物3.0,葡萄糖10.0,蛋白胨5.0。
液体种子培养基 (g/L):NaNO33.0,MgSO4·7H2O 0.30,KH2PO40.30,酵母提取粉1.0,葡萄糖40.0。
发酵培养基(g/L):大豆油80.0 mL/L,MgSO4·7H2O 0.30,KH2PO40.30,氮源种类和添加量根据试验设计进行,大豆油单独灭菌,无菌环境中添加。
以上3 种培养基pH 值均未经调节,配制后均按50 mL/瓶(250 mL 锥形瓶)分装,115 ℃灭菌20 min。
将保藏的菌种转接于活化培养基中,28 ℃、180 r/min 条件下培养1.5 d,然后将其转接至种子培养基中,相同条件下培养2 d。培养好的种子液离心,获得菌体,并用0.9%的无菌氯化钠溶液洗涤2~3 次。按菌体湿重计,用生理盐水溶解为0.12 g/mL 的接种液,按照2%(V/V)的接种量进行接种,于28 ℃、180 r/min 条件下培养8 d。
1.3 试验设计
1.3.1 不同氮源对蚜虫拟酵母合成MELs 的影响选取NaNO3、酵母提取粉(Yeast Extract,YE)、(NH4)2SO4、NH4NO34 种氮源,以4.0 g/L 的量在组1、组2、组3、组4 中分别加入NaNO3、酵母提取粉、(NH4)2SO4和NH4NO3,每组设计3 个平行。发酵结束后,观察发酵现象,测定MELs 产量、生物量、pH 等指标,选取较优氮源进行复配发酵。
1.3.2 优质氮源复配对合成MELs 的影响 根据1.3.1 节中的结果,选取发酵效果好的2 种氮源进行复配,本实验室已有研究表明蚜虫拟酵母发酵第4~7 天时大量合成MELs,故选取发酵第3,4,5、5.5,6、6.5,7,8 天为取样时间点,每个时间点每组取3 个平行样品,测定发酵液中生物量、产物产量、pH、发酵液还原糖浓度和胞外蛋白浓度,同时观察发酵过程中发酵液状态的变化。
1.4 pH、MELs 产量及生物量的测定
发酵结束后,测定发酵液的pH。随后加入等体积的乙酸乙酯(约50 mL),充分振荡萃取,装入50 mL 离心管,3 000 r/min 离心5 min,乙酸乙酯层移至平底烧瓶中进行旋蒸(45~60 ℃,3 000 Pa),获得含有部分油脂的粗产物,将其溶解至15.00 mL甲醇中,振荡混匀,3 000 r/min 离心5 min,取出甲醇层旋蒸获得纯化后的MELs 粗产物,称量并计算产物产量。离心后的菌体取出,用去离子水洗涤2~3 遍,60 ℃烘干至恒重,称量并计算生物量。
1.5 发酵液中蛋白浓度的测定
采用Bradford 蛋白质定量试剂盒法[16]。取考马斯亮蓝染液平衡至室温混匀,预热分光光度计;将0,1,2,3,4,5,6 μL 牛血清蛋白(BSA)标准溶液(1.00 mg/mL)分别加入酶标板,加PBS(pH:7.4~7.6)补足至10 μL;加Bradford 考马斯亮蓝染液190 μL,混匀,室温放置5~10 min,以PBS(pH:7.4~7.6)做为空白对照,在595 nm 下,测定吸光值;以蛋白质质量浓度(g/L)为横坐标x,吸光度为纵坐标y,绘制标准曲线,函数关系为:y=1.1011x(R2=0.9934)。样品测定中,取10 μL 发酵液上清液和190 μL 考马斯亮蓝染液混匀,室温放置5~10 min,用酶标仪测定595 nm 下的吸光值,根据标准曲线计算出发酵液中蛋白含量。
1.6 发酵液中还原糖浓度的测定
采用DNS 法测定还原糖浓度。配制质量浓度为1.000 g/L 的葡萄糖标准溶液;用移液枪分别准确吸取0.08,0.16,0.32,0.64 mL 葡萄糖标准溶液置于6 支10.00 mL 比色管中,并补水至0.80 mL,加0.60 mL DNS 溶液,摇匀;沸水浴5 min 后,取出,冷却至室温,用去离子水稀释至10 mL,取200 μL 于96 孔板,用酶标仪测定波长520 nm 处的吸光度,以葡萄糖含量(mg)为横坐标x,吸光度为纵坐标y,绘制标准曲线,函数关系为:y=0.8558x(R2=0.9932)。
取发酵液上清0.08 mL 样品,测定方法同上,根据标准曲线计算0.08 mL 发酵液中还原糖含量x,发酵液中还原糖浓度C=x/0.08。
1.7 测定临界胶束浓度 (Critical micelle concentration,CMC)
临界胶束浓度是衡量表面活性剂的一个重要定量指标,对于实际应用具有指导意义。取甲醇-环己烷分离纯化后的样品0.10 g,溶于100.00 mL去离子水中,配制成质量浓度1.00 g/L 的原液;用去离子水稀释50,60,70,80,90,100,120,150 倍,
获得不同浓度的MELs 溶液(见表1)。
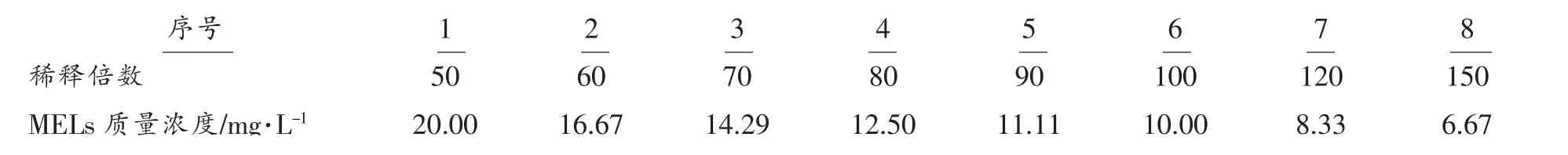
表1 MELs 系列梯度溶液配制Table 1 The preparation of a series of concentrations of MELs solution
在25 ℃条件下,采用铂金板法[17]测定各溶液的表面张力,每个样品重复测定3 次。然后将表面张力对溶液浓度做曲线,拐点对应的浓度即为样品的临界胶束浓度。
2 结果与分析
氮源是微生物生长所需的营养要素之一,不同氮源对于微生物的生长代谢具有明显影响。氮源主要分为有机氮源和无机氮源,有机氮源中选取酵母提取粉,无机氮源主要存在形式为NO3-和NH4+两种形式,试验中选择了含有硝酸根离子的NaNO3、含有铵根离子的(NH4)2SO4以 及NH4NO3做为研究的氮源,其中NaNO3属于生理性碱性物质,(NH4)2SO4属于生理性酸性物质。
2.1 不同氮源对蚜虫拟酵母代谢合成MELs 的影响
在其他成分相同的条件下,组1、组2、组3、组4 分别加入等质量的不同氮源物质,发酵8 d后,观察发酵现象,见图2,测定pH、MELs 产量和生物量,见表2。从图2可以看出,组1 发酵液显暗黄色,表面有油花;组2 菌体生长较多,发酵液略显土黄色,表面漂浮不均匀浅绿色油滴状物质;组3 菌体生长少,发酵液颜色呈白色,大量大豆油漂浮在表面;组4 发酵液呈现类似浑浊石灰水的颜色,菌体生长少,成片的大豆油漂浮在液面上层。表2中的结果显示,4 种所选氮源中,添加NaNO3做为氮源,合成MELs 产量最高;而添加酵母提取粉时,生物量最大;(NH4)2SO4和NH4NO3为唯一氮源时,pH 大幅度下降,菌体生长受到严重影响,生物量和MELs 产量均严重下降,分析认为NH4+被利用后,发酵液中生成大量的H+,使培养液pH 大大降低,严重影响了蚜虫拟酵母生长和发酵合成MELs,当NO3-和NH4+同时存在时,蚜虫拟酵母生长优先利用NH4+,导致培养液pH 下降,说明生理性酸性物质不适合做为蚜虫拟酵母的氮源。因此,选取酵母提取物和NaNO3进一步复配,得到合适的比例以提高MELs 的产量。

图2 添加不同氮源发酵8 d 的发酵液Fig.2 The 8th day fermentation solution with different nitrogen sources

表2 添加不同氮源发酵8 d 后的pH 值、生物量、产物产量Table 2 pH,biomass and the yield of MELs with different nitrogen sources after fermented 8 d
2.2 两种氮源不同复配对蚜虫拟酵母合成MELs过程的影响
为进一步确定NaNO3和酵母提取粉对发酵合成MELs 的影响,将其进行了复配,各试验组保持氮源物质的总添加量不变,试验组编号为0,1,2,3,4,分别加入4.0 g/L YE、1.0 g/L NaNO3+3.0 g/L YE、2.0 g/L NaNO3+2.0 g/L YE、3.0 g/L NaNO3+1.0 g/L YE、4.0 g/L NaNO3。在各取样时间点测定生物量、产物产量、pH、发酵液残余还原糖和胞外蛋白浓度,结果见图3~图7。
2.2.1 发酵过程中生物量的变化 生物量多少能够反映菌体生长情况。图3显示测定结果表明,发酵5 d 后,组2 首先获得最高的生物量,6 d 后,组3 获得最高生物量。而在仅添加硝酸钠的组4 中,发酵过程中生物量偏低。而添加酵母提取粉较多的组0 和组1 中,生物量逐渐上升,7 d 后趋向于稳定,发酵8 d 后,组0 和组1 生物量明显高于组2 和组3,是组4 的近2 倍,说明增加酵母提取粉的添加量有利于蚜虫拟酵母的生长。各试验组在发酵5~7 d 之间,出现不同程度的生物量下降现象,分析认为与蚜虫拟酵母合成MELs 的过程有关,在发酵0~5 d 时,菌体大量生长,且运输大豆油至胞内进行代谢,同时在胞内完成MELs 的合成,进而在后期分泌至胞外,故此生物量出现下降。

图3 不同组生物量随发酵时间的变化Fig.3 The changes of biomass with culture time in different groups
2.2.2 发酵过程中产物产量的变化 产物水平是衡量氮源是否合适的最主要评价指标。结果见图4,产物产量从第3 天逐渐上升,至7 天时,产物产量基本达到最大。发酵8 d 后,MELs 产量为组2>组3>组0>组4>组1,组2 与组1 相比产量提高了22.7%。只添加硝酸钠做为氮源时,生物量明显偏低,而发酵过程中产物产量也明显偏低,后期MELs 产量与只添加酵母提取粉的组0 和添加少量NaNO3的组1 接近,说明将硝酸钠和酵母粉混合添加更有利于MELs 合成。Masaaki 等[18]在研究湖北拟酵母利用橄榄油合成MELs 时,发现添加一定量的酵母提取物可以促进生物量和产物产量的提高,与本研究有相似结果,分析推测是由于酵母提取物中的维生素、 氨基酸等物质为促进因子加强了菌株生长和MELs 合成。
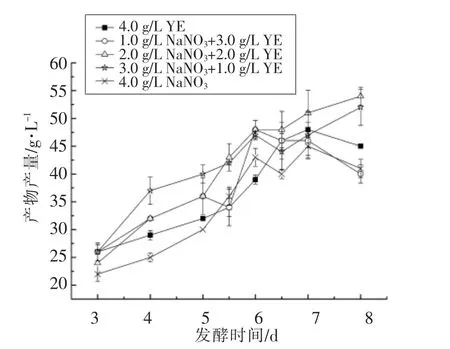
图4 不同组产物产量随发酵时间的变化Fig.4 The changes of MELs yield with culture time in different groups
2.2.3 发酵过程中pH 变化 图5结果表明,整个发酵过程中,发酵液的pH 基本在5.30 和6.50之间,处于一个偏酸性的环境,原因可能有两个,一是磷酸二氢钾的缓冲作用,二是大豆油分解出小分子的脂肪酸与硝酸根利用后产生的OH-相互作用。在研究pH 相关的其他试验中发现(数据未列出),pH 处于该范围内,对菌体生长和MELs 合成影响无显著性差异,当pH 低于4.50 或者高于8.00 时,会对菌体生长和产物合成产生不利的影响。所以,在本研究中,硝酸钠和酵母提取粉的比例变化对生物量和MELs 产量的影响并非源于对pH 的影响。
2.2.4 发酵过程中还原糖变化 现阶段,关于蚜虫拟酵母利用大豆油为唯一碳源发酵合成MELs的代谢途径尚未完全清楚。Hewald 等[19]在玉米黑粉菌中发现了合成MELs 的相关基因簇,检测MELs 产物中脂肪酸链长度呈现Cn-2 的规律,推测大豆油通过缩链反应(β-氧化途径)来获得生长和代谢能量。Günther 等[20]测定了蚜虫拟酵母的基因组和不同碳源水平的转录水平,发现了类似于玉米黑粉菌中合成MELs 的基因簇。为了探究MELs 合成过程中是否有糖类分泌到发酵液,利用DNS 法测定发酵液中还原糖含量,结果见图6。在发酵第5 天之前,在只添加硝酸钠做为氮源的组4 中,发酵液中未测定出还原糖的存在,说明MELs 中的甘露糖基以及细胞生长所需的糖类是直接在细胞内产生并在细胞内被利用。而在添加酵母提取粉的试验组中,3~5 d 含有较大量还原糖,且随着酵母提取粉的添加量增加,发酵液中的还原糖也不断增加,但测定平行样品之间波动较大,分析认为与酵母提取粉中复杂的成分相关。在发酵5 d 之后,组4 中还原糖含量增加,而添加酵母提取粉中的试验组还原糖含量下降,且趋于稳定,推测此时微生物生长已将酵母提取粉中的复杂成分利用,微生物生长达到稳定时期,大量合成所需的酶、 糖类并开始分泌次级代谢产物MELs,而MELs 可以改变细胞膜的通透性[11],释放MELs的同时将胞内未及时利用的部分糖类释放至发酵液中。
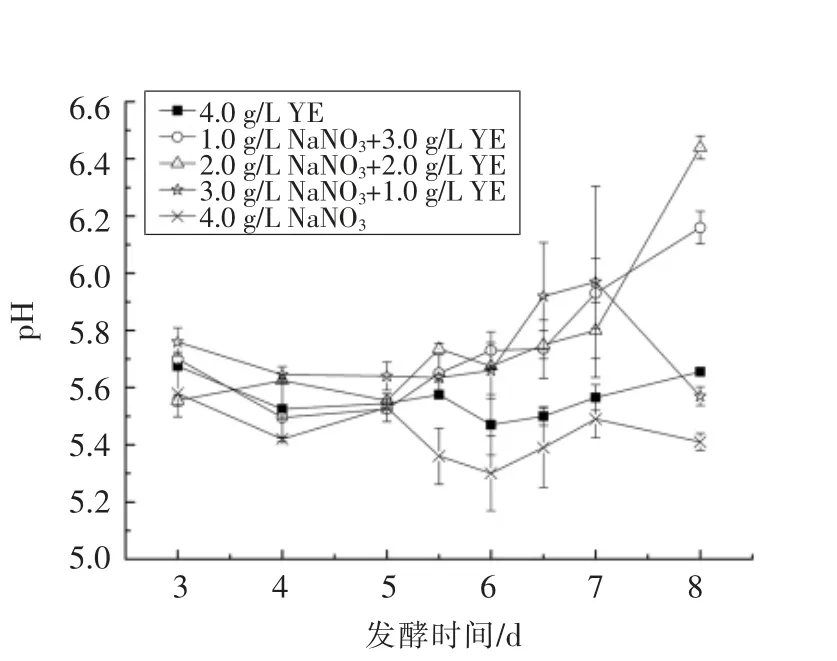
图5 不同组pH 随发酵时间的变化Fig.5 The changes of pH with culture time in different groups
2.2.5 发酵过程中胞外蛋白浓度变化 大多数细胞代谢活动都需要蛋白酶的参与,为了进一步确定蚜虫拟酵母合成MELs 的发酵液中的代谢作用,测定发酵液中的蛋白浓度,结果见图7。可以看出,所有试验组胞外蛋白质量浓度在整个发酵过程均在0.30~0.50 g/L 范围内,且无显著上升趋势。说明蚜虫拟酵母在合成MELs 过程中,主要将营养物质吸收胞内,在胞内合成大量酶,催化多种反应,而很少分泌蛋白酶至胞外进行催化反应,而目前所推测的MELs 合成途径[4],包括β-氧化途径[21]、de novo 途径和整合参入途径均在细胞内完成,与本试验中测定胞外蛋白浓度较低相符。
图6 不同组还原糖质量浓度随发酵时间的变化Fig.6 The changes of reducing sugar concentration with culture time in different groups
2.3 各复配组获得MELs 临界胶束浓度的分析
MELs 由不同构型组成,为了探究不同氮源复配对蚜虫拟酵母合成MELs 性质的影响。取各组分离纯化后的MELs 产物测定临界胶束浓度,见图8。结果显示,当只添加硝酸钠做为氮源(组4)时,临界胶束质量浓度为14.29 mg/L,此时水溶液的表面张力为(30.90±0.21)mN/m,而组0,1,2,3中MELs 产物的临界胶束质量浓度均为12.50 mg/L,水溶液表面张力分别降低至(30.86±0.43),(28.52±0.30),(31.45±0.66),(29.68± 0.26)mN/m,与报道中[15]采用单一MEL-A 构型在临界胶束浓度得到的表面张力值相比,非常接近。本试验结果表明,添加酵母提取粉对于合成MELs 的构型组成比例有一定的影响,进而影响MELs 的表面活性。
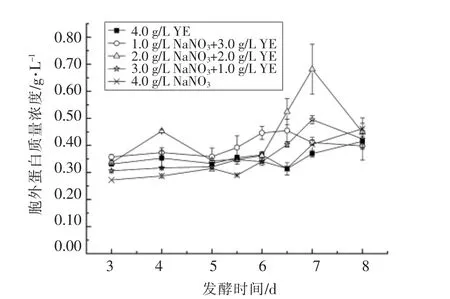
图7 不同组胞外蛋白浓度随发酵时间的变化Fig.7 The changes of extracellular protein concentration with culture time in different groups
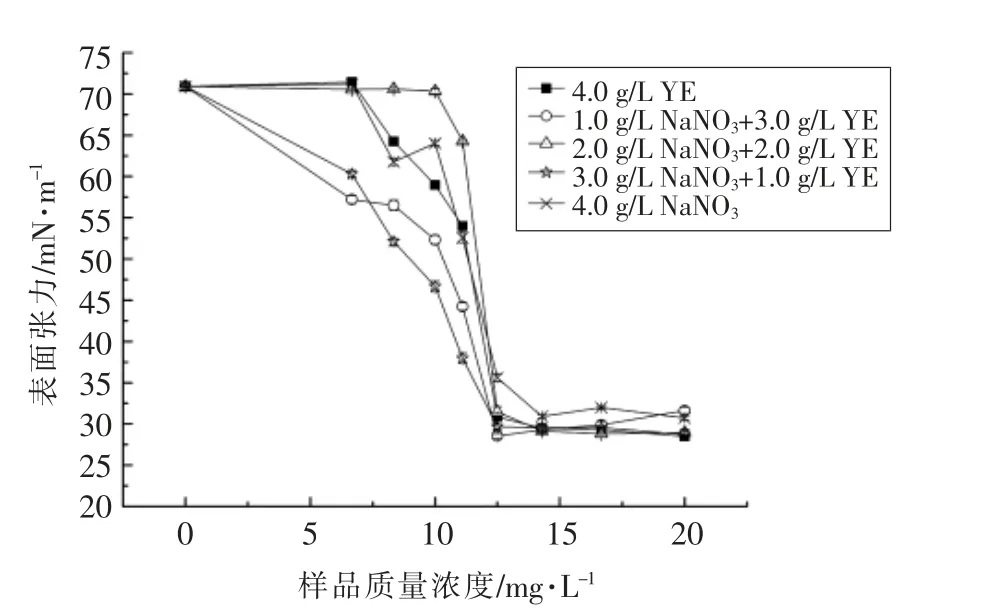
图8 不同组MELs 临界胶束浓度的测定Fig.8 Determination of the critical micelle concentration of MELs from different groups
3 结论
本文通过比较硝酸钠、酵母提取粉、硫酸铵、硝酸铵4 种氮源对蚜虫拟酵母利用大豆油发酵合成MELs 的影响,结果发现硝酸钠有利于MELs 的合成,而酵母提取物更有利于微生物的生长。选取硝酸钠和酵母提取粉进行复配,综合生物量、产物产量、pH、发酵液还原糖浓度和胞外蛋白浓度等指标分析表明:添加2.0 g/L 硝酸钠和2.0 g/L 酵母提取粉时,最有利于蚜虫拟酵母发酵合成MELs,同时间接证明MELs 的合成主要在细胞内完成,随后分泌至胞外。对氮源复配不同组获得的MELs产物测定临界胶束浓度,发现添加酵母提取粉对于MELs 产物的表面活性具有一定影响,而酵母提取粉的添加量对MELs 产物的表面活性无显著影响。
