迷迭香主要组分对沙门氏菌的抑制机理
2019-05-18蔡晓军孙杨赢潘道东曹锦轩曾小群杨雪松
蔡晓军 孙杨赢 潘道东,2* 曹锦轩 曾小群 吴 振 杨雪松
(1 宁波大学浙江省动物蛋白食品精深加工技术重点实验室 浙江宁波315211 2 南京师范大学食品科学与营养系 南京210097)
沙门氏菌(Salmonella)是一种常见的食源性致病菌,在畜禽肠道带菌率较高,常引起肉类食品的污染,这是造成人类沙门氏菌病的重要原因之一。人类感染沙门氏菌会出现脱水,呕吐、腹泻等胃肠炎症状,严重时甚至导致死亡。合理使用抗菌剂,降低畜禽原料肉沙门氏菌的带菌率是控制食源性疾病爆发的一种常见手段[1-3]。目前,畜禽生产中常用抗菌剂主要有化学抗菌剂和天然抗菌剂,前者使用过多易造成细菌的耐药性,甚至威胁人类的健康。天然抗菌剂以其优质、安全、高效的特点备受关注[4]。香料植物作为天然抗菌剂精油的重要来源,在畜禽生产中应用较多[5]。
迷迭香(Rosmarinus officinalis L.)是唇形科迷迭香属香料植物,含有多种具有抗菌、抗氧化、抗癌、镇痛消炎等功效的活性物质[6],在食品、制药和医学保健等领域应用广泛。迷迭香提取物及其精油的抑菌性主要与酚酸类成分及萜烯类成分有关[6],其中,酚酸类成分以鼠尾草酸和迷迭香酸含量较高,而萜烯类成分则以1,8-桉叶素、樟脑及α-蒎烯最为常见[7-9]。研究表明,迷迭香酸[10]和鼠尾草酸[11]均有广谱抑菌性,后者对大肠杆菌、绿脓杆菌及肺炎克雷伯氏菌等表现出与氯霉素效果相当甚至更优异的抗菌活性。1,8-桉叶素、樟脑、α-蒎烯、月桂烯[12]、β-石竹烯等[13]萜类成分对大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌、绿脓杆菌等多种致病菌均有较强的抑菌性。目前国内外学者对迷迭香单体成分的报道多集中于生物活性研究及相关应用上,而关于抑菌机理的报道较为少见。
本研究拟采用牛津杯法比较迷迭香中含量较高的6 种单体组分[6]——鼠尾草酸、1,8-桉叶素、樟脑、α-蒎烯、β-石竹烯和冰片(龙脑)对沙门氏菌的抑菌作用,找出最强抑菌组分,结合细菌细胞壁、细胞膜损伤以及相关酶活力确定其抑菌机理,为控制沙门氏菌源食源性疾病的爆发以及迷迭香成分的开发提供试验依据。
1 材料与方法
1.1 供试菌种与培养基
沙门氏菌(Salmonella)为宁波大学实验室保藏菌种。营养肉汤(NB)培养基、营养琼脂(NA)培养基,购于青岛高科园海博生物技术有限公司。
1.2 材料及试剂
鼠尾草酸(60%,HPLC),上海源叶生物科技有限公司;1,8-桉叶素(99%)、(+)-冰片 (龙脑,98%),上海阿拉丁生化科技股份有限公司;(±)-樟脑(96%)、β-石竹烯(90%,来源于樟树),北京百灵威科技有限公司;α-蒎烯(≥98%,GC),北京索莱宝科技有限公司;无水乙醇(分析纯),国药集团化学试剂有限公司;PBS 缓冲液 (干粉,1 L 含0.01 mol/L PO43+、0.8% NaCl,pH 7.2~7.4),北京酷来搏科技有限公司;碱式磷酸酶(AKP)测试盒、钾(K)测试盒,南京建成生物工程研究所;GENMED正苯基萘胺摄入法细菌膜损伤荧光检测试剂盒、GENMED 半乳糖苷酶释放法细菌膜损伤荧光检测试剂盒,上海杰美基因医药科技有限公司。
1.3 主要仪器与设备
电子数显卡尺0~150 mm,桂林广陆数字测控股份有限公司;LDZH-50KBS 型立式压力蒸汽灭菌器,上海申安医疗机械厂;SW-CJ-2F 超净工作台,苏州华科净化设备有限公司;HWS-0288 智能型恒温恒湿培养箱,宁波江南仪器制造厂;H2500R-2 高速冷冻离心机、H-2050R 高速冷冻离心机,长沙湘仪实验仪器开发有限公司;Eppendorf centrifuge 5418R,艾本德中国有限公司;Infinnite200pro 酶标仪,瑞士TECAN 公司。
1.4 试验方法
1.4.1 迷迭香单体组分溶液的配制 选择迷迭香6 种单体组分鼠尾草酸、1,8-桉叶素、 樟脑、α-蒎烯、β-石竹烯和冰片(龙脑)[6]。采用95%的乙醇溶液分别将6 种组分配成质量浓度为20 mg/mL 的溶液,用直径0.22 μm 的无菌过滤器过滤除菌,4℃冰箱保存备用。
1.4.2 菌悬液的制备及含菌平板的制备 活化后的沙门氏菌按照3%的比例接种至100 mL 肉汤培养基,37 ℃、150 r/min 振荡培养18 h,以灭菌肉汤为溶剂,将菌液稀释至105~106CFU/mL。向无菌培养皿中倒入20 mL 灭菌的琼脂培养基,待凝固后分别加入0.1 mL 菌液(105~106CFU/mL),涂布均匀制成含菌平板备用。
1.4.3 迷迭香组分的抑菌活性 采用牛津杯法测定抑菌直径,参照Diao 等[14]的方法并作适当修改。琼脂平板表面以间距2~3 cm 放置2 个无菌干燥牛津杯(外径8 mm,内径6 mm,高10 mm)并轻轻按压。向牛津杯中分别加入6 种质量浓度为20 mg/mL 的迷迭香单体组分溶液各0.2 mL,用等体积95%乙醇溶液及生理盐水作对照。平板于4 ℃放置1 h 后平放在37 ℃恒温培养箱中培养24 h,用游标卡尺测定抑菌直径,重复3 次。
1.4.4 乙醇体积分数对1,8-桉叶素溶液抑制率的影响 以1,8-桉叶素为抑菌剂,预试验发现,乙醇体积分数低于10%,1,8-桉叶素不能溶解完全,过高则会表现抑菌作用,需筛选合适的溶剂浓度进行后期试验。采用10%,20%,30%,40%和50%的乙醇肉汤溶液分别配制10 mg/mL 的1,8-桉叶素溶液,用肉汤倍比稀释至5,2.5 mg/mL,以相应浓度乙醇肉汤溶液作溶剂对照。向10 mL 无菌离心管中按体积比1∶1 分别加入105~106CFU/mL 菌悬液和0,2.5,5,10 mg/mL 1,8-桉叶素溶液混匀,管内实际含1,8-桉叶素质量浓度分别为0,1.25,2.5,5 mg/mL,设置2 种对照组:以无菌肉汤和相应浓度无菌乙醇肉汤溶液分别作阳性对照和阴性对照。混匀置于37 ℃、150 r/min 恒温振荡培养24 h,测定各组样品600 nm 处OD 值并按公式(1)计算抑制率[15],重复测定3 次。

1.4.5 1,8-桉叶素对沙门氏菌的最小抑菌浓度(MIC)及细菌生长曲线 取37 ℃培养12 h 的沙门氏菌按照一定比例加入到新的肉汤培养基中,调整菌密度约为107CFU/mL。最小抑菌浓度(MIC)测定[16]。用10%乙醇水溶液配制质量浓度为10 mg/mL 的1,8-桉叶素储备液,采用二倍稀释法稀释至5,2.5,1.25,0.625,0.3125 mg/mL。将药液与菌液等比例混匀,置于37 ℃、150 r/min 条件下振荡培养24 h,用生理盐水作空白对照。以肉眼观察菌液澄清的最低含药量为MIC 值,重复测定3 次。
沙门氏菌生长曲线绘制[17]。用10%乙醇肉汤溶液配制质量浓度10 mg/mL 的储备液,用肉汤稀释适当比例后加入到菌液中配成含药终浓度分别为1 MIC 和2 MIC 的1,8-桉叶素溶液,用不含药物的菌悬液作对照组。37 ℃、150 r/min 条件下振荡培养24 h,每隔2 h 分别取样测定OD600nm值,以取样时间为横坐标、以OD600nm值为纵坐标绘制沙门氏菌生长曲线,重复测定4 次。
1.4.6 对细菌细胞壁通透性及钾离子泄漏的影响 细胞壁通透性测定参照Xu 等[18]的方法并做适当修改。取37 ℃培养12 h 的沙门氏菌于5 000 r/min 离心10 min 去上清,沉淀用无菌水洗涤3次后重悬至107CFU/mL。用10%乙醇水溶液配制10 mg/mL 的1,8-桉叶素储备液,无菌水稀释适当比例后加入到菌悬液中配成含药物终浓度分别为1MIC、2MIC 的1,8-桉叶素溶液,同时以不含药物的菌液为对照组。样品置于37 ℃、150 r/min 条件恒温振荡培养,取培养3 h 的菌悬液各1 mL,3 500 r/min 离心10 min,吸取上清液用碱性磷酸酶(AKP)试剂盒测定不同样品培养液的AKP 含量,重复测定3 次。
钾离子含量测定:取上述试验培养0,3 和6 h 的样品各1 mL,3 500 r/min 离心10 min,取上清参照钾(K)测试盒说明书测定钾离子含量,结果按照说明书公式,即公式(2)进行计算,重复测定3次。
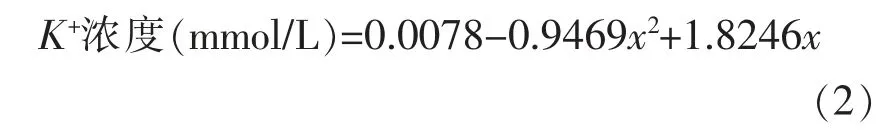
式中,x——样本管绝对OD 值,即x=OD样品-OD空白。
1.4.7 对细菌外膜损伤和内膜损伤的影响 接种3%经37 ℃培养12 h 的沙门氏菌菌液到50 mL 灭菌肉汤培养基中,37 ℃、150 r/min 条件继续培养至OD600=0.50±0.01。取1.4.7 节所制储备液用无菌水倍比稀释成1MIC、2MIC 的1,8-桉叶素溶液,同时以不含药物的菌液作对照组。细菌外膜和内膜损伤程度分别按照GENMED 正苯基萘胺摄入法和GENMED 半乳糖苷酶释放法细菌膜损伤荧光检测试剂盒说明书进行操作,结果以相对荧光单位(Relative Fluorescence Units)表示,重复测定3 次。
1.4.8 对细菌核酸物质和可溶性蛋白泄漏的影响核酸物质测定[17]:参照1.4.7 节制取沙门氏菌沉淀及1,8-桉叶素储备液。沉淀用0.01 mol/L pH 7.4 的PBS 洗涤并重悬至107CFU/mL,储备液用无菌水稀释适当比例后加入到菌悬液中配成含药物终浓度分别为1MIC、2MIC 的1,8-桉叶素溶液,以不含药物的菌液作对照组。37 ℃、150 r/min条件下培养6 h,每隔1 h 分别取样1 mL,5 000 r/min 离心10 min,测定上清液在260 nm 处的吸光值,重复测定3 次。
蛋白质含量的测定:取上述试验中培养2,4,6 h 的菌液各1 mL,5 000 r/min 离心10 min 后取上清液按照福林酚法于500 nm 处测定OD 值,用标准蛋白溶液绘制标准曲线,并根据标准曲线计算蛋白浓度,重复测定3 次。
1.4.9 统计分析 试验数据采用SAS 8.0 软件one-way ANOVA 过 程 中 的Duncan’s multiplerange test 检验过程进行差异性分析,通过Origin8.5 软件进行绘图。
2 结果与讨论
2.1 迷迭香成分对沙门氏菌的抑菌直径
如表1所示,迷迭香6 种组分对沙门氏菌的抑菌直径均明显高于对照组,以1,8-桉叶素抑菌直径最大。结果表明,迷迭香6 种组分以1,8-桉叶素对沙门氏菌抑菌作用最强。迷迭香提取物及精油具有广谱抑菌性,其抑菌活性显著高于常见的食品防腐剂二丁基羟基甲苯(BHT)和苯甲酸[19],且对不同细菌的抑菌效果与酚酸类、 萜烯类成分的种类或含量有关[20-22]。1,8-桉叶素是迷迭香精油的主要组分,精油的抑菌作用表现为其主要组分的抑菌活性[22]。因此,选择1,8-桉叶素为对象研究其对沙门氏菌的抑菌机理。
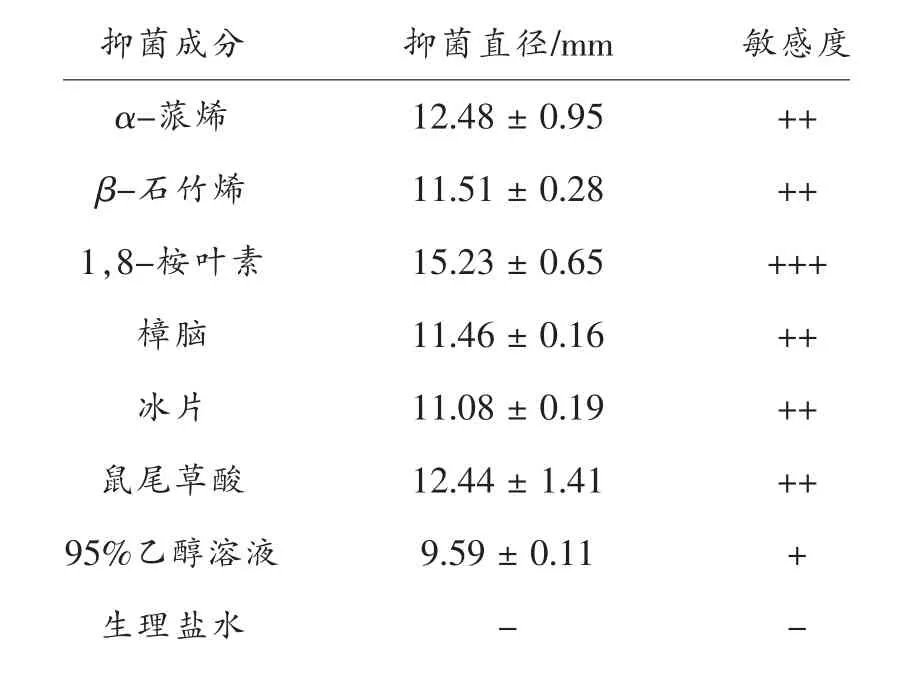
表1 迷迭香组分对沙门氏菌的抑菌直径Table 1 Inhibition zone of Rosemary extract ingredients to Salmonella
2.2 乙醇体积分数对1,8-桉叶素抑制率的影响
如图1所示,乙醇体积分数大于10%,对照组(0 mg/mL)和1,8-桉叶素试验组(5,2.5 mg/mL)的抑制率均接近于100%,不能排除乙醇的抑菌作用。当乙醇体积分数为10%时,与对照组相比,5 mg/mL 试验组抑制率增加26.16%,乙醇抑菌作用相对降低。综上所述,选取体积分数为10%的乙醇溶液作为溶剂进行后期试验。
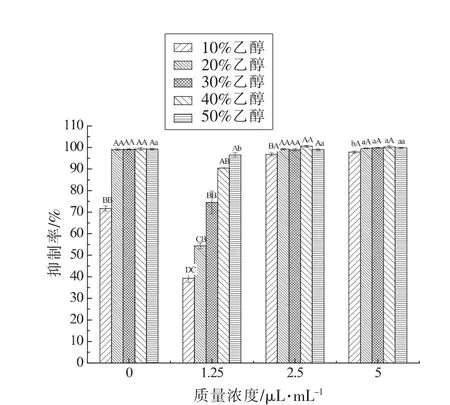
图1 乙醇体积分数对1,8-桉叶素抑制率的影响Fig.1 Effect of ethanol concentration on the inhabitation ratio of 1,8-cineol
2.3 1,8-桉叶素最小抑菌浓度(MIC)及对沙门氏菌生长曲线的影响
1,8-桉叶素的MIC 为2.5 mg/mL。如图2所示,1MIC(2.5 mg/mL)和2MIC(5 mg/mL)2 个处理组的OD 值均呈先略微下降再趋于水平的趋势,而对照组细菌持续增长,在14 h 时达到稳定期。说明1,8-桉叶素在1MIC 和2MIC 两种浓度下均能够完全抑制沙门氏菌的生长甚至杀死细菌。Sokovic等人[12]发现,1,8-桉叶素对大肠埃希氏菌、沙门氏菌、 金黄色葡萄球菌等多种致病菌均有抑菌性,与本试验结果相似。
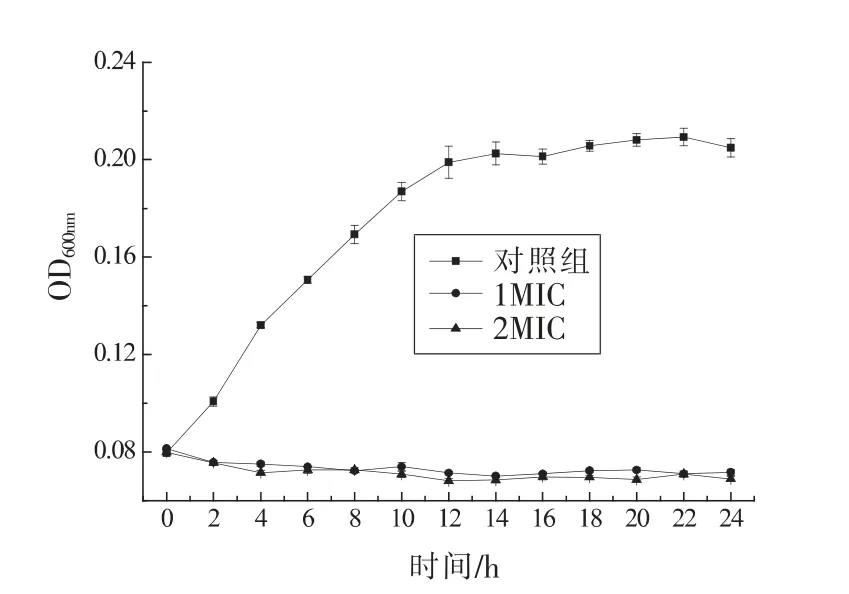
图2 1,8-桉叶素对沙门氏菌生长曲线的影响Fig.2 Antibacterial kinetics of 1,8-cineol against Salmonella
2.4 对细胞壁通透性的影响
细菌中培养液AKP 含量间接反映出细胞壁的通透性[15]。由表2可知,加入1,8-桉叶素溶液后,菌液碱式磷酸酶(AKP)活力明显增加,且1,8-桉叶素浓度越高,酶活力越大。表明1,8-桉叶素破坏了沙门氏菌细胞壁,从而使菌液AKP 含量增加。脂多糖是革兰氏阴性菌细胞壁的特有组成成分,与革兰氏阴性致病菌的病原能力有关[24]。Zhao等[25]发现1,8-桉叶素能够降低由脂多糖诱导的小鼠急性肺炎症。1,8-桉叶素对革兰氏阴性菌的抑菌活性总体高于革兰氏阳性菌[22],可能是其与脂多糖相互作用的结果,致使细胞壁通透性受到破坏。
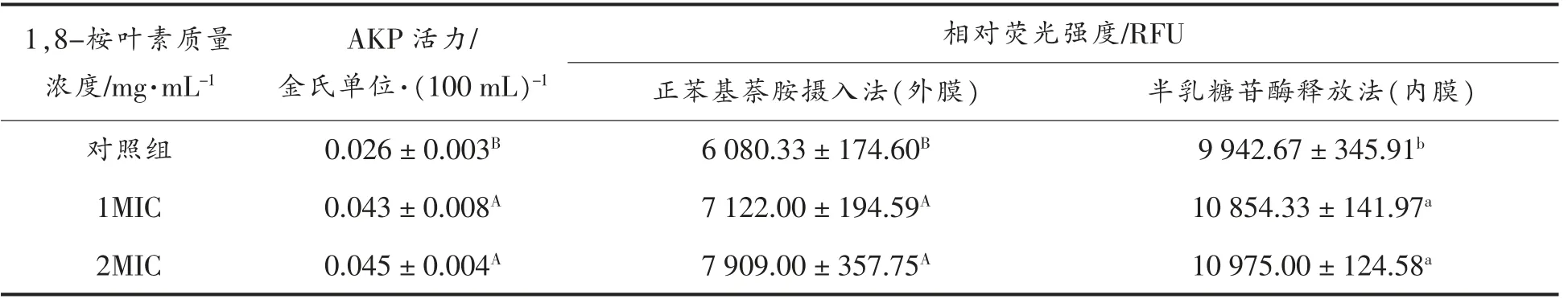
表2 1,8-桉叶素对沙门氏菌AKP 活力及细胞膜损伤的影响Table 2 The AKP activity and membrane damage of Salmonella treated with 1,8-cineol
2.5 对细菌外膜损伤和内膜损伤的影响
如表2所示,添加1,8-桉叶素使沙门氏菌内外膜的相对荧光强度显著提高(P<0.05),且随着药物浓度增加而增大。表明1,8-桉叶素对沙门氏菌的外膜和内膜造成荧光损伤,且浓度越高,膜损伤程度越大。1,8-桉叶素通过诱导革兰氏阴性菌的细胞膜损伤作用发挥抗菌活性[22]。Anjos 等[26]在研究皮肤的渗透机制时发现,1,8-桉叶素分子内部氢键的疏水作用能够促进自身分子到达双层膜的中心地带,分子的极性基团在该区域通过吸引亲水侧的极性脂质首基,破坏细胞膜极性接口处的氢键网络,从而促进膜分区,最终使分子透过膜结构。这或许能够解释1,8-桉叶素对沙门氏菌外膜和内膜的损伤机制。
2.6 对细菌钾离子泄漏情况的影响
由图3可知,与对照组相比,添加1,8-桉叶素使沙门氏菌K+发生泄漏,2MIC 处理组泄漏量显著高于1MIC 处理组(P<0.01),泄漏程度随着作用时间的延长而有所增加。K+是微生物细胞内的重要阳离子,参与细胞内部多种生理功能和代谢途径,其功能主要在于维持细胞膜的渗透压和稳定性等[27]。当细菌受到药物抑制时,细胞膜流动性和透性发生改变,造成胞内K+等小分子物质泄漏,影响细胞的功能特性甚至造成菌体死亡[28]。1,8-桉叶素能够使沙门氏菌K+发生泄漏,表明细菌细胞膜的流动性和通透性发生改变。
2.7 对细菌胞内核酸物质泄漏情况的影响
核酸物质在260 nm 处有最强吸收峰,通过测定细菌培养液260 nm 处的吸光值可以判断核酸物质的泄漏情况[29]。由图4可知,添加1,8-桉叶素溶液使培养液260 nm 处的吸光值明显增加,且随保鲜剂浓度的增加延长和作用时间延长显著增大(P<0.01),试验组的吸光值明显高于对照组,4 h达到最大值。蓝蔚青等[15]发现,添加复合保鲜剂能够破坏荧光假单胞菌细胞膜的完整性。Yao 等[29]发现,大肠杆菌细胞膜受损能够引起胞内物质发生泄漏。1,8-桉叶素能够使沙门氏菌核酸物质外渗,表明沙门氏菌细胞膜的完整性受到破坏。
2.8 对细菌蛋白质泄漏情况的影响
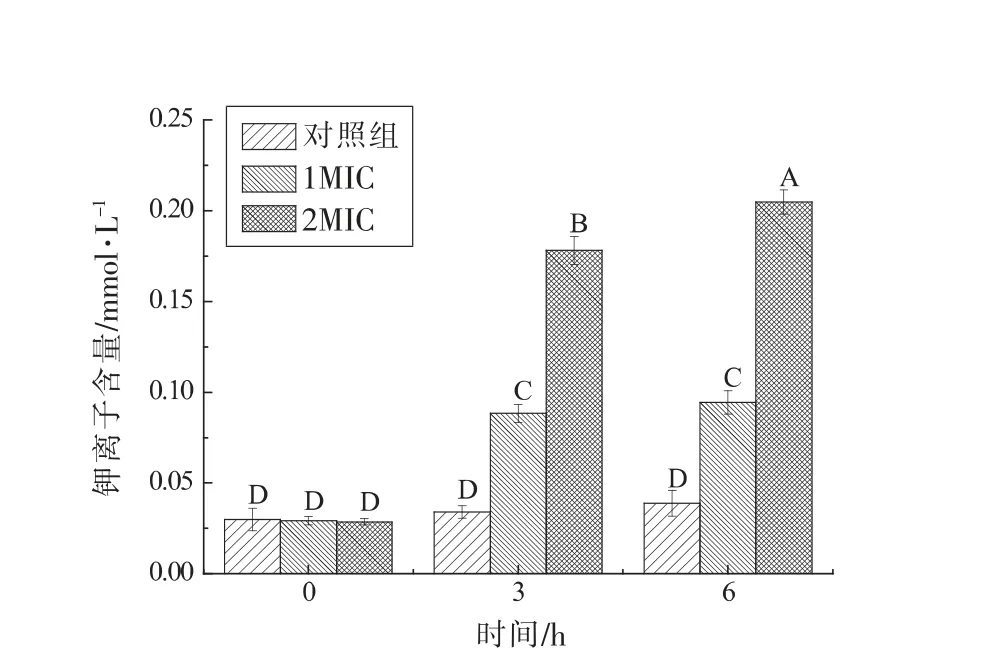
图3 1,8-桉叶素对沙门氏菌钾离子泄漏的影响Fig.3 Effect of 1,8-cineol on the content of K+ released from Salmonella
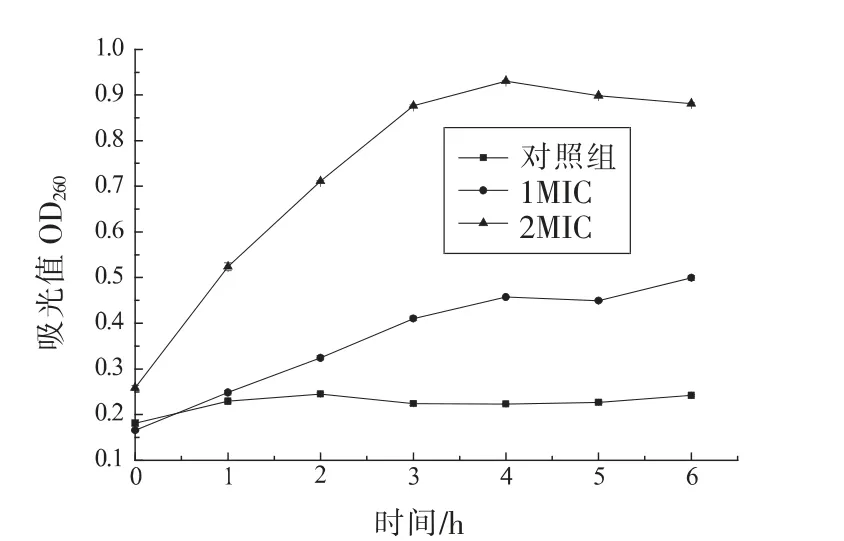
图4 1,8-桉叶素对沙门氏菌OD260nm 的影响Fig.4 Effect of 1,8-cineol on the OD260nm of Salmonella
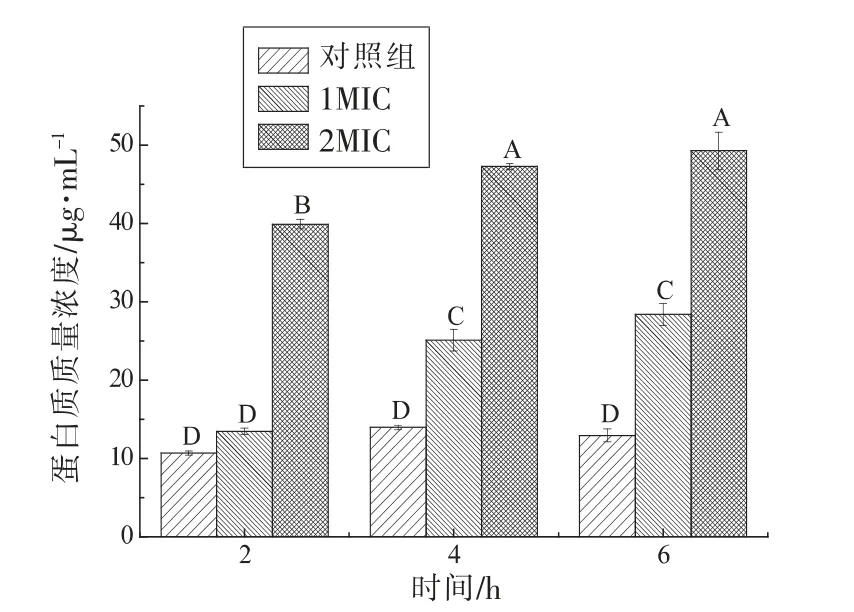
图5 1,8-桉叶素对沙门氏菌胞外蛋白质浓度的影响Fig.5 Effect of 1,8-cineol on extracellular protein concentration of Salmonella
如图5所示,与对照组相比,添加1,8-桉叶素使沙门氏菌培养液中蛋白质浓度增加,2MIC 处理组显著高于1MIC 处理组(P<0.01),作用时间越长,蛋白质浓度越大。蛋白质是细胞膜结构重要组成成分,与细胞多种生理代谢活动有关,细胞膜受损伤可引起胞内蛋白质泄漏[29]。本试验中1,8-桉叶素使沙门氏菌蛋白质发生泄漏,说明沙门氏菌细胞膜受到破坏,破坏程度随着药物浓度增加和作用延长而增大。
3 结论
迷迭香6 种主要组分对沙门氏菌均有较强的抑菌作用,以1,8-桉叶素最强。1,8-桉叶素溶液在浓度为1MIC 和2MIC 时对对数期的沙门氏菌抑制效果显著,它能够破坏细菌的细胞壁,损伤细菌的外膜和内膜,改变并破坏细胞膜的通透性和完整性,引起胞内物质(K+、核酸、蛋白质)外渗。细胞壁和细胞膜的损伤破坏程度及胞内物质的外渗程度随着药液剂量的增加和作用时间的延长而相应增大。1,8-桉叶素抑制沙门氏菌的机理,主要是通过损伤细胞壁和细胞膜结构,从而破坏胞内环境稳定性而起作用。
