驼乳对II 型糖尿病小鼠的糖脂代谢及胰岛素抵抗的影响
2019-05-18高婉婷吉日木图
何 静 高婉婷 明 亮 吉日木图,2*
(1 内蒙古农业大学 乳品生物技术与工程教育部重点实验室 呼和浩特010018 2 内蒙古骆驼研究院 内蒙古阿拉善750306)
II 型糖尿病是一种多基因遗传倾向疾病,由胰岛β 细胞分泌胰岛素不足或靶细胞对胰岛素不敏感(胰岛素抵抗)所致,亦称为非胰岛素依赖性糖尿病(Non-insulin-dependent diabetes mellitus,NIDDM)。据国际糖尿病联盟(IDF)统计,全球范围内II 型糖尿病患者的总人数预计将从2000年的1.71 亿增加到2030年的3.66 亿[1]。目前,糖尿病已成为继心血管和肿瘤疾病之后的第3 位“健康杀手”,加强糖尿病的防治已刻不容缓。
研究表明,临床上用于辅助控制糖尿病的药物均存在不同程度的禁忌症和不良反应,长期应用还可引起药物的继发性失效,即便使用胰岛素注射的方法在注射部位也会出现脂肪萎缩、 肥大并且会导致视力模糊等副作用,因此许多类型的传统食品被应用于糖尿病的治疗[2-3]。在动物界,骆驼乳被认为是上帝创造的奇迹,对驼乳成分的分析表明,骆驼乳中含有一定量的降糖功效因子如胰岛素、类胰岛素蛋白、乳铁蛋白、维生素C、免疫球蛋白等,能够对糖尿病的血糖水平以及血清中其它成分起到调节作用[4]。Agrawal 等[5]研究发现,在印度的Raica 部落,驼乳的消费水平与糖尿病的发病率成负相关,并且大量的体外试验也证实了驼乳的降血糖功效[6]。然而,目前大部分研究都围绕于驼乳与I 型糖尿病开展的,针对II 型糖尿病的研究较少[7-8]。本文以高脂饲料与链脲佐菌素(SZT)联合诱导的II 型糖尿病小鼠为研究对象,观察驼乳对II 型糖尿病小鼠的糖脂代谢与胰岛素抵抗的作用效果,为今后驼乳与II 型糖尿病的研究提供参考。
1 材料与方法
1.1 材料与试剂
驼乳,由苏尼特左旗当地牧民提供;饲料:基础饲料、高脂饲料(67%基础料+10%猪油+20%蔗糖+2.5%胆固醇+0.5%胆盐),均由北京科澳协力公司提供;链脲佐菌素(streptozotocin,STZ),Sigma公司;安稳优加血糖试纸条,三诺生物传感股份有限公司;小鼠胰岛素检测试剂盒,南京建成生物工程研究所;诺和灵R 生物合成人胰岛素注射液,丹麦诺和诺德公司。
1.2 主要仪器设备
三诺安稳优加血糖仪,三诺生物传感股份有限公司;酶标仪,南京华东电子公司;全自动生化分析仪,深圳迈瑞公司。
1.3 试验方法
1.3.1 试验小鼠饲养及二型糖尿病模型建立SPF 级7 周龄雄性C57BL/6J 小鼠24只,体重(16±2)g,由北京维通利华实验动物技术有限公司提供(许可证编号:SCXK(京)2012-0001)。在严格12 h 光照12 h 黑暗、恒温20~22 ℃、相对湿度65%~70%的环境下适应性喂养1 周后开始试验。
II 型糖尿病模型小鼠是通过高脂饲料与链脲佐菌素(STZ)联合诱导。正常组饲喂基础饲料,其余各组饲喂高脂饲料,5 周后各组小鼠禁食不禁水12 h,模型组小鼠连续5 d 腹腔注射STZ(40 mg/kg,溶于0.1 mmol/L 柠檬酸缓冲液,pH 4.4,冰浴,现用现配,30 min 内用完);正常对照组按等剂量腹腔注射柠檬酸-柠檬酸钠缓冲溶液 (0.1 mol/L,pH 4.4)。一周后测定空腹血糖值,将空腹血糖大于11.1 mmol/L 的小鼠判定为II 型糖尿病模型建立成功。
1.3.2 分组及给药方案 II 型糖尿病小鼠造模成功后,将小鼠随机分为2 组:糖尿病模型组、驼乳干预组,每组8 只。用驼乳干预4 周,期间各组小鼠给药方法及剂量如下所示:
正常对照组(NC):普通饲料,自由饮食饮水,每日灌胃0.1 mL/10 g 的生理盐水;
糖尿病模型组(DC):高脂饲料,自由饮食饮水,每日灌胃同等剂量的生理盐水;
驼乳干预组(CM):高脂饲料喂养,自由饮食饮水,每日灌胃驼乳0.1 mL/10 g。
1.4 指标测定
1.4.1 口服葡萄糖耐量试验与胰岛素耐量试验
口服葡萄糖耐量(OGTT)试验:驼乳干预4 周后,小鼠在禁食12 h 后经口给予葡萄糖1.5 g/kg(30%的葡萄糖溶液),测定灌胃后0,30,60,90 和120 min 时的血糖值,并计算曲线下面积(AUC)。
胰岛素耐量试验(ITT):驼乳干预4 周后,小鼠在禁食12 h 后腹腔注射胰岛素(0.75 U/kg),测定注射后0,30,60,90 和120 min 时的血糖值,并根据血糖值绘制血糖变化图,计算曲线下的面积。
1.4.2 空腹血糖与血脂指标测定 驼乳干预期间,每隔1 周测一次小鼠的空腹血糖值。4 周后,小鼠空腹12 h,采取眼球取血后脱颈椎处死,4℃,3 000 r/min 离心15 min 留取血清保存在-80℃备用,采用全自动生化分析仪测定血清中的总胆固醇 (TC)、 甘油三脂 (TG)、 高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。
1.4.3 血清胰岛素测定 小鼠血清胰岛素浓度采用联免胰岛素试剂盒酶疫法测定,试验方法严格按照试剂盒说明进行。用稳态模型计算各组胰岛素敏感性指数 (HOMA-ISI)、 胰岛素抵抗指数(HOMA-IRI)[9]。
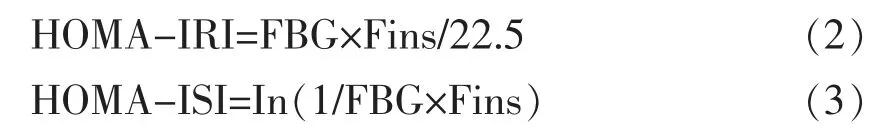
1.5 数据处理
结果用“x±s”表示,采用SPSS16.0 统计软件对结果进行统计分析。服从正态分布且方差齐的数据,采用单因素方差分析,两两比较用Tukey 检验。采用Graphpad prism 7 软件进行绘图。与正常组(NC 组)比较,*P<0.05,**P<001;与模型组(DC组)比较,#P<0.05,##P<0.01。
2 结果与讨论
2.1 驼乳对II 型糖尿病小鼠空腹血糖的影响
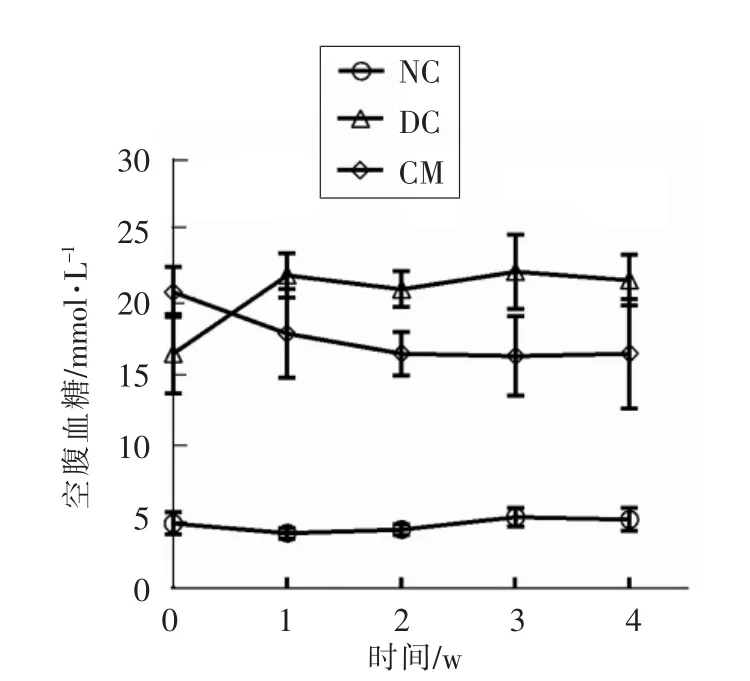
图1 驼乳对糖尿病小鼠空腹血糖(FBG)的影响Fig.1 Variations of mice FBG levels in various groups and time points
图1为驼乳对糖尿病小鼠空腹血糖的影响。从图中可见,正常对照组小鼠的空腹血糖试验期间基本保持一个稳定水平,糖尿病模型组小鼠始终保持较高血糖水平,而驼乳干预组小鼠血糖水平随时间呈下降趋势。到第4 周时驼乳干预组小鼠的空腹血糖值为(16.5000±1.55435)mmol/L,糖尿病模型组小鼠为 (21.6500±0.71543)mmol/L 两者之间存在极显著差异(P<0.01)。以上结果表明,驼乳干预可显著降低糖尿病小鼠空腹血糖。
2.2 驼乳对II 型糖尿病小鼠口服葡萄糖耐量与胰岛素耐量的影响
如图2所示,糖尿病模型组小鼠的葡萄糖耐量水平较正常组严重受损,0,30,60,90 和120 min 时间下模型组血糖值极显著高于正常对照组,而驼乳干预可对小鼠糖耐量有不同程度的调节作用。葡萄糖耐量曲线下面积(AUC),反映了机体总输出葡萄糖情况。如图3所示,灌胃驼乳4 周后驼乳干预组小鼠的糖耐量有明显改善,曲线下的面积显著降低(P<0.05),说明驼乳干预可减少机体葡萄糖输出量。
由图4所示,糖尿病模型组小鼠表现出了胰岛素耐量水平受损,在0,30,60,90 和120 min 时间下,糖尿病模型组血糖值明显高于正常对照组,并且由图5可以发现,与糖尿病模型组相比,驼乳干预可显著降低糖尿病小鼠ITT 曲线下面积(P<0.01)。说明驼乳对小鼠的胰岛素耐量有一定的改善作用。
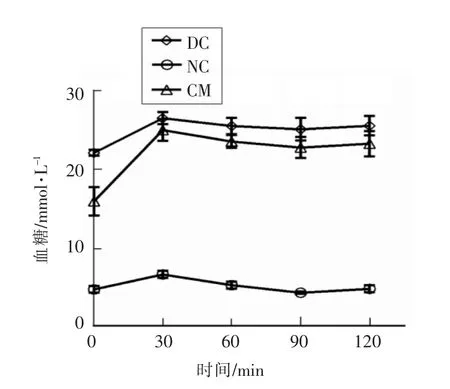
图2 驼乳对糖尿病小鼠口服葡萄糖耐量的影响Fig.2 Effect of camel milk on the glucose tolerance of diabetic mice at various time points
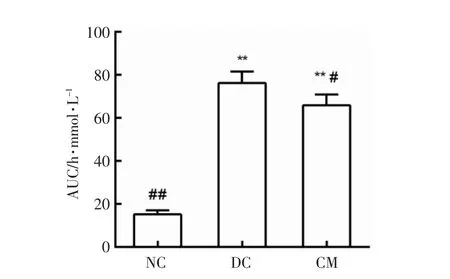
图3 驼乳对糖尿病小鼠葡萄糖耐量曲线下面积的影响Fig.3 Effect of camel milk on the areas under the curve of glucose (AUC)for the diabetic mice
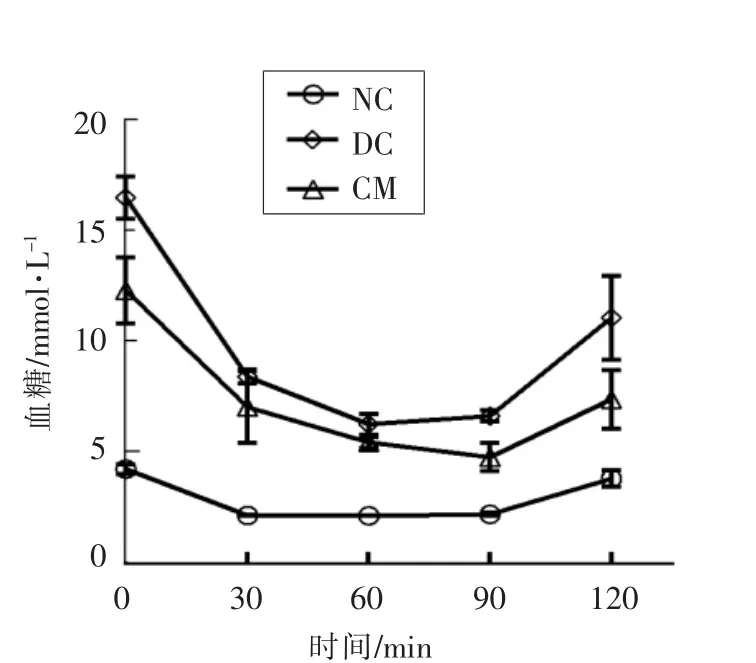
图4 驼乳对糖尿病小鼠胰岛素耐量的影响Fig.4 Effect of camel milk on the insulin tolerance of diabetic mice at various time points
2.3 驼乳对II 型糖尿病小鼠血脂的影响
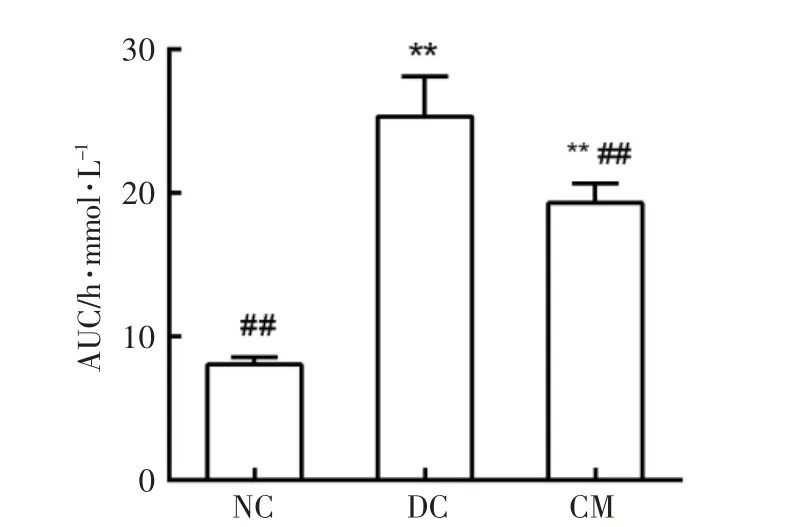
图5 驼乳对糖尿病小鼠胰岛素耐量曲线下面积的影响Fig.5 Effect of camel milk on the areas under the curve of insulin tolerance (ITT)for the diabetic mice
有研究认为HDL-C/TC 可能比单项血脂检测更具临床意义,更有利于评价糖尿病的并发症的危险性[10]。由表1可知,与正常对照组相比,糖尿病模型组小鼠血清中TC、TG 水平显著升高(P<0.05),LDL-C 水平极显著升高,而HDL-C/TC 水平极显著降低(P<0.01),这表明糖尿病模型组的小鼠体内已发生脂代谢紊乱。驼乳干预4 周后,与糖尿病模型组相比驼乳干预组小鼠的TC、TG、LDL-C 水平显著降低 (P<0.05),HDL-C/TC 水平极显著提高(P<0.01)。结果表明,驼乳能有效的改善糖尿病小鼠的脂代谢紊乱,使小鼠血脂逐步恢复到正常水平。并且驼乳对改善糖尿病的心血管并发症有积极作用。
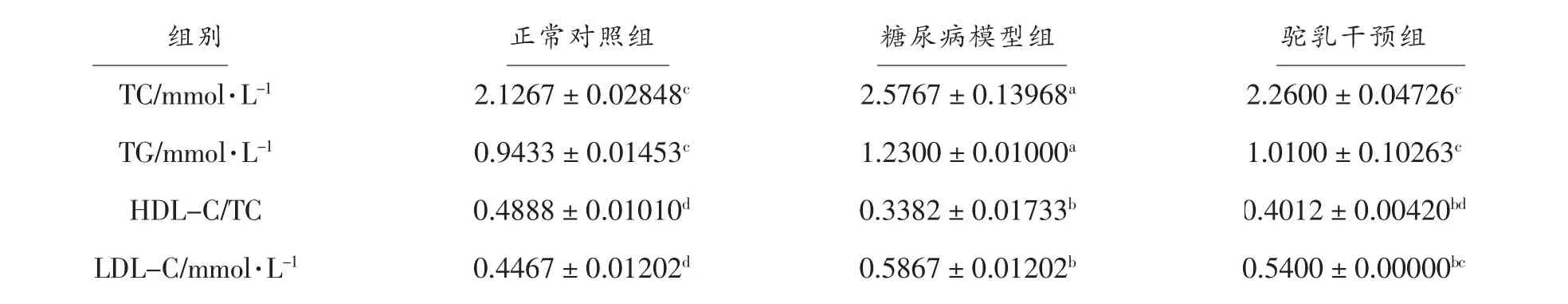
表1 驼乳对II 型糖尿病小鼠血脂的影响Table 1 Effect of camel milk on lipids in type II diabetic rats
2.4 驼乳对II 型糖尿病小鼠血清胰岛素水平的作用
研究发现,STZ 能够破坏部分胰腺组织,造成模型动物胰岛素分泌相对不足,引发高血糖症,高血糖反馈性促进胰岛素分泌,高脂饲养后造成模型组小鼠胰岛素抵抗,进一步加重高胰岛素血症,所以糖尿病模型组小鼠胰岛素水平比正常组明显升高[11]。由表2可知,与正常对照组相比,糖尿病模型组小鼠的血浆胰岛素水平极显著升高(P<0.01),胰岛素抵抗严重。驼乳干预后小鼠的血浆胰岛素水平和胰岛素抵抗指数极显著降低 (P<0.01),胰岛素敏感指数也极显著升高(P<0.01)。试验结果证明,驼乳能够改善糖尿病小鼠胰岛素抵抗的症状。

表2 驼乳对Ⅱ型糖尿病小鼠胰岛素水平的影响Table 2 Effect of camel milk on insulin in type II diabetic rats
3 讨论
目前用STZ 建立糖尿病模型的小鼠品系除最常用的C57BL/6J 外,还有KM、ICR、BALB/C 及CD-1 品系[12]。其中C57BL/6J 小鼠是有腹部肥胖和II 型糖尿病基因倾向的近交系小鼠,具有ob/ob遗传背景。张金宝[13]和伍静[14]分别证实了C57BL/6J 小鼠比ICR、BALB/C、KM、ICR、小鼠敏感性高,同等STZ 剂量下前者成模率高于后者两倍。所以此次试验选用了C57BL/6J 小鼠进行糖尿病模型的建立。
研究发现,胰岛素抵抗(IR)与机体代谢密切相关,是II 型糖尿病的重要病理生理机制。Aida A Korish 等[15-16]报道称,驼乳可有效改善糖尿病大鼠空腹血糖水平、糖耐量状况、以及胰岛素水平。并且作为评估胰岛素抵抗的一个重要参数,驼乳可显著降低HOMA-IR 值[12],本试验结果证明,驼乳干预后的糖尿病小鼠的空腹血糖值、 葡萄糖耐量显著低于糖尿病模型组(P<0.05),胰岛素耐量极显著低于糖尿病组(P<0.01),小鼠的血清胰岛素水平、胰岛素抵抗指数极显著降低(P<0.01),胰岛素敏感指数极显著升高(P<0.01)。近几年来,大量资料表明糖尿病患者在血糖升高的同时还伴随着血脂代谢紊乱的症状。Al-Numair 等[17]发现,驼乳能够显著降低II 型糖尿病大鼠总胆固醇、 甘油三酯以及低密度脂蛋白水平,改善糖尿病大鼠的脂代谢紊乱。本试验结果也表明,驼乳干预后的糖尿病小鼠的血清总胆固醇、 甘油三脂以及低密度脂蛋白含量显著低于糖尿病模型组 (P<0.05),HDL-C/TC 水平极显著提高(P<0.01)。综上所述,驼乳可有效改善II 型糖尿病小鼠的糖脂代谢紊乱以及胰岛素抵抗的状况。
