乙肝病毒基因型、核苷(酸)耐药基因突变对肝硬化、肝癌的影响
2019-05-17雷香菊何雪琴姜雪强
雷香菊,陈 萍#,何雪琴,姜雪强,李 毅,陈 武△
(湖北医药学院附属东风医院:1.医学检验部;2.感染病科,湖北十堰 442001)
乙型肝炎病毒(HBV)是导致肝硬化、肝细胞癌(HCC)的主要原因[1]。目前全球约有2.6亿慢性乙型肝炎(CHB)患者,导致每年20%~30%发展为肝硬化、HCC,约84万人死亡。近年来的研究表明,HBV基因型可能影响CHB患者的临床表现,以及肝硬化、肝癌的发展[2-3];此外,核苷(酸)类药物(NAs)是目前FDA批准的唯一抗HBV化学药物,但易引起耐药性基因突变,导致病毒学、生物化学突破[4-5]。然而,其对CHB患者肝脏病变的影响目前还报道较少[6]。因此,本文调查了本地HBV基因型、逆转录酶区主要耐药基因突变与CHB患者肝硬化、HCC的关系,从而为预防和治疗CHB提供参考。
1 资料与方法
1.1一般资料 回顾性分析2015年4月至2017年12月,在本地住院治疗的540例HBV-DNA定量阳性(DNA拷贝数>1×103/mL)CHB患者,平均(47.8±13.1)岁。根据2015年乙型肝炎防治指南[7],将患者分为慢性乙肝组、肝硬化代偿组、肝硬化失代偿组、HCC组。排除甲、丙、丁、戊型肝炎病毒感染和可能导致肝脏病变的其他疾病,并记录前期NAs用药史。患者于住院期间清晨抽取静脉血送医学检验部,检测HBV基因型和RT区主要耐药基因突变,以及血清透明质酸酶(HA)、层黏连蛋白(LN)、Ⅲ型前胶原N端肽(PCⅢNP)、Ⅳ型胶原(Ⅳ-C)、甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原199(CA199)水平。
1.2仪器设备 荧光定量PCR仪RG-6000(Corbett Research公司)、分子杂交仪HBHM-9000A(广东凯普生物科技有限公司)、基因芯片阅读仪YN2009(深圳亚能生物技术有限公司)、美国Beckman-coulter公司(DxC 600型)生化免疫一体机。
1.3检测方法 血清肝纤维化、肿瘤标记物采用免疫化学发光法测定(美国Abbott诊断公司,500次/盒)。HBV-DNA提取和RT-PCR采用荧光定量试剂盒(广州达安基因股份有限公司,48次/盒);HBV基因型、耐药基因突变类型采用巢式PCR和反向杂交法测定(深圳亚能生物技术有限公司,25次/盒):参照试剂盒说明,在保证显色控制点、阳性质控品正常显色而阴性质控不显色情况下,通过芯片阅读仪判读,得到HBV基因型和耐药基因突变结果,检测的RT区主要突变模式为M204V、M204I、L180M、A181V、V207I、N236T。
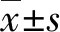
2 结 果
2.1一般性资料 收集的540例HBV-DNA 阳性CHB患者中,19例因未检测出基因型而排除。其他521例CHB患者中,200例有CHB相关肝硬化或肝细胞癌(38.4%),322例无肝脏病变(61.6%)。两者间年龄差异有统计学意义,且4组年龄呈明显递增趋势(F=18.059,P<0.001);两者间性别差异无统计学意义(P>0.05),但男女性HCC比例差异有统计学意义(χ2=7.543,P=0.006)。此外,521例CHB患者中,272例有NAs用药史,249例无NAs用药史,前者肝脏病变率明显低于后者,差异有统计学意义(表1)。
2.2基因型、耐药基因突变与CHB肝硬化、肝癌相关性 521例CHB患者中,检出B、C、D和BC混合基因型分别为323例(62.0%)、187例(35.9%)、3例(0.6%)和8例(1.5%)。由于D型、BC混合型例数较少,因此未计入统计分析。C基因型CHB患者中肝脏病变的比例高于B基因型,差异有统计学意义(P<0.05)。272例有NAs用药史的CHB患者中,113例检出RT区主要耐药基因突变(41.5%),突变型患者中肝脏病变的比例与野生型无统计学意义。见表2。
2.3HBV基因型、耐药基因突变与血清肝纤维化指标的相关性 血清肿瘤标记物水平经取ln对数后均满足正态分布,结果显示:C基因型血清ln、PⅢPNP、Ⅳ-C水平均高于B型,差异有统计学意义(P>0.05);血清HA水平亦高于B基因型,但差异无统计学意义(P>0.05)。在272例有NAs用药史的CHB患者中,突变型各血清肝纤维化指标与野生型差异均无统计学意义。见表3。
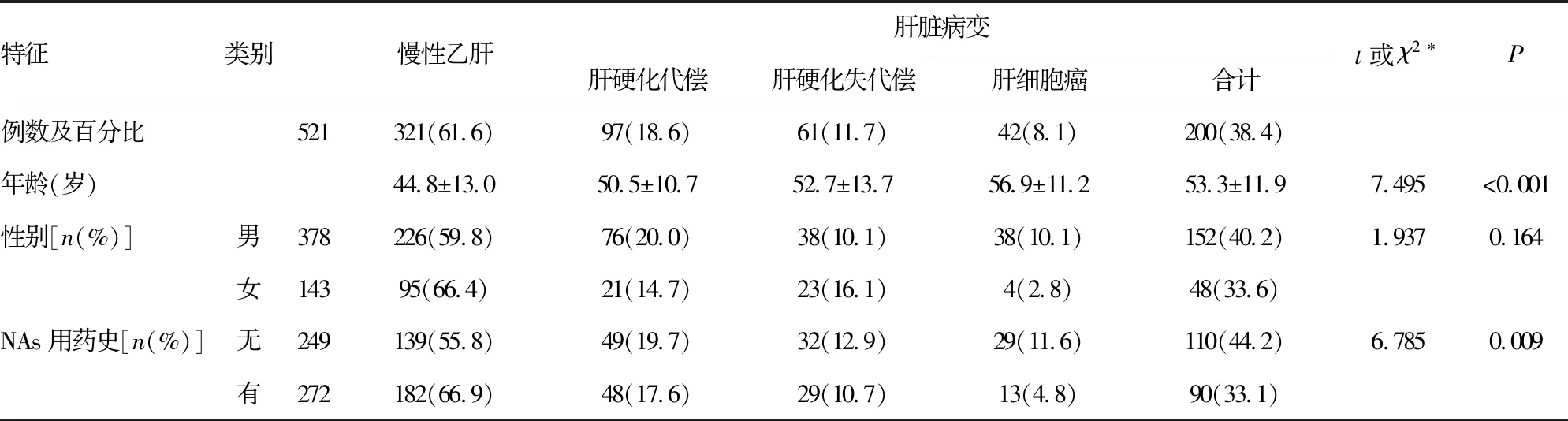
表1 慢性乙肝患者的临床分组和特征
注:*CHB合并肝脏病变患者与单纯CHB患者的比较
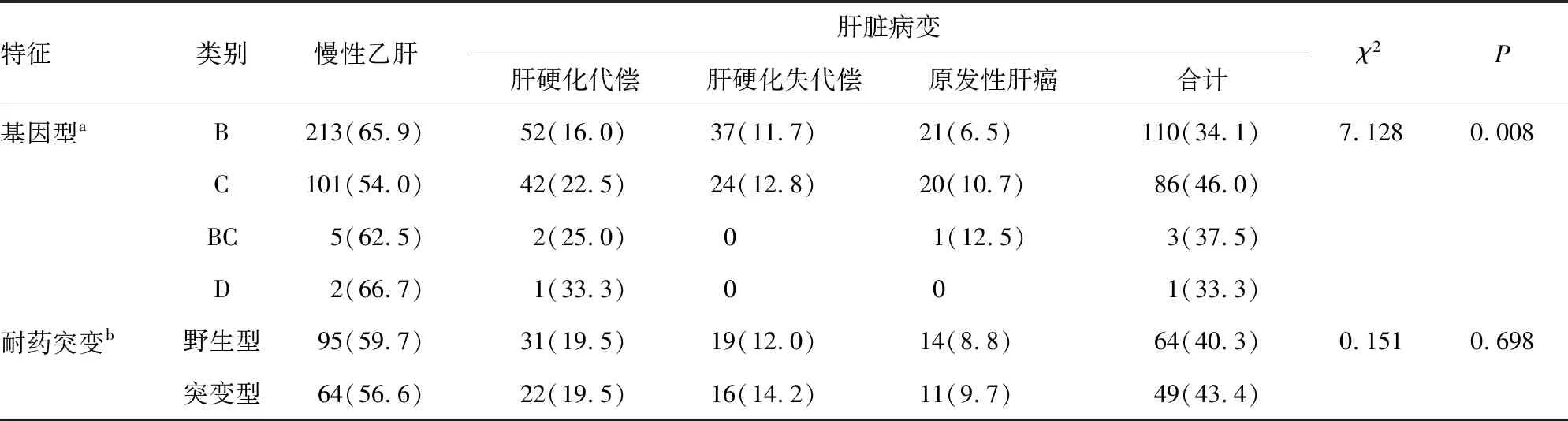
表2 慢性乙肝患者基因型、耐药基因突变与肝脏病变的关系[n(%)]
注:a由于D型、BC混合型例数较少未计入统计分析;b有NAs用药史
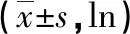
表3 基因型、耐药基因突变与血清肝纤维化指标的关系
注:*有NAs用药史;-表示无数据
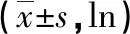
表4 基因型、耐药基因突变与血清肿瘤标志物的关系
注:*有NAs用药史;-表示无数据
2.4基因型、耐药基因突变与血清肿瘤标记物的相关性 血清肿瘤标记物水平经取ln对数后均满足正态分布,结果显示:C基因型CHB患者血清AFP、CA125水平高于B基因型,差异有统计学意义(P<0.05);血清CEA、CA199水平亦高于B基因型,但差异无统计学意义(P>0.05)。而耐药基因突变型各血清肿瘤标记物均高于野生型,但差异均无统计学意义(P>0.05)。见表4。
2.5基因型、性别与血清肿瘤标记物的相关性 由于不同肿瘤的发生率与性别有关,因此本文分别比较了男女性B、C基因型肿瘤标记物的差异。结果表明:男性两基因型只有AFP差异有统计学意义(P<0.05);而女性中两基因型AFP、CEA、CA125差异均有统计学意义(P<0.05);而两者CA199均无统计学意义(P>0.05)。
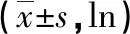
表5 基因型、性别与血清肿瘤标志物的关系
注:-表示无数据
3 讨 论
目前根据HBV全基因组序列差异大于8%,将其分为A~J等10种基因型,且基因型呈明显的地域分布[2]。我国北方及部分南方地区以C型为主,湖北、湖南、江西、福建、台湾等部分地区以B型为主[8]。本地CHB住院患者中,B基因型比例高达63.9%(包括混合型)[9],这对研究B型HBV的特点提供了良好的条件。已有的研究表明,C基因型具有较慢的血清乙型肝炎E抗原(HBeAg)转换、对干扰素治疗不敏感[6]。本文前期的研究也表明:C基因型CHB患者血清HBV-DNA、乙型肝炎表面抗原(HBsAg)、酶学水平高于B型,且更易发生NAs耐药基因突变[9]。然而,其与肝硬化、肝癌的关系还有待调查。
已有的几项亚洲人群的调查显示出不一致的结果:一项对台湾地区2 762例HBV携带者的调查显示,C基因型携带者HCC发生率接近B型的两倍[10];另一项对香港地区CHB患者的调查结果也表明,C基因型是HCC独立的风险因素[11];然而一项对大陆地区9省1 096例HBV携带者的调查,却未发现基因型与肝硬化、HCC有相关性[12];而近年来的一项meta分析则显示:C型HBV携带者发展为肝硬化、HCC的风险分别是B基因型的3.89、4.40倍[8]。本次调查的521例急性住院CHB患者,平均年龄47.8岁,排除不同HBV基因型患者间年龄、性别的差异,结果表明HBV基因型与CHB肝硬化、肝癌临床诊断、血清标记物均有相关性,C基因型相对B基因型肝硬化、肝癌的风险更高,其OR值分别为1.34(1.04~1.73)、1.84(1.04~3.26)。几项对日本、澳大利亚CHB患者的调查也显示:C基因型发展为HCC的年龄更低[13-14],提示年龄、性别、疾病状态可能影响HBV基因型与HCC的相关性,这可能是上述结果不一致性的原因。
另一方面,NAs药物的广泛使用可导致耐药基因突变,然而其对CHB患者肝硬化、肝癌的影响目前报道却较少。本次调查结果显示:在同样有NAs用药史的CHB患者中,耐药基因突变型患者肝硬化、HCC比例与野生型差异无统计学意义,提示RT区主要耐药基因突变与CHB肝硬化、HCC可能无相关性。尽管有研究表明:BCP区突变与HCC有关,但与RT区突变的关系目前尚不清楚[6]。此外,本次调查中还发现有NAs用药史的CHB患者中,肝硬化、HCC比例低于无NAs用药史患者,其OR值为0.75(0.60~0.93),提示NAs抗病毒治疗可降低肝硬化、HCC的发生率;而近来一项大型Meta分析也证实了这一点[15]。
4 结 论
总之,本次从临床症状、实验室指标两个方面调查了521例急性CHB患者,结果表明:CHB患者肝硬化、HCC与基因型有相关性,而与逆转灵酶区主要耐药基因突变无相关性,且NAs用药史与低的肝硬化、HCC发生率有关。考虑到本次调查的例数有限,且主要是住院患者,其结果还有待大规模前瞻性的研究进行证实。由于B、C基因型是我国HBV携带者两种主要的基因型,因此探讨其对肝硬化、HCC的影响对CHB的预防和治疗具有重要意义。
