抑制胞浆型磷脂酶A2γ的表达对乳腺癌细胞迁移侵袭作用的研究
2019-05-17米力坎木哈司木努尔比亚玉苏甫
米力坎木·哈司木,努尔比亚·玉苏甫,田 刚
(1.新疆维吾尔自治区喀什地区第一人民医院药学部,新疆喀什 844000;2.天津市公安医院检验科,天津 300040)
胞浆型磷脂酶A2(CPLA2)家族包含6个胞内酶,其中胞浆型磷脂酶A2γ(cPLA2γ)是 cPLA2家族具有独特结构的成员[1-2]。有报道cPLA2家族的其他成员与结肠、小肠和肺部肿瘤的发生有密切的联系,特别近年来研究发现cPLA2α在乳腺癌侵袭转移中有一定的作用[3-5],但cPLA2γ与肿瘤的关系只处于理论推断上,国内外未见详细的报道。本研究试图从cPLA2γ角度探索乳腺癌侵袭转移的信号传导通路及其对乳腺癌细胞迁移侵袭能力的影响,为遏制此类疾病的发生提供一些有价值的帮助。
1 材料与方法
1.1一般材料
1.1.1组织标本和细胞系 乳腺癌患者组来自新疆维吾尔自治区喀什地区第一人民医院(以下简称“本院”)2015年1月至2017年2月手术切除的139例乳腺癌患者。其对应的乳腺癌旁正常组织标本作为对照组。139例乳腺癌患者的病历资料经住院部病案室查阅,结合随访资料完善基本资料分析。其中乳腺癌患者年龄分布范围为30~65岁,平均(48.8±4.1)岁。入选标准符合世界卫生组织(WHO)的乳腺癌诊断标准。乳腺癌MDA-MB-231细胞株由本院研究所实验中心提供。
1.1.2试剂与仪器 cPLA2γ(圣克鲁斯生物技术公司);cofilin和p-cofilin(细胞信号转导生物技术公司);p-Akt和p-PKCζ (艾博抗生物技术公司);Akt和PKCζ (圣克鲁斯生物技术公司);StealthTMRNA转染试剂盒(大连宝生物);cPLA2γ免疫组化试剂盒(北京中杉生物公司);兔抗人β-actin多克隆抗体(英杰生命技术有限公司)。超净工作台(细胞培养专用,中国安泰生物技术公司);Olympus IX70倒置显微镜(日本 奥林巴斯);转膜仪(伯乐生物医学有限公司);凝胶成像系统 (美国柯达公司);Transwell小室(美国密理博公司)。
1.2方法
1.2.1细胞培养 人乳腺癌细胞系MDA-MB-231常规培养,待细胞进入对数生长期后,用PBS清洗两次,0.25%胰酶消化,用1 mL完全培养基终止消化后吹打为单细胞悬液,接种到6孔板内继续培养准备后续试验。
1.2.2抑制cPLA2γ的表达及其检测 设计3段cPLA2γ靶Stealth siRNA 序列(si#1,si#2 and si#3 siRNA)转染MDA-MB-231细胞,同时用一段无关序列转染MDA-MB-231细胞作为转染对照组(scr表示),未进行转染的细胞作为对照组。48~72 h后裂解细胞,用Western blot检测cPLA2γ的表达情况。用反转录聚合酶链反应(RT-PCR)检测mRNA水平。
1.2.3StealthTM-RNA转染 采用脂质体复合物滴加细胞表面的方法转染,6 h后换成常用RPMI-1640培养液;细胞转染72 h后,取细胞进行下一次转染,细胞经转染两次后进行下一步实验。
1.2.4免疫组化检测cPLA2γ表达 应用免疫组化检测临床乳腺癌标本石蜡切片中cPLA2γ蛋白的表达情况。按照操作说明书进行,染色结果由两名中级职称以上病理科医生采用双盲原则评定。结果判定胞浆出现浅黄至棕黄色颗粒为阳性。
1.2.5划痕实验 6孔培养板每孔接种5×105个细胞孵育过夜,然后用无菌移液枪头在培养皿表面划均匀直线一道。观察划线周边细胞移动距离,分别测量3处取均值绘制曲线。
1.2.6Western blot检测cofilin、PKCζ及其磷酸化抗体和Akt及其磷酸化抗体的表达 细胞培养进入对数生长期,向6孔板中加入细胞裂解液(300 μL/孔,其中PMSF浓度为0.1%),冰上裂解后用10% SDS-PAGE胶进行电泳,分别用cofilin、p-cofilin、PKCζ、p-PKCζ、Akt和p-Akt(ser473和Thr308)的兔抗人单克隆一抗(1∶1 000)室温下孵育2 h,再用过氧化物酶标记的羊抗兔二抗(1∶5 000稀释)室温下孵育30 min。
1.2.7稳定转染MDA-MB-231细胞挑选抑制cPLA2γ表达的克隆细胞 稳定转染MDA-MB-231细胞,欲获得抑制cPLA2γ表达的MDA-MB-231稳定克隆细胞(用shcPLA2γ MDA-MB-231细胞表示),Western blot检测挑选的稳定克隆细胞抑制cPLA2γ表达的效果。shcPLA2γ MDA-MB-231细胞的cPLA2γ蛋白表达比scr MDA-MB-231细胞的明显降低。
1.2.8体内侵袭实验 实验动物采用免疫缺陷SCID小鼠,均来自中科院动物中心,4~6周龄,雌性,清洁级;选取经过筛选的scr细胞和稳定转染有cPLA2γ shRNA的MDA-MB-231细胞,调整细胞浓度为5×106个/mL,悬液20 μL以微量注射器注射于小鼠尾静脉(各10只,分别作为对照组和实验组)。注入小鼠肿瘤细胞后2周观察自发转移和定向转移情况,处死小鼠,取出小鼠的肺,观察脏器表面肿瘤结节数和大小。
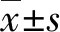
2 结 果
2.1免疫组化检测cPLA2γ在乳腺癌组织中表达 139例乳腺疾病患者中淋巴结转移的89例,淋巴结未转移的50例。在89例淋巴结转移病例中,有80例cPLA2γ表达阳性。然而,在无淋巴结转移的50例病例中,只有4例cPLA2γ表达阳性。两组比较差异均有统计学意义(P<0.01)。配对的正常乳腺组织中无cPLA2γ表达(图1)。提示cPLA2γ的表达与乳腺癌转移具有相关性。本研究未发现cPLA2γ的表达与肿瘤大小和组织学分级有关。
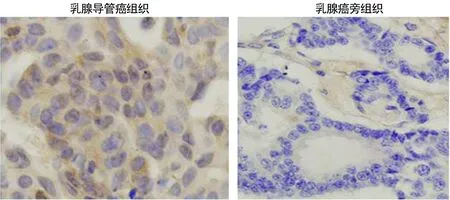
图1 cPLA2γ在乳腺导管癌组织和乳腺癌旁组织中的表达(40×)
2.2StealthTM-RNAi技术分析MDA-MB-231细胞中cPLA2γ表达情况
2.2.1抑制cPLA2γ表达的MDA-MB-231细胞mRNA和蛋白表达水平 转染si#1、si#2和si#3 siRNA的MDA-MB-231细胞cPLA2γ的蛋白表达水平明显比对照组和scr细胞的cPLA2γ蛋白表达水平降低,且si#3 siRNA的效果最明显。RT-PCR结果也同样显示MDA-MB-231细胞的cPLA2γ的mRNA表达水平明显比对照组降低。
2.2.2抑制cPLA2γ表达的MDA-MB-231细胞迁移能力影响 应用小RNA干扰技术瞬时转染MDA-MB-231细胞,抑制了cPLA2γ的表达,细胞迁移和定向运动能力明显比对照组降低(图2)。

图2 瞬时转染MDA-MB-231细胞抑制cPLA2γ的表达抑制细胞迁移
2.2.3抑制cPLA2γ表达对MDA-MB-231细胞周期的影响 流式细胞术分析表明对照组MDA-MB-231细胞G0/G1期为45.3%±3.1%,S期为34.9%±2.9%,G2/M期为20.8%±1.8%。抑制cPLA2γ表达的MDA-MB-231细胞G0/G1期为39.0%±3.0%,S期为35.9%±5.7%,G2/M期为25.1%±3.4%。结果显示抑制cPLA2γ表达的MDA-MB-231细胞S期以及G2/M期生长没有受影响,差异无统计学意义(P>0.05),进一步说明细胞迁移功能的改变不依赖于细胞增殖。
2.3cPLA2γ抑制后细胞侵袭能力变化 计数聚碳酸酯膜中央部分和周围部分5个随机视野(200×)内侵袭细胞的数目,经过统计发现Scr细胞和通过siRNA抑制PLA2γ(sicPLA2γ)/MDA-MB-231细胞平均每个视野侵袭细胞为243.15个和50.12个,sicPLA2γ/MDA-MB-231细胞穿透matrigel胶的能力明显低于Scr组,与Scr组相比侵袭能力下降了79.4%,两组比较差异有统计学意义(P<0.01),见图3。
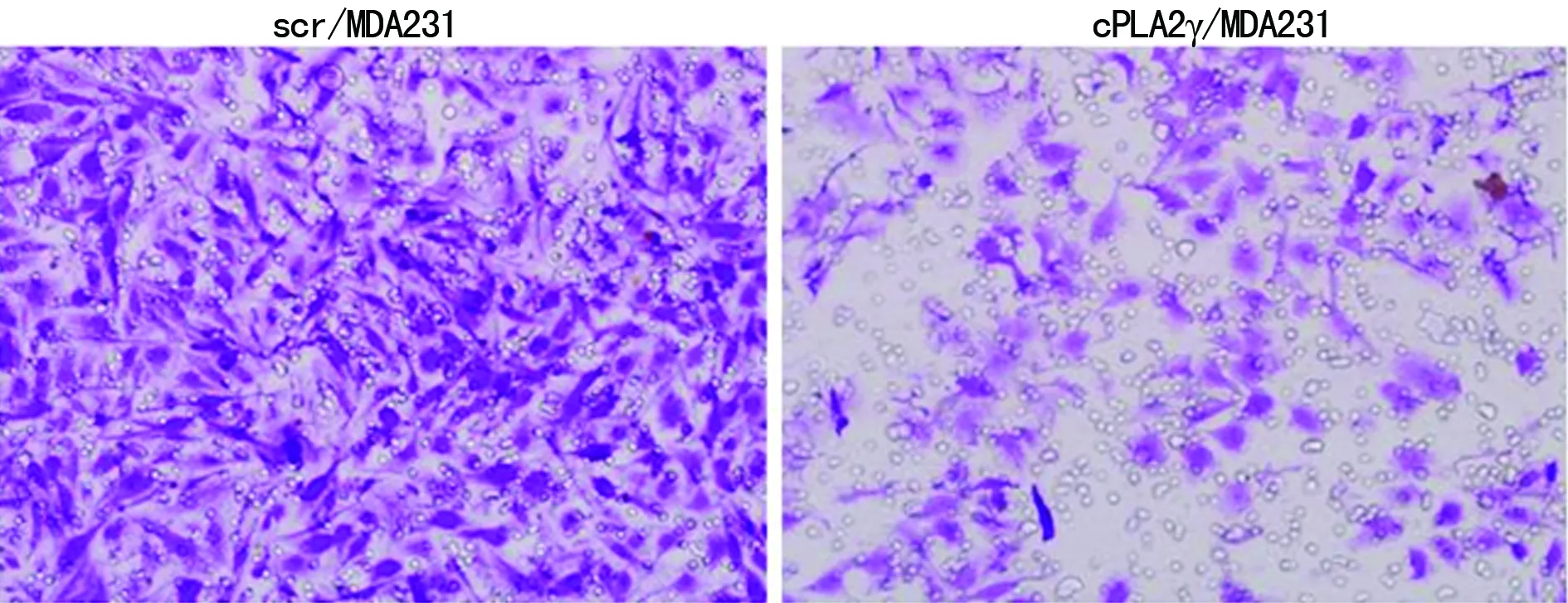
图3 抑制cPLA2γ表达的MDA-MB-231细胞侵袭能力的影响
2.4cPLA2γ调节EGF诱导的细胞信号分子Akt、cofilin和PKC磷酸化活性 在sicPLA2γ MDA-MB-231细胞内,EGF刺激5 min内,cofilin的磷酸化表达水平与对照组相比有明显下降的趋势。Akt在cofilin的信号通路上游,同时检测了EGF诱导的Akt 473和308位点的磷酸化水平,结果sicPLA2γ MDA-MB-231细胞内Akt 473和308位点的磷酸化蛋白表达水平比对照组明显降低。另外Akt也是PKC的上游调节分子,sicPLA2γ MDA-MB-231细胞PKC磷酸化活性明显比对照细胞低。提示抑制cPLA2γ表达对细胞迁移降低作用机制,与PI3K/Akt通路有关。
2.5抑制cPLA2γ表达对SCID鼠体内乳腺癌细胞肺转移的影响 尾静脉注入shcPLA2γ MDA-MB-231细胞的SCID小鼠肺表面的肿瘤结节数明显比对照组注入scr MDA-MB-231细胞的少。两组比较差异有统计学意义(P<0.01)。
3 讨 论
作为近年来发现的cPLA2家族成员之一cPLA2γ具有独特的结构已引起学术界广泛的关注。它是唯一钙离子非依赖型的膜结合磷脂酶A,有两个保守的模序即C端的异戊烯化和N端的十四烷酰化[5-8]。CAAX的法尼基模序的突变将引起其在胞浆内定位的改变。另外cPLA2γ缺乏PLA1的活性,从sn-1和sn-2位脱酰基作用释放油酸、花生四烯酸和其他不饱和脂肪酸。其活性功能的潜在上游信号分子研究的还不十分清楚[9]。但本研究的结果充分体现cPLA2γ在EGF诱导的乳腺癌侵袭转移中扮演着重要的角色。
应用免疫组化的方法发现,cPLA2γ在乳腺癌组织浸润性导管癌中有淋巴结转移的比无淋巴结转移的表达率高。经统计学分析cPLA2γ的表达与临床病理参数的关系可见,cPLA2γ的表达升高与淋巴结转移相关。在不同的乳腺癌细胞系中cPLA2γ的表达(不同于cPLA2其他亚型)是均匀的[10-12]。抑制cPLA2γ表达的乳腺癌细胞不能改变其生长周期,这些与cPLA2γ功能的独特性有关[13]。所有的研究数据表明cPLA2γ在肿瘤的发生和转移中起非常重要的作用。侵袭和转移是肿瘤发生发展的重要环节,抑制癌基因及其受体的表达将是切断肿瘤蔓延生长的根本。本研究发现肿瘤发生的新靶点cPLA2γ将为临床小分子抑制癌细胞生长提供新思路。
以前的文献曾报道PKCζ在乳腺癌迁移中起着非常关键的作用[14]。PKCζ的活化通过PDK1/Akt2/Rictor调节[15]。本研究发现cPLA2γ调节乳腺癌细胞的迁移是通过PI3K/Akt通路。EGF诱导的Akt473、Akt308和cofilin的磷酸化水平在抑制cPLA2γ表达后受到抑制也表明,cPLA2γ可能参与PI3K/Akt通路下游分子的定位和活化。cPLA2γ也可作为抑制肿瘤信号传导集簇应答的新靶点。
对SCID鼠体内乳腺癌细胞肺转移的影响观察可见,鼠尾静脉注射抑制cPLA2γ表达的乳腺癌细胞,SCID小鼠肺表面的肿瘤结节数明显比对照组小鼠少。说明抑制cPLA2γ表达影响了乳腺癌细胞的被动转移和定向转移。临床上抑制肿瘤细胞的目的是延长患者生存期,动物模型实验更进一步阐明cPLA2γ表达与乳腺癌细胞生长及侵袭转移有关,预示其可作为患者生存期延长的关键因子。
4 结 论
cPLA2γ参与EGF诱导的乳腺癌细胞的迁移和侵袭。抑制cPLA2γ表达对乳腺癌细胞迁移起着抑制作用。本研究为进一步阐明乳腺癌侵袭转移机制提供新思路,cPLA2γ的调控与Akt通路有关。Akt信号通路中的靶分子cPLA2γ可能成为肿瘤基因治疗的新靶点。
