迷迭香酸生物学作用研究进展
2019-05-17综述胡志敏审校
李 珂 综述,胡志敏 审校
(武汉市中西医结合医院检验科,湖北武汉 430022)
迷迭香酸(RA)是一种天然存在的水溶性多酚类化合物。它分布广泛,常见于唇形科、紫草科、葫芦科和伞形科的物种,比如迷迭香、鼠尾草和紫苏。迷迭香酸的化学名称是[R(E)]α-〔[3-(3,4-二羟基苯基)-1-氧代-2-丙烯基]氧基〕-3,4-二羟基苯丙酸。(化学结构见图1)迷迭香酸可以由L-苯丙氨酸和L-酪氨酸通过包含苯丙氨酸氨裂解酶和肉桂酸4-羟化酶在内的8种酶合成而来[1],也可以通过咖啡酸和3,4-二羟基苯基乳酸的酯化来化学生产[2],也可以直接从植物中提取。目前,由于RA及其衍生物有着抗炎症、抗氧化、抗抑郁、抗肿瘤和抗微生物等功能,引起了人们对它的兴趣。在临床上,RA能减弱T细胞受体介导的信号传导,减轻过敏性鼻炎、哮喘的症状,还能减缓阿尔茨海默病的发展。不仅如此,迷迭香酸在制药、食品和化妆品等领域也有着巨大的价值。随着迷迭香酸的用途越来越广,其需求量也会进一步扩大。因此,对迷迭香酸进行研究有着重要的现实意义和广阔的市场前景。

图1 迷迭香酸的化学结构
1 迷迭香酸的生产及其衍生物
目前主要通过化学合成、生物合成、酶法合成和植物中提取的方法来制备迷迭香酸。同时也在研究植物生物技术来为RA的生产提供替代系统。
1.1化学法 迷迭香酸的化学合成路线主要有以下3种:(1)以胡椒基氯或胡椒醛为原料合成迷迭香酸及其衍生物,总收率在5%左右;(2)以(S)-酪氨酸为原料经7步反应合成了具有旋光性的(S)-(-)-迷迭香酸,总收率在9%;(3)以甲基作为羟基保护基,以藜芦醛为起始原料,经Erlenmeyer-Plochi反应、水解开环、还原、保护、缩合、脱保护等7步反应,完成(±)-迷迭香酸的合成[3-4](图2)。前两种方法收率较低而且成本高昂,第3种方法将收率提高到了30%。但化学法整体存在得率低、产物光学纯度不高、成本高昂,污染环境等缺点。
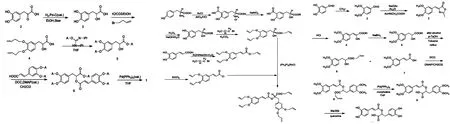
图2 3种合成迷迭香酸的化学方法
1.2生物法 生物合成的途径包括苯丙氨酸和酪氨酸 2 条平行分支途径,在这个过程中有8种酶起到了重要的作用,该合成途径起始于芳香族氨基酸L-苯丙氨酸和L-酪氨酸。苯丙氨酸解氨酶(PAL),肉桂酸-4-羟化酶(C4H)和4-香豆酸CoA-连接酶(4CL)在L-苯丙氨酸脱氨基转化为咖啡酸的过程中起着重要的作用。而 L-酪氨酸则转化为4-羟基苯基乳酸,其中L-酪氨酸转化为4-羟苯丙酮酸(pHPP)涉及了酪氨酸氨基转移酶(TAT)和羟基苯丙酮酸还原酶(HPPR)。生物法的反应条件温和、产物立体选择性高、对环境友好,是一种新的趋势。
1.3浸渍法 将植物研磨后过筛,按其重量的20倍量加入50%乙醇,室温浸泡4 h并搅拌,分离提取液,残渣加入原植物重量的10倍后再加入50%乙醇,室温浸泡6 h并搅拌,分离提取液,离心后过滤除杂。加入抗坏血酸到滤液中,静置6 h后过滤去除沉淀。用dH2O将滤液醇浓度调节至20%,加到聚酰胺柱,用不同浓度的乙醇去洗柱,收集60%乙醇洗脱时的流出液,然后在60 ℃、-0.1 Mpa的条件下减压脱醇浓缩,低温放置析出颗粒状迷迭香酸,最后真空减压干燥结晶[5]。
1.4植物生物技术 当从自然界中提取某种物质变得越来越困难时,植物生物技术可以为其生产提供替代系统。 产生植物化学物质的植物细胞培养物相对于该领域的植物培养物具有几个优点:可以在世界任何地方收集所需产物,同时保持严格的生产和质量控制;不需要除草剂和杀虫剂;避免与气候或生态有关的问题;生长周期较短。然而,尽管具有这些优点,但很少有能够成功生产具有活性化合物的例子,这可能是由于缺乏植物次生代谢及其体外培养的知识和经验。植物生物技术通过鉴定参与生产和控制特定次级代谢产物的生物合成基因和酶,并将其应用于植物次生代谢工程中。对其细胞系的选择、培养基的改良、生物反应器的设计进行优化,配合新的高通量转录分析方法(微阵列,cDNA-AFLP)和蛋白质组学来提高其产量。
1.5RA及其衍生物 最著名的RA衍生物,紫草酸(C27H22O12)是RA和咖啡酸的缀合物。 紫草酸B(C36H30O16)是一种更复杂的咖啡酸酯,存在于紫草科植物中。Eritrichin(C26H20O10)是一种咖啡酸三聚体,最初是从齿缘草的愈伤组织和根培养物中分离出来的。Rabdosiin(C36H30O16)和Sagerinic acid(C36H32O16)是从毛叶香茶菜分离出的咖啡酸的四聚体[6]。从云南鼠尾草中分离出了8种云南酸,云南酸A(C54H46O24)包括云南酸C(C27H22O12)和D(C27H24O12),它们是咖啡酸的三聚体。云南酸B(C54H46O25)是云南酸C的二聚体。云南酸E(C27H24O14)和F(C29H26O14)都是云南酸C的生物遗传衍生物。芳基萘型木脂素酯,云南酸G(C36H30O16)和H(C36H26O16),则是由两个RA分子之间的氧化耦联衍生而来的(图3)。
1.6RA衍生物的生物活性 RA的衍生物紫草酸既能够激活Nrf2-HO-1和Sirt1的表达并抑制INF-γ和IL-1β诱导的p-p38和p-JNK来发挥抗炎和细胞保护的作用;紫草酸也能减少清蛋白尿,脂质过氧化,肾小球肥大和肾小球系膜扩张来治疗糖尿病肾病;还能降低血清中8-羟基脱氢鸟甘酸(8-OHdG)、超敏C-反应蛋白(hsCRP)、细胞趋化蛋白1(MCP-1)的表达,从而预防糖尿病视网膜病变。RA的衍生物Rabdosiin能够减少β-氨基己糖苷酶的表达并激活透明质酸酶,抑制炎症,氧化和癌细胞的转移起到抗炎症和抗过敏的作用;对HIV-1整合酶的活性也有抑制作用,起到抗HIV的作用。

图3 迷迭香酸及其一些衍生物的结构
2 RA的作用
由于RA在作为药物或膳食补充剂时能够在人类健康方面发挥积极的作用,对癌症和动脉硬化等疾病的预防有着极大的潜能,同时RA是一种天然的抗氧化剂,在化妆品领域中也体现出了重要地应用价值,因此对迷迭香酸的研究在过去几年中大幅增加。
2.1抗微生物作用
2.1.1抗细菌作用 RA对细菌具有抑制作用,将接种了金黄色葡萄球菌的菌液分成两组,一组添加0.1 %的RA,一组作为空白对照,每间隔1 h测定其蛋白浓度。试验发现,随着时间的推移,添加了RA的菌液中蛋白浓度远高于空白对照组,因此RA对细菌的细胞膜渗漏有着显著的影响。RA不仅可以改变细胞膜的通透性,致使糖类和蛋白质渗漏从而影响细胞的代谢,而且还可以抑制DNA聚合酶的活性从而干扰DNA的复制[7]。因此对葡萄球菌、铜绿假单胞菌、嗜麦芽窄食单胞菌、粪肠球菌、大肠埃希菌和枯草芽孢杆菌等细菌有抑制和杀菌功能。RA既能抑制革兰阳性金黄色葡萄球菌的活性也能抑制大肠埃希菌的活性,有试验表明,当RA浓度为0.1 %时,涂布了大肠埃希菌的平板上没有抑菌圈产生,而涂布了金黄色葡萄球菌的平板上有直径为14.7 mm抑菌圈产生;当RA浓度达到0.6 %时,大肠埃希菌平板上抑菌圈直径为11.5 mm,金黄色葡萄球菌平板上的抑菌圈直径为34.2 mm,因此可以发现金黄色葡萄球菌对RA更加敏感[8]。另外RA可抑制龋齿链球菌、变异链球菌的生长和生物膜形成,降低它们的葡萄糖基转移酶活性,可用于口腔疾病的预防、治疗。RA的抗微生物功效受pH值与盐的类型和浓度的影响[9]。
2.1.2抗真菌作用 RA对于不同植物病原真菌菌丝生长有抑制作用,可以有效地减少游动孢子的萌发[10],但是对病原菌菌丝生长地抑制活性明显低于对其孢子萌发地抑制活性,而且由于真菌种类的不同,RA的抑制活性也会发生变化。RA的抗菌活性有很强的稳定性,其水溶液在80 ℃水浴30 min或在4 ℃ 贮藏1年其抑菌活性并没有显著变化[11]。
2.1.3抗病毒作用 RA是许多植物的活性成分,从46种草本植物中提取了51个样品,其中45个显示出对MT-4细胞中HIV-1诱导的细胞病变有着显著的抑制作用[12-13]。RA还能直接抑制逆转录并影响早期自然内源性逆转录的不同阶段。RA可以抑制疱疹病毒,其抗病毒活性除抑制病毒生活周期中某些酶活性外,还能迅速与病毒外壳蛋白结合,从而使疱疹病毒失活;RA在酸性条件下与亚硝酸根离子反应得到6-硝基和6,6-二硝基迷迭香酸这两种化合物,可以作为HIV-1整合酶的抑制剂,并抑制人淋巴细胞MT-4细胞中的病毒复制而不增加细胞毒性[14];RA可减少患有日本脑炎病毒的老鼠病死率,显著降低病毒数量和促炎症因子水平,使病毒不易传播[15];核苷类似物对治疗乙型肝炎病毒(HBV)是有效的,但为了防止多重耐药性的产生,新的抗HBV药物的研发也很有必要,而RA则有这个潜力,因为迷迭香酸两端的两个酚羟基和咖啡酸样结构对于抑制ε-Pol的结合至关重要,HBV前基因组RNA的ε(ε)序列与病毒聚合酶(Pol)之间的相互作用是HBV复制周期中的关键步骤,因此,迷迭香酸可以抑制HBV感染细胞中HBV的复制[16]。综上所述,研究RA的抗病毒作用有着重要的现实意义和广泛的市场需求。
2.2抗氧化作用 迷迭香酸的抗氧化能力比维生素E还要强,而它极强的抗氧化能力要归功于它清除体内自由基的能力和防止氧化损伤的本领[17]。研究显示,RA可以与不饱和脂肪酸竞争性地与脂质过氧基结合,从而降低脂质的过氧化速率;RA也能显著降低细胞内活性氧簇的产生,并通过抑制c-Jun氨基末端激酶(JNK)和细胞外信号调节蛋白激酶(ERK)的活化来帮助恢复线粒体膜电位;RA还能抑制中性粒细胞呼吸爆发并减少细胞内钙离子浓度来抑制溶酶体的释放;抑制内皮细胞调节的低密度脂蛋白的氧化。进一步研究发现,迷迭香酸的抗氧化作用和它的结构息息相关,邻二酚羟基在其中扮演了重要的角色,并且C3位的共轭双键具有增效作用[18]。RA的抗氧化作用使其成为了化妆品市场的潜力股。
2.3抗炎作用 研究发现用RA可以用来治疗炎症,对皮肤暴露于佛波酯的小鼠模型进行研究,发现RA介导了中性粒细胞的浸润和髓过氧化物酶活性的抑制,并降低了细胞间黏附分子1(ICAM-1),血管细胞黏附分子-1(VCAM-1)和炎性蛋白-2信使RNA(mRNA)的表达。RA可抑制肾小球系膜细胞增殖和肾小球膨胀,起到抗肾炎的作用;RA可减轻脂多糖(LPS)诱导的肝损伤,降低血浆转氨酶的水平,证明了RA的肝保护作用是通过清除或降低超氧化物或氧化亚硝酸盐水平而不是通过抑制TNF-α而产生的[19];RA能抑制嗜中性粒细胞羁留和间质水肿为特点的肺损伤,起到抗肺炎的作用;RA能抑制胶原诱导的关节炎,有效治疗关节炎并减少受影响关节的数目,起到抗关节炎的作用;RA能够抑制细菌斑块的形成,从而防止慢性牙龈炎,起到抗牙周炎的作用;RA对异位性皮炎又称异位性湿疹或遗传过敏性湿疹有缓解作用,起到抗皮炎的作用。
2.4抗肿瘤作用 RA能增加黑色素的含量和酪氨酸酶的表达,通过激活蛋白酶A(PKA)信号诱导黑色素生成,黑色素在保护皮肤,预防光致癌的过程中起着重要的作用;RA还能通过抑制ERK和Akt的磷酸化来抑制结肠直肠癌地转移;TNF-α可以激活核转录因子NF-κB并诱导炎性反应,而RA能抑制TNF-α 诱导的活性氧(ROS)的产生和NF-κB的活化表达,导致TNF-α诱导的人白血病U937细胞凋亡[20];RA能降低HTA29人结肠直肠癌细胞中TPA诱导的炎症基因环氧酶-2(COX-2)的产生和启动子活性;RA还抑制TPA诱导的转录激活蛋白-1(AP-1)的活性,表明RA可能会有效地预防乳腺癌[21];RA可以降低ROS的水平,同时增加了GSH的产生,抑制了基质金属蛋白酶-2(MMP-2)和MMP-9的表达,从而诱导细胞外基质降解;RA能够抑制鼻咽癌CNE-1细胞增殖并诱导其凋亡,其机制可能与调控PTEN、PI3K/Akt/mTOR信号通路有关[22-23];RA对人多发性骨髓瘤ARH-77细胞的增殖也有较为明显的抑制作用,且在一定范围内,呈时间和剂量依赖性,其机制可能是由于RA 上调了Fas 的表达,引发了凋亡的死亡受体通路[24]。综上所述,RA可以在体外和体内有效抑制肿瘤转移,起到抗肿瘤的作用[25]。
2.5其他作用 紫苏叶具有抗抑郁的作用,而RA是其主要活性成分。RA能很好地保护神经元和起到抗抑郁的作用。RA通过增加线粒体膜势能,抑制caspae-3活性,抗凋亡,也可对脑形成胶质细胞,同时还能抵抗谷氨酸诱导的PC12细胞凋亡[26],RA可促进小鼠海马齿状回颗粒细胞的增殖,推测RA对神经系统也有一定的影响。通过对小鼠进行试验发现,RA能减少被强迫游泳的小鼠的不动性,从而证实RA具有一定的抗抑郁作用[27]。
RA体外可抑制人血小板中丙二醛的形成,其半数抑制浓度(IC50)为3.37 nmol/L,显示RA能够阻止胶原诱导的血小板聚集,促进纤维蛋白溶解活性起到抗血栓的作用。与此同时,RA也是黄嘌呤氧化酶的抑制剂,而黄嘌呤氧化酶是人体产生尿酸过程中的关键酶,也是治疗痛风时的作用靶点,因此,RA有可能成为治疗高尿酸血症和痛风的特效药物[28]。
3 小 结
RA在植物中分布广泛,对它的提取、分离方法研究得比较清楚,因此比较好获得。其次迷迭香酸的稳定性较好,食盐和蔗糖对RA稳定性的没有影响;pH和温度对RA的稳定性影响较小。结果表明,RA更适宜在酸性以及低温的条件下保存使用;光照对RA的影响较大,故在使用时应尽量避光;Ca2+、Mg2+对RA的稳定性影响较大,其他金属离子对RA影响较小,因此使用时应尽避免与钙、镁的接触。同时RA也具有抑菌、抗炎、抗氧化、抗肿瘤、抗病毒和抗抑郁等多种功能且作用明确,所以RA有着广阔的应用前景和市场价值。随着对RA作用机制的进一步研究和对其衍生物的结构优化,RA会在制药、食品、化妆品等领域中有更多的贡献。
