运用全因子试验方法优化单抗生物类似药生产过程中的糖基化分布
2019-05-17张磊杨沐迪董顺刘明秋
张磊 杨沐迪 董顺 刘明秋
(1. 复旦大学生命科学学院,上海 200438;2. 上海博威生物医药有限公司,上海 201318)
蛋白质糖基化对蛋白质的构象、溶解度、稳定性、免疫原性以及生物学活性有较大影响[1]。根据不同的修饰位点,糖基化可分为N-端糖基化和O-端糖基化。对于单抗药物而言,N-端糖基化是最重要的翻译后修饰之一,该修饰起始于内质网,结束于高尔基体,与单抗稳定性、生物学活性、半衰期和免疫原性有关[1]。常见的N-端糖基化修饰包括半乳糖基化、岩藻糖基化和Man5等,不同糖基化修饰的单抗与Fc受体结合能力不同,从而影响药物的生物学活性。例如,通过半乳糖苷酶切掉单抗的半乳糖残基后,单抗补体依赖的细胞毒作用(CDC)活性降低了25%,而高半乳糖基化的单抗能够提高50%的CDC活性[2-3]。此外,具有岩藻糖基化的单抗会降低其抗体依赖细胞介导的细胞毒作用(ADCC)活性[4]。而Man5修饰的单抗不仅血清半衰期短,并且具有较强的免疫原性[5-6],因此,在细胞培养过程中应尽量降低Man5修饰。
在动物细胞培养生产抗体药物过程中,不同宿主细胞、pH、温度、DO(溶解氧)、二氧化碳分压、氨氮浓度等都能影响糖基化修饰过程[7-8]。近年来,越来越多的研究开始关注添加物对单抗糖基化修饰的影响,如在细胞培养中加入天冬酰胺或N-乙酰葡萄糖胺(GlcNAc)均能引起半乳糖基化降低[9-10],而加入半乳糖、锰离子等可提高单抗半乳糖基化[11-13]。另外有研究显示,添加锰离子或甜菜碱能降低Man5[14-15]。目前,针对单抗岩藻糖基化调控的报道较少,基本停留在基因工程改良细胞株阶段。
本研究以表达单抗的CHO细胞为研究对象,在前期开发中其半乳糖基化和Man5均与原研药存在较大差异。通过全因子设计(FFD),在摇瓶培养中考察半乳糖、尿苷、氯化锰和蛋白水解物对细胞生长、单抗产量和单抗糖基化的影响并建立糖基化调控模型。在此基础之上,通过不同规模的反应器培养验证模型最优条件。单抗药物的糖基化调控是生物类似药工艺研发的重点和难点,本研究通过FFD设计优化单抗糖基化分布,从而为生物类似单抗药物的糖基化调控提供重要科学依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 试验用细胞株为CHO-K1细胞,表达抗核因子κ B受体活化因子配体单抗,由本公司提供。
1.1.2 培养基 基础培养基Fed-batch、流加培养基Feed 1、半乳糖、尿苷、氯化锰均购于Sigma-Aldrich公司。蛋白水解物购于Kerry公司。地诺单抗(Prolia,Amgen Inc)作为原研药。
1.2 方法
1.2.1 种子细胞培养 从细胞库中复苏细胞,以0.5×106cells/ mL活细胞密度接种于摇瓶,置于36.5℃、130 r/min和5% CO2的摇床(瑞士科耐Kuhner公司)中培养。每3 d进行细胞传代,作为试验用种子细胞。
1.2.2 批次培养 取对数生长期细胞,以约0.5×106cells/ mL的活细胞密度接种至250 mL摇瓶中,接种体积为50 mL。通过JMP软件设计2个中心点24全因子试验,研究半乳糖(X1)、尿苷(X2)、氯化锰(X3)和蛋白水解物(X4)对单抗糖基化的影响。根据试验设计进行摇瓶试验。培养周期为14 d。每隔1 d取样,进行细胞计数和生化分析。按厂商提供的补料方式进行流加补料。培养结束后收集培养液,于3 000 r/min离心5 min后,取上清,置于-80℃保存待用。
1.2.3 反应器培养验证 选取最优模型条件进行1 L、3 L和15 L反应器(Applikon)培养验证,培养体积分别为0.5 L、1.2 L和8.0 L。反应器参数设置:36.5℃,pH(7.0±0.15),DO 40%,转速 180-250 r/min。通气方式为Drill Hole Sparger,培养过程中不加碱。
1.2.4 测定和分析方法 通过ViCELL-XR细胞计数仪(Beckman Coulter)进行细胞计数和活率分析;氨氮浓度用Nova 400生化分析仪检测(Nova Biomedical);单抗产量采用POROS A/20色谱柱(2.1 mm×30 mm)进行高效亲和色谱检测;上清收获液经rProtein A亲和层析柱纯化后,用糖谱分析色谱柱AdvanceBio Glycan Map(2.1 mm×150 mm)进行单抗糖基化检测,具体分离步骤见产品说明书。其中五聚高甘露糖型(YM)通过检测直接得到,而半乳糖基化(YG)和岩藻糖基化(YF)通过公式计算得出[13]:

G0表示不含半乳糖残基,G1表示含一个半乳糖残基,G2表示含二个半乳糖残基,G0F表示不含半乳糖残基但包含一个岩藻糖残基,G1F表示含一个半乳糖残基和一个岩藻糖残基,G2F表示含有二个半乳糖残基和一个岩藻糖残基。
2 结果
2.1 添加物对单抗产量和糖基化的影响
运用JMP软件进行全因子试验设计(Run1-18)并进行摇瓶培养,基于预试验结果和Gramer[13]报道,试验设计中X1和X2分别选择40 mmol/L和8 mmol/L作为最高浓度,X3和X4根据本公司平台和相关项目经验分别选择4 μmol/L和15 g/L为最高浓度。全因子试验设计和结果见表1,结果显示不同组合的添加物浓度对单抗产量并无影响。但是糖基化分布受添加物浓度的影响有较大变化,其中YG(%)最低值和最高值分别为5.2和15.2,YF(%)最低值和最高值分别为85.1和91.9,YM(%)最低值和最高值分别为8.8和19.7。

表1 半乳糖、尿苷、氯化锰和蛋白水解物对单抗产量和糖基化的影响
2.2 全因子试验设计分析
根据全因子试验设计(Run1-18)结果(表1),采用JMP软件分别对响应变量YG、YF和YM进行最小二乘法分析建模。发现YG和YM出现失拟,需加入二次平方项;根据JMP软件支持曲线拟合的特性,试验增加随机组Run19、Run20(评估系统误差)和Run21加入模型。
各因素对YG、YF和YM的影响(P< 0.002)经JMP软件拟合得到的回归方程模型分别为:

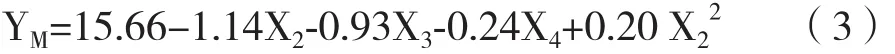
从式(1)可知,X1、X2和X3均对YG有显著正向影响,但平方项X12系数为负,方程的抛物面开口向下,对于X1存在极大值点。式(2)显示X4和二阶交互X3X4能够显著提高YF,但X2和X3对YF有负向影响,需要控制X2和X3的浓度以降低对YF的不利影响。对于YM,X2、X3和X4有显著负向影响(式3),但平方项X22系数为正,方程的抛物面开口向上,对于X2存在极小值点。
全因子试验结果采用JMP软件进行方差分析,结果(表2)显示YG、YF和YM的回归方程模型无失拟(Lack Of Fit)(P>0.05),表明模型对实验的拟合有效。调整R2(R2Adj)与相关系数R2接近且R2>0.9,说明所有模型拟合度良好。

表2 回归模型拟合度分析
原研药的平均YG、YF和YM值分别为13.9%、93.0%和8.6%,而空白对照组(表1,Run1)为5.2%、89.4%和17.5%,两者单抗糖基化分布分别相差8.7%、3.6%和8.9%。为了减少与原研药糖基化修饰的差异,需要提高YG、YF并降低YM。根据式1,当X1在20-25 mmol/L时YG有极大值,结合中心点实验结果选择最优X1浓度为20 mmol/L。根据式2,当X2在2-4 mmol/L时其Man5有极小值,选择2 mmol/L作为最适X2浓度。结合式2和式3,当X4为15 g/L时能最大化提高YF并降低YM。为了尽量减少X3对YF的不利影响(式2),通过JMP软件进行求值,得到最优 X3的浓度为 1 μmol/L。该条件下 YG、YF、YM预测值分别为11.4%、90.9%和9.6%,与原研药差距分别为2.5%、2.1%和1%。
2.3 添加物对细胞密度和YM的影响
在细胞培养生产过程中,活细胞密度是单抗产量的重要决定因素。为了考察不同添加物对最终活细胞密度的影响,将各实验组(Run1-18)按添加物情况进行分组,并通过双样本t检验对数据进行统计学分析。结果(图1)显示添加X1实验组(P=0.43)和添加X3实验组(P=0.74)均不影响最终活细胞数,而添加X2实验组(18.6±1.4)最终活细胞数低于无X2组(20.9±2.6)(P=0.04)。此外,添加X4实验组(21.7±2.3)最终活细胞数高于无X4组(18.1±0.8)(P=0.01),该结果表明添加X4有利于细胞生长。

图1 加入蛋白水解物对最终活细胞数的影响
Pacis等[14]报道过氨氮浓度和YM之间存在正相关性,因此有必要对培养过程中的氨氮浓度和YM之间关系进行系统的分析。根据模型优化的结果(式3),高浓度X2会提高YM,将添加X2实验组(5.6±0.75)和无X2组(3.9±0.56)的最终氨氮浓度进行双样本t检验,两组存在显著差异(P<0.000 1),表明加入X2能显著提高培养液中氨氮浓度(表3)。将收获时氨氮浓度与YM进行作图,发现有一定正相关性(图2-A)。由于添加物X4可产生氨氮并降低YM,为了确认X2的影响,将添加X4的实验组去掉,氨氮浓度(x)与YM(y)接近线性相关(y=0.285 5x+0.414 7,R2=0.815 1)(图 2-B)。
2.4 反应器培养验证
选取最优添加物浓度(X1为20 mmol/L,X2为2 mmol/L,X3为 1 μmol/L,X4为 15 g/L)在 1L、3L、15L反应器(BR)中进行模型验证,结果显示不同规模反应器之间细胞生长,细胞活率和单抗产量基本一致(图3)。无X4条件(1L-BR*)其培养第8天之后活细胞数逐渐低于其他实验组(图3-A),但最终细胞活率维持较高(图3-B)。另外,所有实验组的单抗产量并无明显差异(表4)。推测添加X4虽能提高活细胞数,但也会导致培养后期营养物质缺失,因此后续试验有必要对流加补料工艺进行进一步探讨。不同规模的反应器(1/3/15L-BR)中糖基化分布基本相同(表4),以15 L反应器为例,其YG、YF、YM实际值分别为11.2%、91.4%和8.2%,其中YG和YF与模型预测值差异小于0.5%,而YM差异为1.4%。同空白对照组(Run 1)相比YG、YF分别提高了6.0%和2.0%,而YM降低了9.3%,说明添加物能够有效改善单抗糖基化分布。无X4条件(1LBR*)相比于15 L反应器其YF下降了6.9%,而YM提高了6.1%,该试验结果与模型预测公式一致(表 4)。

表3 尿苷对氨氮浓度的影响

图2 细胞收获液中氨氮浓度和YM水平的关系,所有实验组(A)与仅考虑X2实验组(B)
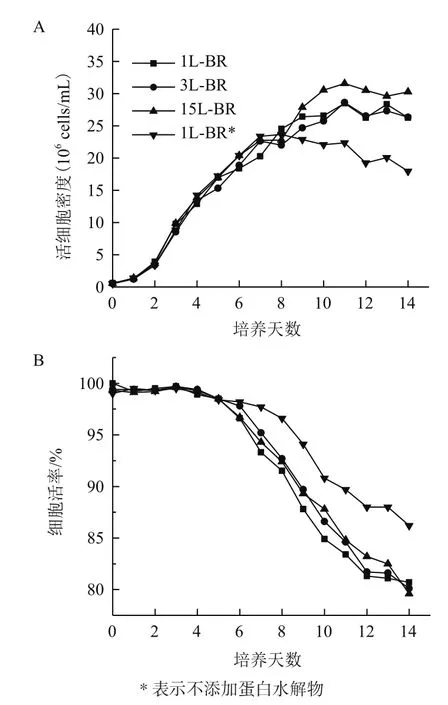
图3 不同反应器规模中活细胞密度(A)和细胞活率(B)
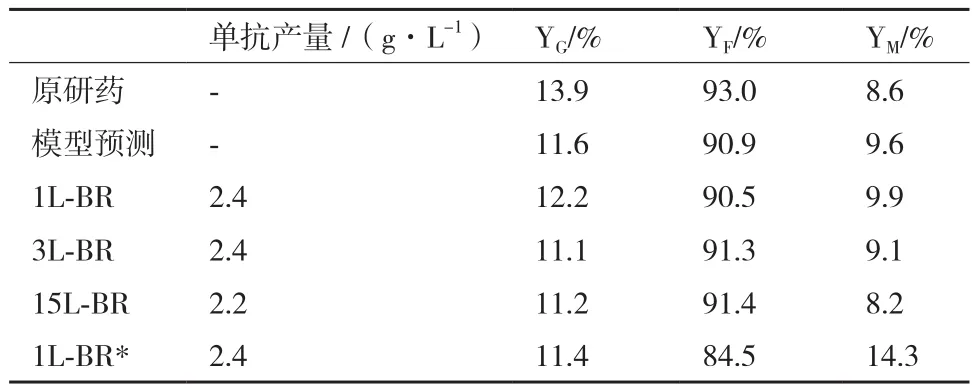
表4 反应器中单抗产量和糖基化分布
3 讨论
生物类似药相比新药研发投资小,成功率高。欧洲药品管理局在批准第一个生物类似药-红细胞生成素之后,陆续开始批准更多的生物类似药[16]。面对竞争日益激烈的生物药市场,如何快速获得安全、有效的生物类似药至关重要。而单抗糖基化修饰不仅影响单抗的结构、活性以及药代动力学,更是单抗药物重要的质量属性,因此在细胞培养过程中需要严格控制。在本研究中,通过添加半乳糖、氯化锰和尿苷均能有效提高单抗半乳糖基化。但同时发现,较高浓度的半乳糖却难以进一步提高单抗半乳糖基化,这与之前的报道一致。在Gamer等[13]的研究中,将半乳糖和氯化锰的浓度分别从40 mmol/L和0.016 mmol/L提高到100 mmol/L和0.04 mmol/L后,仅提高了2%半乳糖基化。另外较高浓度半乳糖会导致渗透压升高,抑制细胞生长。不仅如此,St Amand等[12]发现,较高浓度的半乳糖和氯化锰还能影响蛋白产量,同时引起Man5增加。为了进一步提高单抗半乳糖基化的优化空间,可以选择半乳糖的替代糖源,Hossler等[17]发现松三糖或乳糖可提高半乳糖基化并降低Man5。
本研究发现较高浓度的尿苷可导致Man5增加。加入尿苷的摇瓶最终氨氮浓度偏高,并且伴随着Man5的增加,说明氨代谢与Man5存在内在联系。该结果与Pacis[14]试验结论一致。氨氮是尿苷最终分解代谢产物,浓度过高会加重氨代谢负担,引起鸟氨酸积累从而导致Man5增加[15]。另外,氨氮对蛋白糖基化的影响因素还包括:(1)影响UDPGlcNAc转运蛋白活性[18];(2)提高细胞内pH,影响高尔基体内糖基化酶的活性[19];(3)降低β-(1,4)半乳糖苷转移酶的表达,在细胞培养中添加15 mmol/L氨氮浓度能降低40%半乳糖基化[20]。因此用尿苷进行糖基化调控,需要摸索最适作用浓度。
蛋白水解物是蛋白经过酶水解之后得到的多肽混合物,是一种常用的细胞培养添加剂[21]。本研究加入的蛋白水解物可促进细胞生长,且对单抗产量基本无影响,与之前Spearman[22]的研究结果一致,但该报道中蛋白水解物不影响蛋白糖基化。根据Ho等[23]的研究,蛋白水解物可提高半乳糖基化。而本研究所使用的蛋白水解物可提高岩藻糖基化并降低Man5。该现象可能与不同水解物的来源和生产工艺有关。通常认为,蛋白水解物能为细胞提供较好的氧化还原环境,使得细胞内各个细胞器能够正常工作。例如,加入具有抗氧化作用的还原性谷胱甘肽能降低Man5[15]。由于蛋白水解物产品存在批次差异,会导致最终单抗药物质量不稳定,所以大多数生物制药企业对蛋白水解物的使用持谨慎态度。但越来越多的水解物生产商推出了成分明确的蛋白水解物产品,如BD Recharge,该类水解物批间差异小,适合商业化生产。后续研究应考察该类蛋白水解物对于糖基化修饰的影响。
4 结论
在重组CHO细胞培养过程中,通过加入半乳糖、尿苷和氯化锰能够显著提高半乳糖基化,其中尿苷过量会提高Man5。而添加蛋白水解物能降低单抗Man5并提高岩藻糖基化。本研究成功利用上述添加物将生物类似药的糖基化水平调控至与原研药相当。本研究所使用的添加物对单抗产量基本无影响,却能极大地改善单抗糖基化分布,适用于已有的细胞培养工艺基础上进行糖基化调整。
