生物学标志物联合检测在前列腺癌诊断及鉴别诊断中的价值研究
2019-05-17孙冉李玉梅
孙冉,李玉梅
(河南省南阳市第一人民医院 病理科,河南 南阳 473000)
前列腺癌属于一种好发于中老年男性的上皮性恶性肿瘤,由于该病早期缺乏典型症状,多数患者确诊时已处于中晚期,错过了最佳治疗时机[1]。目前生物学标志物诸如高分子量角蛋白(34βE12)、P63、α-甲酰基CoA消旋酶(P504S)、Ki-67等为前列腺癌诊断中常见免疫组化标志物,但经临床实践发现,将34βE12、P63、P504S、Ki-67单独进行检测时存在与病理学诊断不符合现象[2]。因此有研究指出,将各生物学标志物联合检测可能提升前列腺癌鉴别诊断效能[3-4]。鉴于此,本研究将进一步分析 34βE12、P63、P504S、Ki-67联合检测在前列腺癌诊断及鉴别诊断中的价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年10月- 2018年9月本院治疗的137例前列腺疾病患者临床资料,依据穿刺活检检查结果将其分为两组,将65例前列腺癌患者临床资料分为观察组,72例良性前列腺疾病(慢性前列腺炎42例、前列腺增生患者30 例)患者临床资料分为对照组。观察组患者年龄45~86 岁,平均(62.41±3.17)岁;病程8个月~6年,平均(3.20±1.14)年。对照组患者年龄43~84岁,平均(62.34±3.15)岁;病程8个月~7年,平均(3.25±1.12)年。两组一般资料比较差异无统计学意义(P >0.05),具有可比性。
1.2 入选标准
1.2.1 纳入标准 ①入选者临床资料、病理资料较为完整;②入组前均未接受手术、放化疗等治疗;③患者加入研究时知情研究内容,并签署知情同意书。
1.2.2 排除标准 ①伴有精神疾病史,认知、理解功能异常者;②患有其他恶性肿瘤者。
1.3 方法
采集入选者电切或穿刺活检的前列腺标本,通过二分步法(免疫组织化学法)测定34βE12、P63、P504S、Ki-67水平,其中石蜡标本切片厚度4 µm,常规脱蜡,检查各项操作严格依据抗体说明书进行。鼠抗人多克隆抗体34βE12抗体及鼠抗人多克隆抗体P63抗体、兔抗人多克隆抗体P504S抗体、试剂兔抗人多克隆抗体Ki-67抗体分别由Abcam公司及北京中杉金桥生物技术开发有限公司提供。依据34βE12、P63、P504S、Ki-67于前列腺癌组织中的表达判定结果,其中细胞核出现棕黄色、棕褐色及黄色颗粒则可判定为阳性,若上述部位出现少部分着色或未着色则判定为阴性。
1.4 评价指标
对比两组34βE12、P63、P504S、Ki-67阳性率。判定标准:P63:阳性信号定位在基底细胞细胞核,呈褐色颗粒,有棕色颗粒为阳性(+),无棕色颗粒为阴性(-);P504S:阳性信号定位在上皮细胞细胞质中,呈棕黄色颗粒状,着色细胞<25%为棕色颗粒细小、稀少为灶性阳性;着色细胞≥25%,棕色颗粒粗大、密集为阳性(+),无着色细胞为阴性(-);34βE12:阳性信号定位在基底细胞质和细胞膜,基底细胞呈棕黄染色为阳性(+),无染色为阴性(-);Ki-67:阳性信号定位在基底细胞细胞核,呈棕黄染色为阳性 (+),无染色为阴性(-)。
1.5 统计学方法
应用SPSS 22.0软件对数据进行统计学分析,计数资料以百分比(%)表示,比较采用χ2检验;计量资料以均数±标准差()表示,比较采用t检验。P <0.05为差异有统计学意义。
2 结果
与对照组比较,观察组34βE12、P63阳性率较低,P504S、Ki-67阳性率较高,差异有统计学意义(P <0.05)。见表 1。
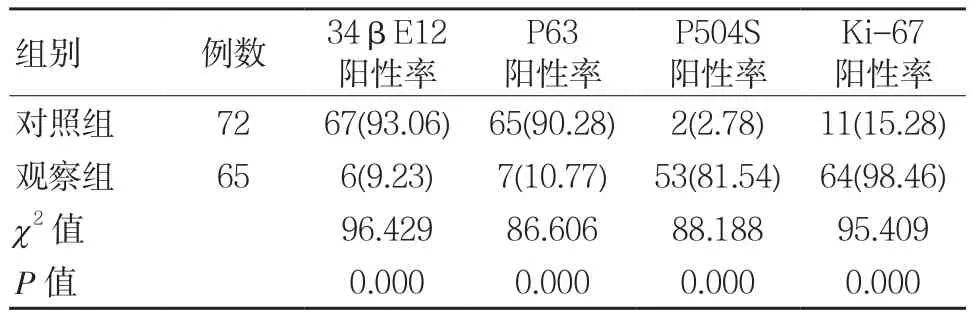
表1 两组34βE12、P63、P504S、Ki-67阳性率比较 例(%)
3 讨论
前列腺癌作为男性泌尿生殖系统常见的恶性肿瘤,近年来由于诊断技术的提升、饮食结构的改变及人均寿命的延长,临床前列腺癌患病率逐年上升,而如何早期诊断、鉴别诊断前列腺癌已成为临床关注的重点[5]。目前前列腺穿刺活检为前列腺癌诊断中的金标准,但由于针吸活检穿刺标本直径小,若组织标本丢失或染色失败,重做难度较大[6]。
目前部分良性病变与恶性病变间差异较小,两者组织学特征相似,极易造成误诊或漏诊现象,故为提升前列腺疾病诊断准确率,结合一些免疫标志物检测结果作为辅助,对诊断、鉴别诊断前列腺疾病具有重要影响[7]。34βE12作为一种细胞角蛋白,其分子量较高,可稳定于正常细胞膜上,在正常的前列腺基底细胞、腺泡上表达较高,由于多数前列腺癌患者具有基底细胞缺如现象,故前列腺癌患者组织中34βE12表达较少或不表达[8]。经研究发现,34βE12利于辨别基底细胞(正常前列腺组织)且特异度较高,为目前基底细胞常用的标记物,同时34βE12还可通过前列腺疾病组织基底细胞是否出现阳性着色或着色特点来判断非癌、癌组织中是否存在基底细胞,进而可对前列腺疾病良恶性进行鉴别诊断[9]。P63为P53家族成员,多在前列腺组织基底细胞中表达,前列腺癌组织多以基底细胞缺如为主要表现,故可通过对基底细胞存在与否判定前列腺疾病良恶性[10]。经研究证实,少数前列腺癌组织中存在P63不连续阳性表达,而这表明前列腺癌组织中存在残留基底细胞,而慢性前列腺炎、前列腺增生组织基底细胞中P63表达可呈阴性,则反映出良性前列腺组织基底细胞伴有不连续或缺如现象,故P63表达阴性无法作为前列腺癌诊断指标。P504S作为细胞质蛋白,多存在于线粒体、过氧化物酶体内,参与了脂肪酸β-氧化过程,P504S在前列腺癌患者中阳性表达率较高,且伴有弥漫性高表达,在前列腺癌诊断中发挥了重要作用[11]。Ki-67作为评估恶性肿瘤增殖活性抗原,其位于细胞核,Ki-67表达水平随着细胞周期的改变而出现相应变化,Ki-67于G0、G1期不表达,随后表达水平上升,并于M期时达到顶峰,随后于有丝分裂后期降解消失,目前Ki-67为影响前列腺癌预后的独立因素,对评估患者生活质量、预后具有重要影响。龚德霖等[12]研究中观察了P504S、34βE12、CK5/6、P65联合检测在前列腺良恶性病变诊断中的应用价值,结果得出,P504S、34βE12、CK5/6、P65作为前列腺良恶性疾病诊断中敏感指标,但将P504S、34βE12、CK5/6、P65联合检测更有助于提升前列腺癌诊断的准确性,降低漏诊、误诊几率,为前列腺良恶性病变诊断提供确切依据。本次研究结果显示,与对照组相比,观察组34βE12、P63阳性率较低,P504S、Ki-67阳性率较高,由此可见,34βE12、P63作为前列腺良恶性疾病诊断中的常用标记物,P504S、Ki-67则为前列腺癌中特异度、敏感度较高的肿瘤标记物,故将其单独用于前列腺癌诊断、鉴别诊断中具有一定的局限性,应将34βE12、P63、P504S、Ki-67联合检测以提升前列腺癌诊断效能,提高疾病检出率,降低误诊、漏诊几率,进而可为临床治疗方案的制定提供帮助。
综上所述,34βE12、P63、P504S、Ki-67作为前列腺癌诊断中的重要生物学标志物,联合检测利于提升前列腺癌诊断及鉴别的准确性。
