细胞治疗产品的工艺平面与厂房设施的设计
2019-05-16陈国笋
陈国笋
摘 要 细胞治疗产品的制备分为载体物质制备和CAR-T细胞终产品制备两大部分,笔者阐述了其工艺平面,如房间布局和人流、物流等要求。重点以CAR-T细胞终产品为例,介绍了其工艺设备和厂房设施的设计要求。
关键词 细胞治疗产品 厂房设施设计 工艺平面 嵌合抗原受体T细胞
中图分类号:TQ460.8 文献标志码:C 文章编号:1006-1533(2019)09-0071-03
Design of process layout and plant facilities for the production of cell therapy products
CHEN Guosun
(Shanghai Macroprocess Lustration Technology Co., Ltd., Shanghai 201100, China)
ABSTRACT The preparation of cell therapy products can be usually divided into two parts including vector preparation and CAR-T cell final product preparation and its process layout requirements such as the room layout and flows of personnel and materials were described. Meanwhile, focusing on the final product of CAR-T cell as an example, the design requirements for its process equipment and plant facilities were also introduced.
KEY WORDS cell therapy product; facility design; process layout; chimeric antigen receptor T cells
近年来,细胞治疗产品的研发与临床应用发展迅猛,尤其是嵌合抗原受体T细胞产品(CAR-T细胞产品)。CAR-T细胞产品对多种血液肿瘤有着非常好的临床疗效,而且对实体瘤治疗也有着非常大的潜力[1]。2017年美国批准了2个CAR-T细胞产品上市,然而,细胞治疗还是一个新兴领域,它的技术成熟度和产业化还有待进一步的摸索和发展。笔者参与了多个细胞治疗产品的产业化项目,结合积累的经验,针对以CAR-T细胞产品为代表的细胞治疗产品的工艺平面和厂房设施的设计进行探讨。
1 细胞治疗产品的工艺特点
一个典型的CAR-T细胞产品的生产工艺流程,主要分为如下几个步骤:血样-T细胞分离-基因修饰-细胞扩增-检验放行[2]。结合CAR-T细胞产品生产工艺和无菌药品的特性,可以总结此类产品及其工艺特点为:①属于个性化产品,批量小,自动化操作难;②个体差异大,产品质量一致性难;③生产过程需无菌操作,属于非最终灭菌的无菌产品,也不能无菌过滤;④生产周期长,约2周[3]。
2 工艺平面的探讨
CAR-T细胞产品的制备包括基因载体物质的制备和CAR-T细胞终产品的制备这两大生产环节。同时,载体物质的制备又包括了质粒载体制备和病体载体制备工艺过程[4]。所以,完整的CAR-T细胞产品的生产车间分成3个区域,分别为质粒制备、病毒载体制备和CAR-T细胞终产品制备区域。部分厂家可能将载体物质的生产委托给其它有条件的厂家进行生产,或直接外购,这样仅需CAR-T细胞终产品制备区域。除了生产区域,还需包括质控区和储存区,质控区包括支原体、内毒素、無菌、微生物限度、阳性对照、流式细胞仪和分子生物学等相关检测,储存区包括病毒、菌种和细胞储存。
2.1 CAR-T细胞终产品制备区域
CAR-T细胞终产品制备区域,包括了血液样本接收区、准备区、细胞操作区、辅助区、人流更衣、物料缓冲等区域(图1)。血液样本接收区,是用于外来血液样本的接收和登记,并传递到准备区的区域。准备区,是用于血样样本的初步处理以及该批所需原辅料和一次性材料的领取和准备的区域。另外,准备区还用于血液样本、原辅料和一次性材料的暂存,所以需要配备一定数量的货架和冰箱。辅助区,主要包括工器具清洗灭菌、洁净服清洗灭菌、洁具清洗或灭菌、生物废弃物的灭活等的区域。通常,辅助区与准备区可共用1个区域,洁净级别为C级。
细胞操作区,是用于进行CAR-T细胞产品的生产操作区域,包括T细胞分离、基因修饰、细胞培养扩增、制剂分装等。1个细胞操作间,同一时间只能生产1个批次的产品,细胞操作时间约2~3 h,培养时间约10~15 d。如果生产过程中为非全封闭操作,则应该在生物安全柜之内进行,房间环境洁净级别为B级。细胞操作区的人员更衣,建议进出通道分开,以避免交叉污染。生物废弃物收集到密闭的袋子或容器,经废物通道转移到C级区,使用双扉式湿热灭菌柜进行灭活处理。
此外,还需1个产品传出通道和1个取样样品的传出通道。产品传出洁净区后,进行成品外包装操作。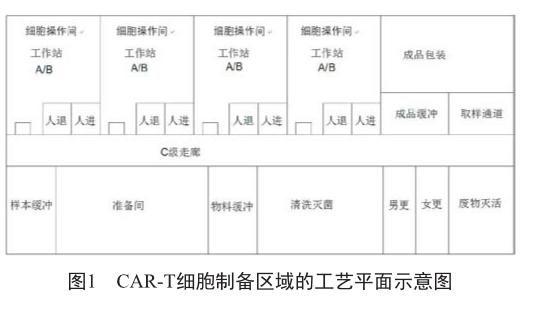
如果建筑面积允许,细胞操作间的物流可以设计成单向流,废弃物的退出通道与产品和生产物料的洁净通道分开,设立独立的废弃物走廊和废物灭活房间,这样可以最大限度地减少交叉污染,也可便于生产管理。
如果产品的批次多,可以设立独立的细胞培养间,细胞在细胞操作间处理之后,转移至细胞培养间的培养箱培养。细胞操作间也可相应缩小面积,物料的减少也便于批次之间的清场管理。
2.2 病毒载体制备区域
病毒载体制备区域,包括了細胞培养、病毒传染、病毒载体纯化和产品灌装以及辅助间、人流更衣、物料缓冲、废弃物灭活等区域(图2)。房间的洁净级别,除了产品灌装为B级外,其它为C级。另外,生物安全等级,
2.3 质粒制备区域
质粒制备区域,包括了细菌菌种接种、发酵、收获、质粒提取纯化和产品灌装以及辅助间、人流更衣、物流缓冲、废物灭活等区域。房间的洁净级别,除了产品灌装为B级外,其它为C级。另外,生物安全等级,需根据细菌特性而定,一般设计为生物安全等级2级。质粒制备区域的工艺平面,与病毒载体制备区域类似。
3 厂房设施的设计
本文以CAR-T细胞终产品的制备区域为例,对工艺设备和厂房设施的设计要求进行阐述。病毒载体制备区和质粒制备区的厂房设施的要求,与疫苗车间类似。
3.1 工艺设备
CAR-T细胞产品的制备需要进行血液细胞的分离和纯化,其工艺设备分为开口式和封闭式。目前封闭式的设备,有德国Miltenyi Biotec公司的CliniMACS Prodigy、GE公司的Biosafe Sefia、Cesca公司的CARTxpress等,它们均采用灭菌过的一次性材料。
细胞操作(分离和纯化),如存在非全封闭式操作,则需要在生物安全柜A级保护下进行,其房间洁净级别为B级。然后在CO2培养箱内进行细胞培养。
血液样本接收之后可能需要暂存,所以在准备间需配置2~8 ℃的冰箱。
CAR-T细胞产品进行制剂分装之后,也需2~8 ℃的冰箱进行暂存。如果需要过夜,则需使用程序降温仪进行降温,然后转移至液氮储存罐进行储存。
进入B级区的生产用工器具、洁净服和清洁用百洁布,需要使用湿热灭菌柜进行灭菌。
生物废弃物,需要使用湿热灭菌柜进行灭活,然后按医疗废弃物进行处理。
3.2 工艺公用设施
工艺公用设施,指的是那些对产品质量有直接影响的系统,如注射用水、纯化水、纯蒸汽、洁净气体系统和净化空调系统等。
因为CAR-T细胞产品不能最终灭菌和过滤除菌,所以生产用水和试剂应为无菌。如每日用量不大,可直接使用外购的无菌水和试剂,如每日所需无菌水较多,则可考虑设计1个注射用水储存和分配系统,注射用水理论上为非无菌水,应经过湿热灭菌之后使用。
所有与产品接触的容器和材料,均为一次性无菌材料,因此车间不需要纯蒸汽系统。
需要1个纯化水站及储存和分配系统,以用于洁净区工作服的清洗、生产用的工器具的清洗和洁净区的清洁。
需要1个CO2气瓶间,通过汇流排调压后输送到CO2培养箱,并监测CO2浓度。
洁净区的净化空调系统,需要按照区域进行设置,以便于管理和减少交叉污染。传染性病毒阳性血的细胞操作间,应设计为全排风。
洁净区的温湿度,一般为18~26 ℃和45%~65%相对湿度。房间的压差,可按照《药品生产质量管理规范》进行设计,即洁净区与非洁净区之间、不同级别洁净区之间的压差应>10 Pa。建议细胞操作间与相邻的B级走廊压差应>10 Pa。
3.3 辅助公用设施
辅助公用设施,指的是那些对产品质量无直接影响的系统,如冷冻水、工业蒸汽、热水、自来水、排水和配电等系统。
对于CAR-T细胞产品车间,工艺设备不需要冷冻水、工业蒸汽和热水,但其净化空调系统可能需要冷源(冷冻水)和热源(工业蒸汽或热水),冷源和热源需要具备同时供给的能力,以便控制洁净区的温湿度,使之满足规定要求。
另外,考虑到断电影响CAR-T细胞产品质量的风险,需要为关键设备提供UPS电源,比如细胞分离和纯化设备、CO2培养箱、冰箱、关键的分析仪器和液氮储存罐等。
3.4 环境监控系统
为了保证生产环境始终符合规定要求,CAR-T细胞产品车间需要设立1个环境监控系统,对洁净区关键位置的温湿度、压差和尘埃粒子进行实时的监测。该系统的监测数据可按设定的时间间隔进行储存,监测数据不可更改,参数设定和关键操作行为具备追溯功能,具备分级权限管理。
4 结语
随着细胞治疗产品的生产设备向全封闭式、一站式自动化发展及隔离器的应用,对生产环境的要求也将降低,洁净级别也可由B级降低为C级或D级,从而使得细胞治疗产品产业化生产车间也将进一步简化,大大降低车间运营成本和提高工作人员的舒适度。但是,细胞治疗产品生产车间的工艺布局和厂房设施,应该与企业自身情况如场地、生产品种和批次等相适应。
参考文献
[1] 叶世光, 李萍, 梁爱斌. 嵌合抗原受体T细胞治疗的研究进展[J]. 上海医药, 2018, 39(11): 3-8.
[2] Eaker S, Armant M, Brandwein H, et al. Concise review: guidance in developing commercializable autologous/patientspecific cell therapy manufacturing[J]. Stem Cells Transl Med, 2013, 2(11): 871-883.
[3] Levine BL, Miskin J, Wonnacott K, et al. Global manufacturing of CAR T cell therapy[J]. Mol Ther Methods Clin Dev, 2017, 4: 92-101.
[4] Alici E, Blomberg P. GMP facilities for manufacturing of advanced therapy medicinal products for clinical trials: an overview for clinical researchers[J]. Curr Gene Ther, 2010, 10(6): 508-515.
