Na2SeO4对蛹虫草子实体生长的影响
2019-05-16马麦艳焦子伟马正海张相锋
马麦艳, 焦子伟, 马正海, 张相锋*
(1.伊犁师范学院 生物与地理科学学院,新疆 伊宁 835000;2.新疆大学 生命科学学院,新疆 乌鲁木齐 830046)
蛹虫草(Cordycepsmilitaris(L.) Link)又叫北虫草或北冬虫夏草,属于子囊菌亚门,核菌纲,麦角菌目,麦角菌科,虫草属[1]。大量理化分析证实,蛹虫草与冬虫夏草的活性成分和药理作用基本相同,某些活性成分含量甚至高于冬虫夏草,其在提高免疫能力、抗氧化性和抗肿瘤等活性方面日益得到人们认可[2]。蛹虫草所富含的腺苷、虫草素、麦角甾醇及虫草多糖等多种生物活性物质,具有抗癌、促进细胞分化、滋补益肾、抑制蛋白激酶活性等多种功能[3-5]。硒被科学家们誉为“生命的火种”“抗癌之王”[6]。人体内缺乏硒会导致多种疾病[7-8]。我国处于全球的缺硒带,全国近72%的地区不同程度地缺硒[6]。这些地区的人从食物中摄取的硒,远远不能满足机体对硒的需求。因此,开发补硒产品显得尤为重要。蛹虫草通过细胞代谢将无机硒转化为无毒的有机硒,有利于人体更好地吸收,可作为富硒载体。近年来,我国许多学者[9-12]对于蛹虫草生物富硒方面进行了大量的研究。陈宏伟等[13]研究发现当硒浓度较低时可促进菌丝体生长,较高浓度硒则对菌丝生长有抑制作用;于田田等[14]研究了蛹虫草液体发酵富硒过程中最佳的营养条件,确定蛹虫草富硒的最佳培养基配方;王权等[15]采用正交试验优化磁化水培养富硒蛹虫草的条件;邵颖等[16]对富硒蛹虫草活性成分及抗氧化作用进行了分析,结果表明富硒蛹虫草中虫草素、腺苷、多糖等的含量要明显高于普通蛹虫草;张曦文等[17]在培养基中添加不同浓度的Na2SeO3液体培养蛹虫草,探究富硒对蛹虫草菌丝干重及胞内酶活性的影响,结果表明适宜的硒添加量能在不同程度上提高胞内酶活性,但促进效果存在差异;凌宏通等[18]研究表明,加硒可提高蛹虫草的耐硒能力,但加入过量硒源会导致蛹虫草分化时间延长、子座产量降低。赵建英等[19]进行富硒蛹虫草的筛选及其耐硒特征的研究,结果表明当培养时间为72 h左右时,其生物量最大且此时的富硒效果最好。本研究在总结前人研究经验的基础上,以Na2SeO4为硒源、新疆本地蛹虫草为富硒载体,初步探讨不同浓度Na2SeO4对蛹虫草菌丝发育及子实体生长情况的影响,为富硒产品开发寻找新的硒源开辟新思路,为新疆地区进一步大规模栽培富硒蛹虫草提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株 供试菌株为MAT1-1和MAT1-2两种不同交配型的代表菌株d9、a11,来自本实验室。
1.1.2 培养基 改良马铃薯(PDA)固体培养基;含硒培养液:将配好的改良PDA培养基[20]中分别加入一定量的Na2SeO4,配成含硒质量浓度分别为20、40、60、80、100、150、200 mg/L的含硒改良培养液;大米培养基:每个组培瓶加入20 g大米和20 mL不同浓度的含硒改良培养液,盖紧白色透气盖,于115 ℃高压蒸汽灭菌15 min。
1.2 方法
1.2.1 试验设计 试验共设计8个实验组,每个处理6次重复(见表1)。

表1 不同处理人工栽培培养基
1.2.2 蛹虫草子实体人工栽培 参考努尔买买提等[21]方法进行人工栽培。将MAT1-1、MAT1-2两个不同交配型菌株接种于改良PDA培养基上培养15~20 d。将活化后的两株菌株分别接种在改良马铃薯液体培养基中,获得d9、a11两种菌悬液,将这两种菌悬液等体积混合均匀后用无菌水稀释10倍,然后吸取10 mL均匀添加到各个处理的培养瓶中。将接种好的培养瓶置于培养室中,培养55~60 d。培养期间需要人工定期对培养室进行消毒擦洗,且要保持培养室内相对湿度80%和温度(25±1) ℃。培养期间定期对不同处理的蛹虫草丝菌丝体及子实体进行观测并记录生长状况,对收获后的蛹虫草子实体的鲜重、干重、长度、硒含量、腺苷及虫草素含量等相关指标进行分析评价。
1.2.3 蛹虫草子实体中硒含量检测方法 子实体中硒含量检测方法参考胡婷等[22]方法。硒标准储备液:1 mg/mL(国家标准物质中心),1 μg/mL标准使用液由标准储备液逐级稀释,现配现用。将样品于40 ℃烘干至恒重,粉碎,过100目筛。称取0.500 0 g(精确到0.001 g)样品于消解罐中,加入10 mL HNO3冷浸过夜,加2 mL 30% H2O2,震荡,90 ℃恒温水浴30 min。再次冷却后置于微波消解仪中依次以200 W、5 min,400 W、5 min,200 W、12 min条件消解。冷却后取出加热至近干,加入5 mL 6 mol/L HCl,反应完全后用超纯水定容于25 mL容量瓶,待测。
1.2.4 蛹虫草子实体中腺苷、虫草素含量检测方法 采用高效液相色谱法进行检测。①测定条件:C18,250 mm×4.6 mm×5 μm;流动相:A:乙腈,B:1.0% 乙酸VA∶VB=5∶95;流速:1.0 mL/min;柱温:35 ℃;检测波长:260 nm,紫外检测器打开;进样量:10 μL。②标准溶液配制:虫草素、腺苷标准品各取10 mg(按实际含量折算),用流动相(V乙腈∶V水=5∶95)定容至100 mL,摇匀。③标准曲线绘制:分别取0.1、0.2、0.5、1.0、2.0、5.0 mL标准溶液(100 μg/mL)定容至10 mL,标注曲线浓度1.0、2.0、5.0、10.0、20.0、50.0 μg/mL。配制不同梯度的虫草素和腺苷标准品溶液,通过标样峰面积制成标准曲线。将被测的提取液逐一高效液相色谱仪进行检测,根据标准曲线计算虫草素和腺苷的含量。
1.2.5 数据统计 本研究数据以平均值作为依据,采用SPSS软件(Version11.5,USA)、EXCEL软件对数据进行方差分析(ANOVA)与处理。
2 结果与分析
2.1 蛹虫草菌丝生长分析
由表2可知,实验组1与对照组(CK)在菌丝长满时间、菌丝密度、菌丝转色时间和菌饼变黄时间上无明显差异,而其他组与对照组均有明显差异。随着培养基中Na2SeO4浓度的增加,蛹虫草菌丝长满时间延长,菌丝密度下降,菌丝转色时间延长。由此可见,在一定浓度范围内,随着Na2SeO4浓度的增加,对蛹虫草菌丝生长会产生较明显的抑制作用,实验组7表现最为明显。
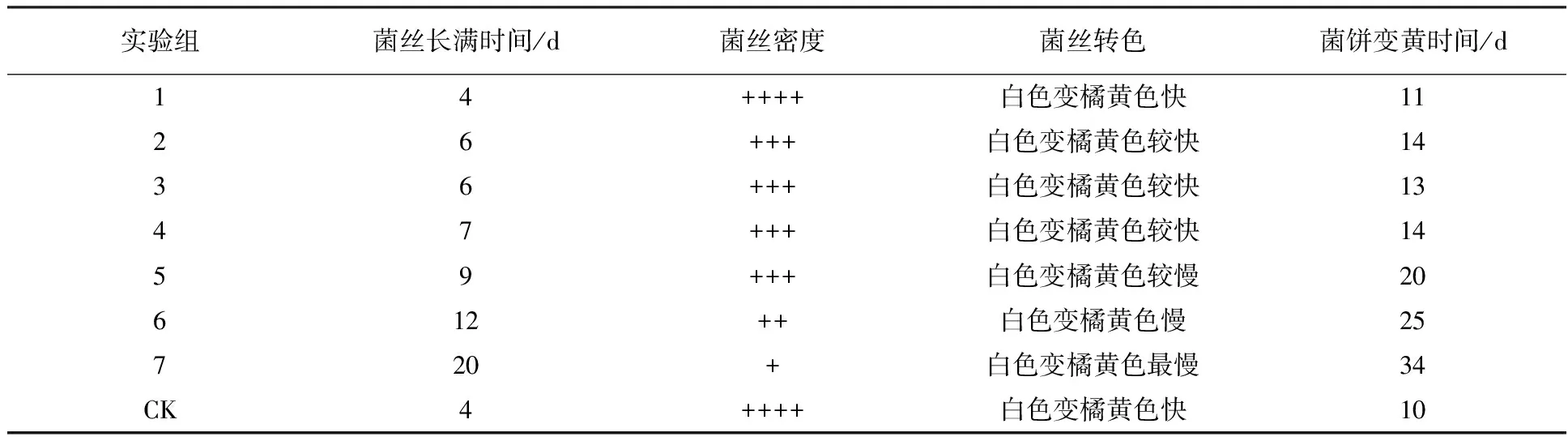
表2 不同处理蛹虫草的菌丝生长情况比较
注:“++++” 密度最好;“+++” 密度较好;“++” 密度一般;“+” 密度差
2.2 蛹虫草子实体生长分析
由表3可知,Na2SeO4质量浓度为20 mg/L实验组与对照组在出草时间、子座生长、子实体生长及色泽、子囊壳和出草质量上没有明显差别,而其他实验组与对照组均有比较明显的差异。随着培养基中Na2SeO4质量浓度的增加,蛹虫草出草时间延长,子囊座变得短粗且不均匀,子实体形成量减少,质量变差。由此可见,在一定浓度范围内,随着Na2SeO4质量浓度的增加,对蛹虫草菌子实体生长有明显的抑制作用,浓度越高抑制作用越明显,Na2SeO4质量浓度达到200 mg/L时蛹虫草子实体已不具备商品价值。
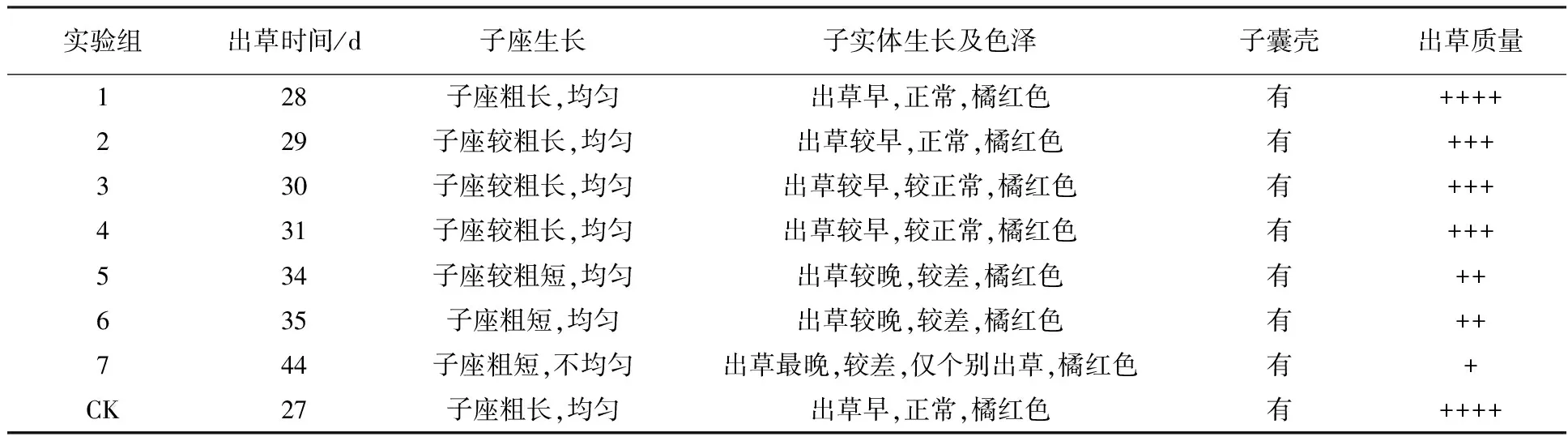
表3 不同处理蛹虫草的子实体生长情况比较
注:“++++”表示80%的子实体直径≥ 3 mm,长度≥4 cm;“+++”表示80%的子实体直径≥2 mm,长度≥3 cm;“++”表示80%的子实体直径≥1 mm,长度≥2 cm;“+”表示80%的子实体直径<1 mm,长度<2 cm
2.3 蛹虫草出草比较
由表4可知,培养基中添加20 mg/L Na2SeO4的实验组在虫草长度、鲜重、干重、鲜干比和生物转化率几个指标上与对照组都没有显著差异。其他实验组与对照组均有显著差异,而且除了干鲜比外其他考察指标均随着培养基中Na2SeO4质量浓度的增加逐渐下降,当Na2SeO4质量浓度达到200 mg/L时蛹虫草各项指标已达到失去生产意义的程度。由图1也可以明显看出不同Na2SeO4浓度处理对蛹虫草出草指标的影响。

图1 不同处理人工栽培蛹虫草子实体效果Fig.1 Effect of different treatments on the fruiting ofCordyceps militaris
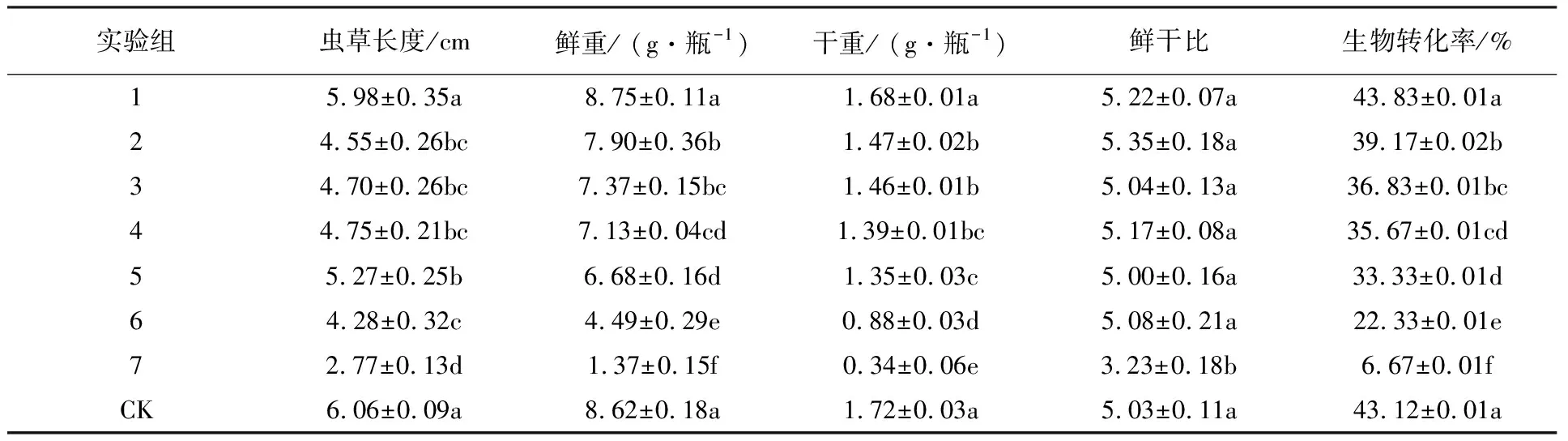
表4 不同处理的蛹虫草子实体相关指标分析
注:数据为平均值和标准误差;不同字母表示为显著性差异(P<0.05),下表同
2.4 不同处理硒含量分析
由于对照组没有添加外源硒,所以对照组在子实体硒含量对比中没有意义。由表5可知,培养基Na2SeO4质量浓度为20 mg/L和40 mg/L,实验组在子实体总硒含量上没有显著差异,其他各实验组之间均有显著差异。子实体总硒含量随着培养基中外源硒浓度的增加而呈逐渐递减趋势,当外源Na2SeO4质量浓度为200 mg/L时,蛹虫草子实体中总硒含量由34.74%降为3.92%。

表5 不同处理子实体中总硒含量
2.5 不同处理腺苷、虫草素含量分析
由表6可知,就腺苷含量来看,培养基Na2SeO4质量浓度为20 mg/L和40 mg/L实验组子实体中腺苷含量与对照组相比差异显著,且腺苷含量显著提升;当外源硒质量浓度达到80 mg/L以上子实体中腺苷含量随着培养基中外源硒浓度的增加而呈逐渐递减趋势,培养基中硒质量浓度为200 mg/L时,腺苷含量仅为505.20 μg/g。就虫草素含量来看,与对照组相比处理1、2虫草素含量有所增加且差异显著,处理1、2间差异显著;当外源Na2SeO4质量浓度达到60 mg/L,即处理3,子实体中虫草素含量与对照组相比显著下降,且随着培养基中外源硒浓度的增加虫草素含量呈递减趋势;当外源Na2SeO4质量浓度为200 mg/L时,蛹虫草子实体中虫草素含量为4 035.62 μg/g。
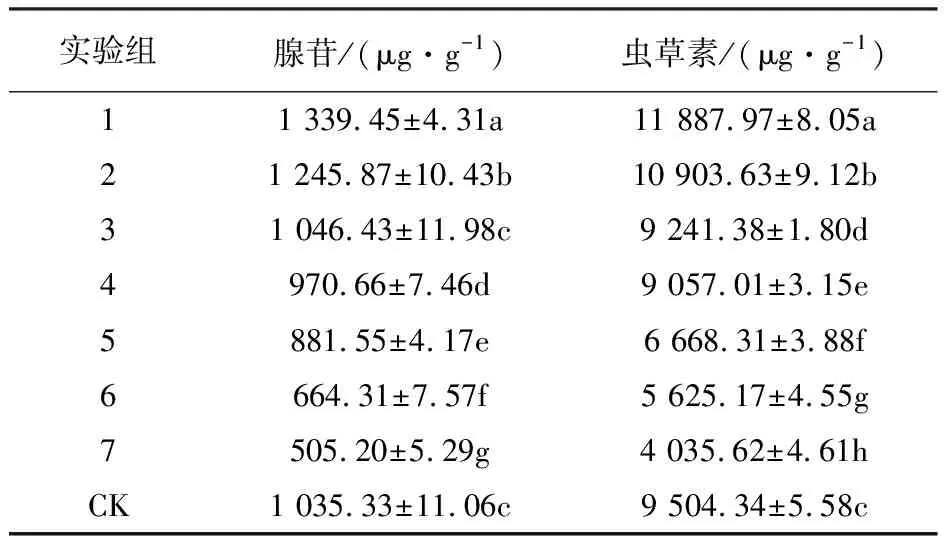
表6 不同处理子实体中腺苷、虫草素含量
3 讨 论
许多学者[6,11,16]进行富硒蛹虫草研究时,多以Na2SeO3作为外源硒,本研究以Na2SeO4作为硒源,通过大量人工栽培试验,为寻找新的硒源开辟新思路,进一步为新疆地区大规模栽培富硒蛹虫草提供一定的参考。研究结果表明:与对照相比,Na2SeO4质量浓度为20 mg/L处理的蛹虫草菌丝生长情况呈较好态势,随着培养基中硒浓度增加,硒对蛹虫草菌丝体生长的抑制作用更加显著,当Na2SeO4质量浓度达到200 mg/L的虫草菌丝生长表现最差。这说明较高浓度的外源硒对蛹虫草菌丝体生长有一定影响,这与于田田等[14]的研究结果一致。通过对不同浓度Na2SeO4处理的蛹虫草子实体生长状况及生物学指标进行观测和方差分析,发现随着外源Na2SeO4浓度的增加,蛹虫草子实体生长的各项参考指标均有不同程度下降,当外源Na2SeO4质量浓度达到200 mg/L时,蛹虫草子实体已不具商品价值。这说明高浓度的外源Na2SeO4对蛹虫草子实体生长具有明显的抑制作用,这与杜双田等[6]、贲松彬等[23]研究结果基本一致。通过对不同浓度Na2SeO4处理的蛹虫草子实体总硒含量进行测定发现,除20 mg/L及40 mg/L处理以外,总体上其他各处理间子实体中总硒含量均呈显著性差异(P<0.05)。随着培养基中Na2SeO4质量浓度的增加,蛹虫草子实体总硒含量呈下降趋势。这与杜双田等[6]研究结果不尽一致,可能与试验材料及环境条件等因素有关。通过对不同浓度Na2SeO4处理的蛹虫草子实体中腺苷、虫草素含量进行测定,发现20 mg/L处理与其他各处理间子实体中腺苷及虫草素含量均呈显著性差异(P<0.05),且当培养基中Na2SeO4质量浓度达到80 mg/L以上时,蛹虫草子实体中腺苷及虫草素含量呈下降趋势,这有可能是高浓度的硒影响了蛹虫草生物代谢,其影响机制有待进一步深入研究。
本研究结果表明,培养基中添加20 mg/L Na2SeO4,对蛹虫草菌丝生长(菌丝密度、菌饼变黄时间、菌丝转色情况)、蛹虫草的子实体生长(子实体形成时间、子座、出草质量等)无明显影响。但随着培养基中Na2SeO4浓度的增加,蛹虫草菌丝及子实体生长指标均呈明显下降趋势。当培养基中Na2SeO4质量浓度达到200 mg/L时,各项指标与其他组相比均达到最低值,已明显不具商品价值。通过本研究可以看出,在培养基中添加不超过20 mg/L质量浓度的Na2SeO4对蛹虫草的生长不产生显著的影响,是以Na2SeO4为硒源进行蛹虫草富硒研究的安全浓度。该研究为富硒产品开发寻找新的硒源开辟了新思路,为新疆地区进一步大规模栽培富硒蛹虫草提供一定的参考,但对以Na2SeO4为硒源的最佳富硒浓度还有待进一步研究。
