牛布鲁氏菌病、结核、炭疽、口蹄疫、病毒性腹泻黏膜病、副流感、传染性鼻气管炎可视化基因芯片检测方法的建立
2019-05-15魏春霞陈延飞刘怀东才学鹏曾巧英薛青红
魏春霞,孙 淼,赵 炜,陈延飞,刘怀东,张 敏,李 岭,陈 建,才学鹏*,曾巧英*,薛青红*
(1.甘肃农业大学,兰州 730070;2.中国兽医药品监察所,北京 100081 )
伴随我国居民生活水平的提高及膳食结构的变化,牛肉、牛奶等产品市场需求旺盛,进而促进了养牛业的发展。牛布鲁氏菌病、结核、炭疽、口蹄疫、病毒性腹泻黏膜病、副流感、传染性鼻气管炎这几种牛病常发病,威胁着这一产业的发展。因此,为了满足民众日常需求,减少养殖场和养殖户的经济损失,建立一种快速高效检测这几种牛病原的方法用以这些疾病的预防和防控十分必要。
牛布鲁氏菌(Brucella, Bru)、结核杆菌(Mycobacteriumtuberculosis, MTB)、炭疽杆菌(Anthrax)、口蹄疫病毒(Foot-and-Mouth disease virus, FMDV)、牛病毒性腹泻病毒(Bovine viral diarrhoea virus, BVDV)、牛副流感病毒3型(Bovine para ̄influenza virus, BPIV3)、牛传染性支气管炎病毒(Bovine infectious rhinotacheitus virus, IBRV)均易感牛,在不同程度上均可造成牛消瘦、母牛流产,甚至导致死亡。目前,常用的布病检测方法有琥红平板实验、凝集试验及补体结合试验;炭疽的检测方法主要依赖微生物学及血清学方法,包括Ascoli氏反应和PCR;结核的检测常用过敏反应等来鉴定;FMDV、BVDV、BPIV3、IBRV的检测主要以病原分离、血清学试验和分子生物学检测方法为主。上述检测方法均存在检测指标单一、操作复杂、费时费力等问题[1],给牛群疫病诊断带来一定困难。本文针对牛群主要发生疫病病原诊断方法存在的问题拟研究建立一种可以快速高效同时检测七种牛疫病病原的基因芯片检测技术,用于牛群疫病诊断及流行病学调查。
1 材料与方法
1.1 材料 本实验所用检测病原牛布鲁氏菌疫苗、结核分支杆菌疫苗、炭疽芽孢杆菌弱毒苗、牛病毒性腹泻病毒、牛副流感病毒、牛传染性支气管炎病毒、牛流行性热病毒由中国兽医药品监察所(IVDC)保存并提供,口蹄疫病毒疫苗由金宇保灵生物有限生物有限公司提供。所用临床样本采集自某养殖场,由中国兽医药品监察所保存。实验用病原信息见表1。
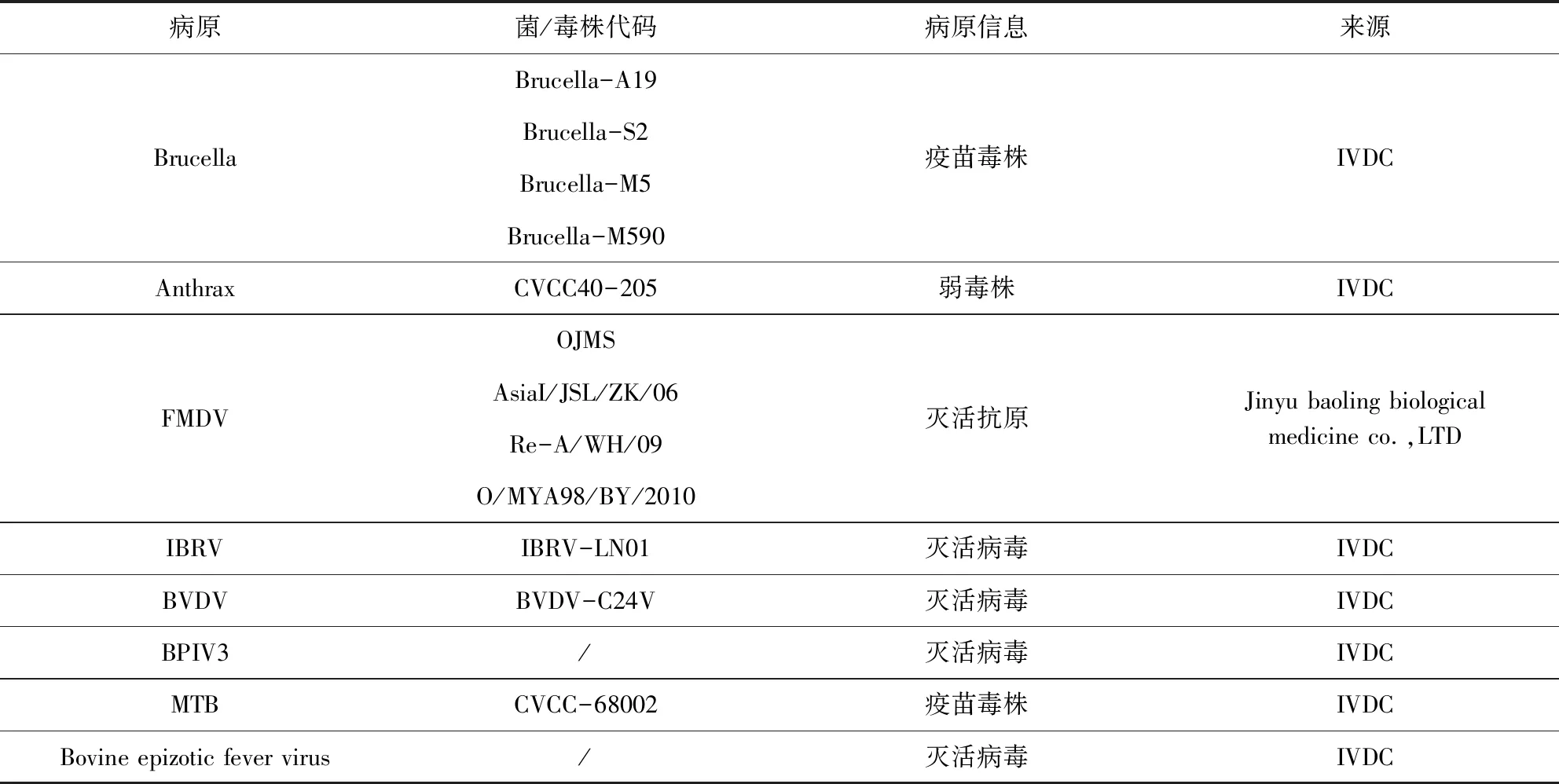
表1 病原信息Tab 1 Pathogens information
1.1.1 主要试剂 核酸提取试剂盒AXYGEN Axyprep体液病毒DNA/RNA小量试剂盒,逆转录试剂盒Prime-Script One Step RT-PCR Kit Ver2(TaKaRa),PMD 18-T Vector Cloning Kit(TaKaRa),TOP 10感受态细胞,MakerII(康为世纪),2×Taq MasterMix、普通质粒小量提取试剂盒、琼脂糖凝胶回收试剂盒(北京天根生化科技有限公司),SA-HRP(Jackson),PierceTM1-Step Ultra TMB Biotting Solution (Thermo)。
1.2 方法的建立
1.2.1 引物探针的设计 以布鲁氏菌的外膜蛋白(OMP25)保守序列为靶基因设计引物;以炭疽芽孢杆菌的POX1质粒和16SrDNA基因片段为模板设计引物探针;参照文献[2]设计牛结核分枝杆菌引物及探针;副流感病毒N蛋白常作为分子诊断的靶基因,针对N基因设计引物及探针[3];IBRV有四类糖蛋白,针对gB蛋白基因的保守区域设计引物探针[4];BVDV E2基因是病毒的主要保护性抗原编码基因,在E2基因的5'端是不同毒株的主要变异区域,故选择BVDV 5'-非翻译区(5'-Untranslated region, 5'-UTR)设计引物和探针[5];比较FMDV全基因组进行多序列比较,发现FMDV 7个血清型的保守基因是3D基因,进而根据该保守序列设计引物及探针。以上引物设计及性能评价用oligo7软件。引物探针具体信息见表2和表3。
1.2.2 芯片的制备 探针用磷酸缓冲液稀释至终浓度为6 μmol/L,设置点样仪参数为100 drop,按照点样顺序将各探针点样于纳米膜上。点样后将膜基片置于湿度为40%~60%,温度为22~25 ℃条件下过夜晾干,2~8 ℃存放。芯片点样模式见图1。
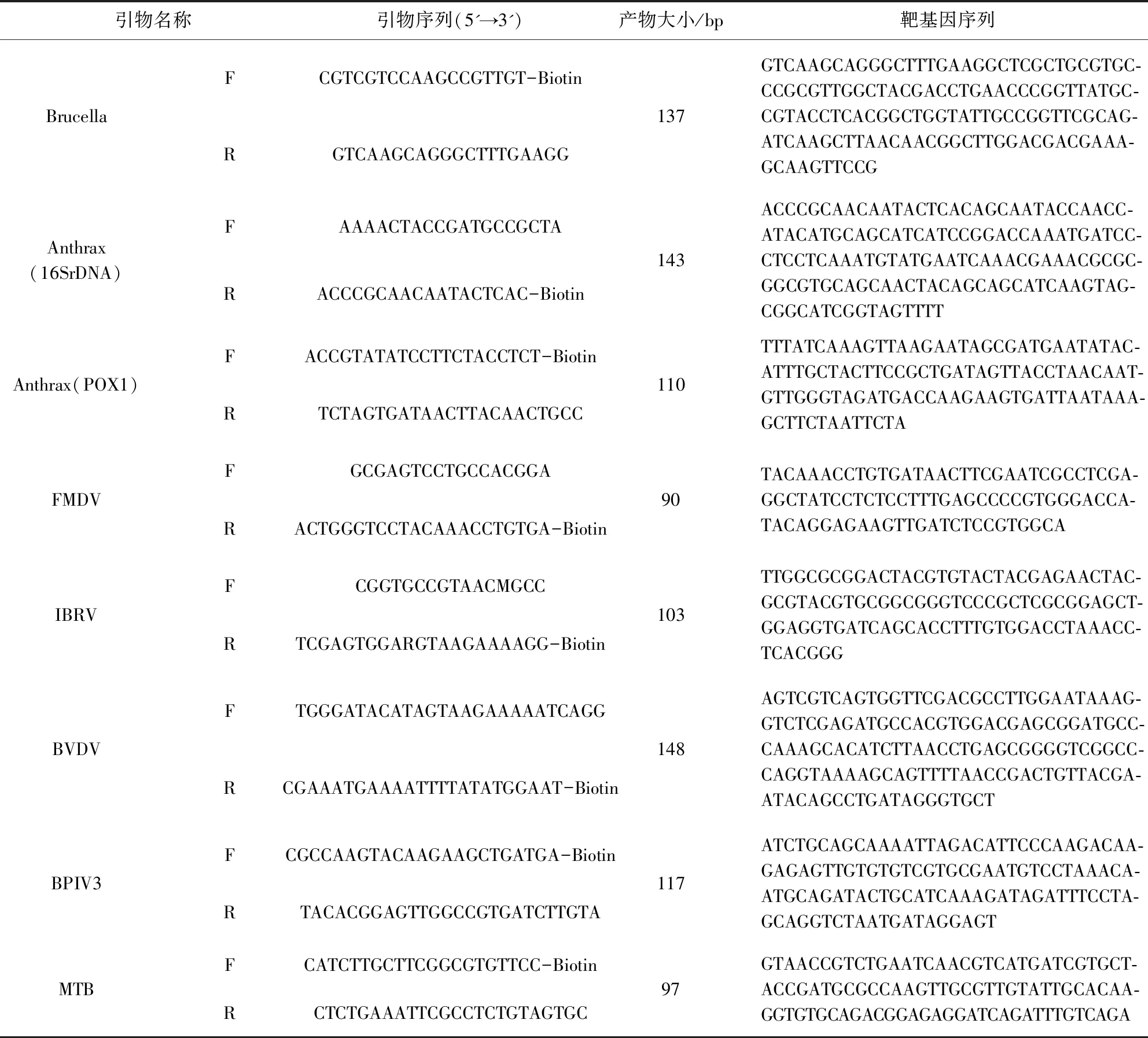
表2 引物信息Tab 2 Primers information

表3 探针信息Tab 3 Probes information
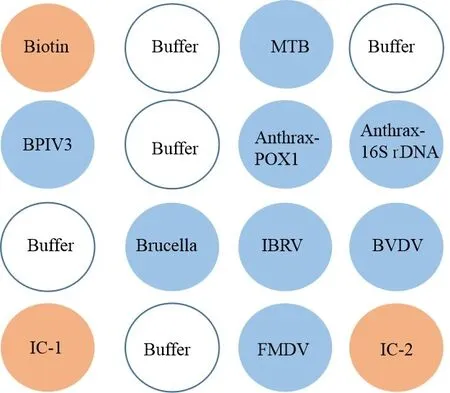
Biotin、IC-1、IC-2为阳性质控点,Buffer为阴性质控点图1 芯片点样模式Fig 1 The chip spotting model
1.2.3 单一病原核酸的提取、扩增 参照核酸提取试剂盒说明书提取各病原的核酸,优化退火温度等PCR反应条件。将BPIV3、BVDV、FMDV核酸(遗传物质为RNA),Brucella、IBRV、MTB、Anthrax核酸(遗传物质为DNA)分别按常规体系扩增。反应条件分别为50 ℃ 30 min,94 ℃ 4 min,94 ℃ 45 s,56 ℃ 1 min,72 ℃ 30 s,35个循环,72 ℃ 10 min;94℃ 5 min,94 ℃ 45 s,56 ℃ 1 min,72 ℃ 30 s,35个循环,72 ℃ 10 min。
1.2.4 混合样品核酸的扩增 应用多重PCR方法对混合样品核酸进行扩增,通过对其退火温度、引物用量等反应条件优化后,将样品核酸按表4体系进行扩增。扩增条件为50 ℃ 30 min,94 ℃ 4 min,94 ℃ 45 s,56 ℃ 1 min,72℃ 30 s,35个循环,72 ℃ 10 min。
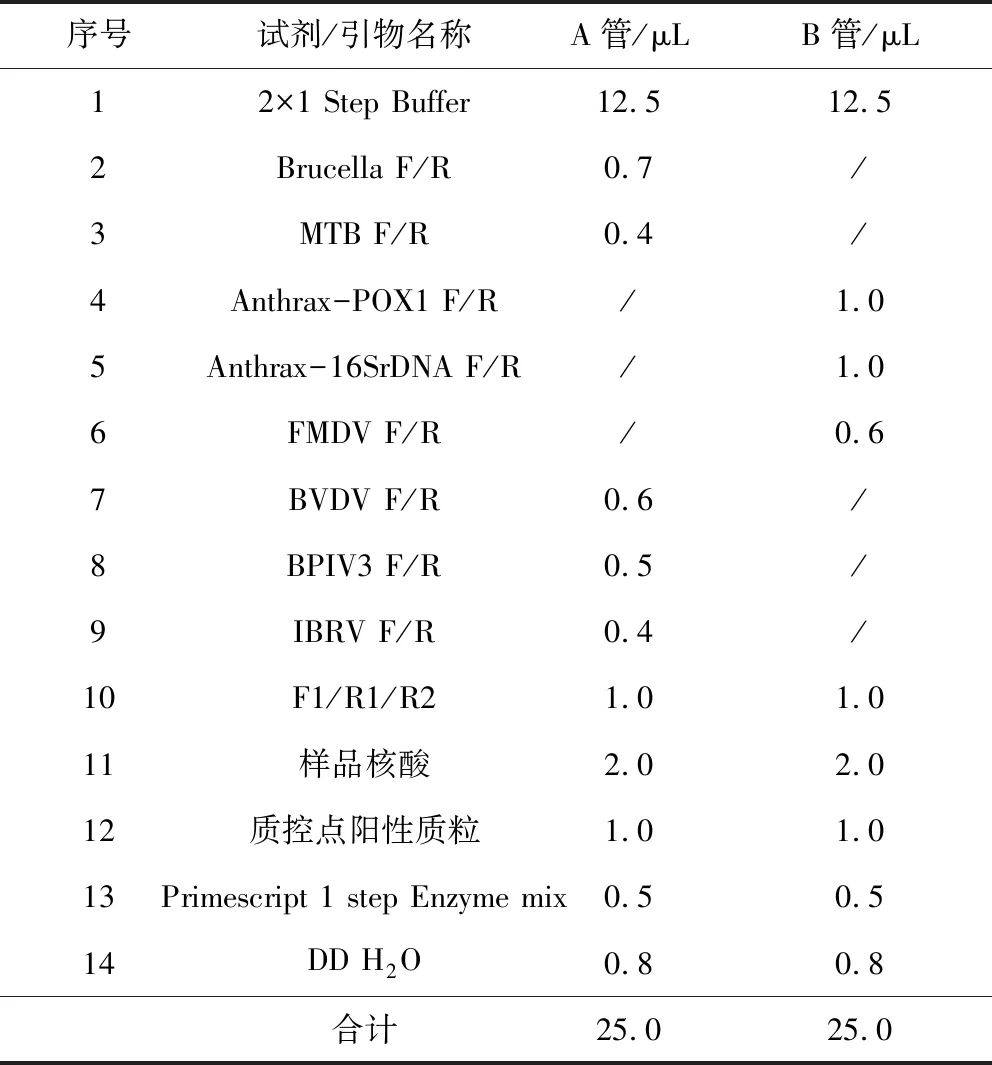
表4 混合样品核酸扩增体系Tab 4 Mixed sample nucleic acid amplification system
1.2.5 基因芯片的杂交、洗涤与可视化检测 取20 μL PCR产物,加入到100 μL的杂交液中,沸水浴5 min后加入到已47 ℃预热芯片中,200 r/min 反应20 min。弃去反应液后用47 ℃预热的洗涤液,200 μL/孔淋洗三遍,47 ℃孔板孵育器洗10 min。杂交液1∶2000稀释SA-HRP,100 μL/孔,200 r/min,室温反应 10 min。洗涤液室温淋洗2次,每孔加入60 μL TMB避光显色。拍照记录实验结果。
1.2.6 结果判定 阴性质控点不显色,阳性质控点的颜色为明显强于阴性质控点的蓝紫色,两个阳性质控点至少有一个显色为有效实验结果。如被测样品所在探针点不显色,即为阴性;如果被测样品所在探针点为蓝紫色,则为阳性。
1.2.7 引物的特异性试验 将各病原样品扩增后,2%琼脂糖凝胶电泳。将胶回收产物送往华大基因公司测序。
1.2.8 探针的特异性试验 将七种病原、健康牛血清、牛流行性热病毒,分别按照1.2.4扩增后进行芯片检测。
1.2.9 芯片的灵敏度试验 各病原PCR产物琼脂糖凝胶电泳之后,将胶回收产物连接pMD 18-T Vector,连接产物转化至TOP 10感受肽细胞中,涂板,选取大小适中的单个菌落培养,菌液PCR后,将PCR阳性的菌液送往测序公司测序。使用DNA Star和NCBI Blast分析测序结果,同时将测序成功的阳性菌液扩增培养后提取质粒。将各阳性质粒定量后10倍倍比稀释,扩增后分别与芯片反应,进行单一阳性质粒灵敏度检测同时对其进行2%琼脂糖凝胶电泳。再将七种病原质粒等浓度体积混合,10倍倍比稀释,扩增后与芯片杂交,进行七种阳性质粒混合灵敏度测定。
1.2.10 芯片的保存期试验 将浓度为1.4×10-4ng/μL的七种病原阳性混合质粒按照步骤1.2.4扩增,与在2~8 ℃保存30 d、60 d、120 d、180 d的芯片分别进行反应。
1.2.11 芯片的重复性检测 将同一质控样品的扩增产物用不同批次及同一批次内不同芯片进行检测。
1.2.12 芯片检测临床样品与国标方法检测的比对
将23份牛血清、4份牛肺组织、3份牛肠组织临床样品提取核酸后,按照1.2.4方法进行扩增,扩增产物与芯片反应后记录检测结果,芯片反应操作同1.2.5。同时将各临床样本参照《奶牛布鲁氏菌病PCR诊断技术NY/T 1467-2007》、《动物炭疽诊断技术NY/T 561-2015》、《结核病病原菌实时荧光PCR检测方法GB/T 27639-2011》、《口蹄疫检疫技术规范SN/T 1181-2010》、《牛病毒性腹泻/粘膜病检疫规范 SN/T 1129-2007》、《牛传染性鼻气管炎检疫技术规范SN/T 1164.1-2011》及中和试验进行检测。
2 结果与分析
2.1 引物的特异性评价 各病原扩增产物大小与前期设计一致(图2),测序结果与设计目的片段相同。
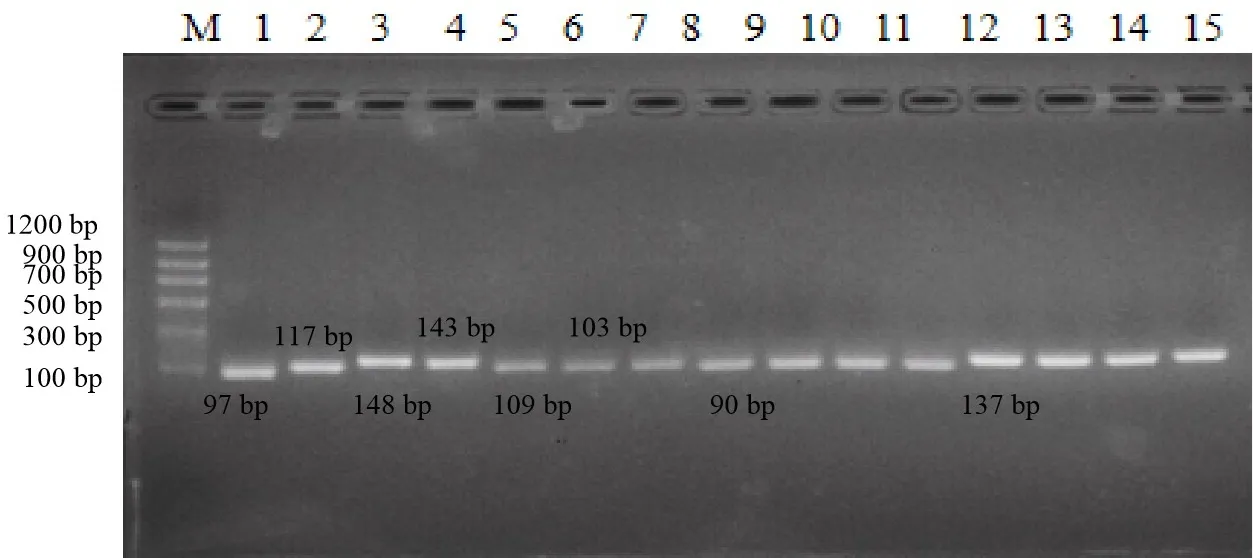
M: DNA分子质量标准;1: 结核杆菌; 2: 牛副流感病毒3型; 3: 牛病毒性腹泻病毒; 4: 炭疽-16SrDNA; 5: 炭疽-POX1; 6,7: 牛传染性鼻气管炎病毒; 8-11: 口蹄疫病毒; 12-15:布鲁氏菌M: MakerII; 1: MTB; 2: BPIV3; 3: BVDV; 4: Anthrax-16SrDNA; 5: Anthrax-POX1;6,7: IBRV; 8-11: FMDV; 12-15: Brucella图2 PCR产物示意图Fig 2 Schematic diagram of PCR product
2.2 探针的特异性评价 阴性质控点无响应,阳性质控点响应,各病原探针点特异性响应。健康牛血清、牛流行性热病毒除阳性质控点响应外,其他探针均无响应(图3),表明所设计探针特异性良好。

1: 牛副流感病毒3型; 2: 牛病毒性腹泻病病毒; 3: 口蹄疫病毒; 4: 传染性鼻气管炎病毒; 5: 炭疽-POX1; 6: 炭疽-16SrDNA; 7: 布鲁氏菌; 8: 结核杆菌; 9: 健康牛血清; 10: 牛流行性热病毒 1: BPIV3; 2: BVDV; 3: FMDV; 4: IBRV; 5: Anthrax-POX1; 6: Anthrax-16SrDNA; 7: Brucella; 8: MTB; 9: Healthy bovine serum; 10: Bovine epizotic fever virus图3 探针特异性响应实验结果Fig 3 Probe specificity test results
2.3 芯片的灵敏度评价
2.3.1 单一阳性质粒灵敏度 单一阳性质粒芯片检测灵敏度可达1.0 ×10-6ng/μL,比普通PCR高出10~100倍(表5)。
2.3.2 混合阳性质粒灵敏度 当混合阳性质粒稀释至浓度为1.4×10-5ng/μL时,各病原探针点与阳性质控点均显色,阴性质控点无显色。浓度为1.4×10-6ng/μL时,阳性质控点正常显色,阴性质控点无显色,病原探针点只有MTB、Anthrax有响应(图4)。故七种病原混合阳性质粒芯片检测灵敏可达1.4×10-5ng/μL。
2.4 芯片的保存期评价 同一扩增产物与2~8 ℃保存了30 d、60 d、120 d、180 d的芯片反应后,阳性质控点及七种病原对应探针点均有显色(图5),表明在2~8 ℃,芯片至少可保存180 d。

表5 单一病原质粒检测灵敏度Tab 5 Sensitivity of the single pathogen plasmid ng/μL

1: 1.4×10-1 ng/μL; 2: 1.4×10-2 ng/μL; 3: 1.4×10-3 ng/μL; 4: 1.4×10-4 ng/μL; 5: 1.4×10-5 ng/μL; 6: 1.4×10-6 ng/μL; 7: 1.4×10-7 ng/μL; 8: Blank control图4 混合样品灵敏度检测结果Fig 4 Mixed sample sensitivity experiment results

1: 30 days; 2: 60 days; 3: 120 days; 4:180 days图5 不同保存期实验结果Fig 5 The results of different storage experiment
2.5 芯片的重复性评价 用同一批样品的扩增产物与同一批次及不同批次的芯片进行反应。实验结果表明,针对同一样品,同一批次及不同批次的芯片的检测结果均相同。芯片的可重复性为100%。
2.6 临床样本的检测 30份牛样品经芯片检测,其中Brucella检出1份,BPIV3检出7份,BVDV检出10份,IBRV检出11份,Anthrax、MTB、FMDV未检出。经标准方法检测Brucella检出1份,BPIV3检出7份,BVDV检出12份,IBRV检出10份,Anthrax、MTB、FMDV未检出。其中单一病原感染占63.3%,两种病原混合感染比例为36.7%。两种检测方法符合率为98.6%。具体数据见表6。
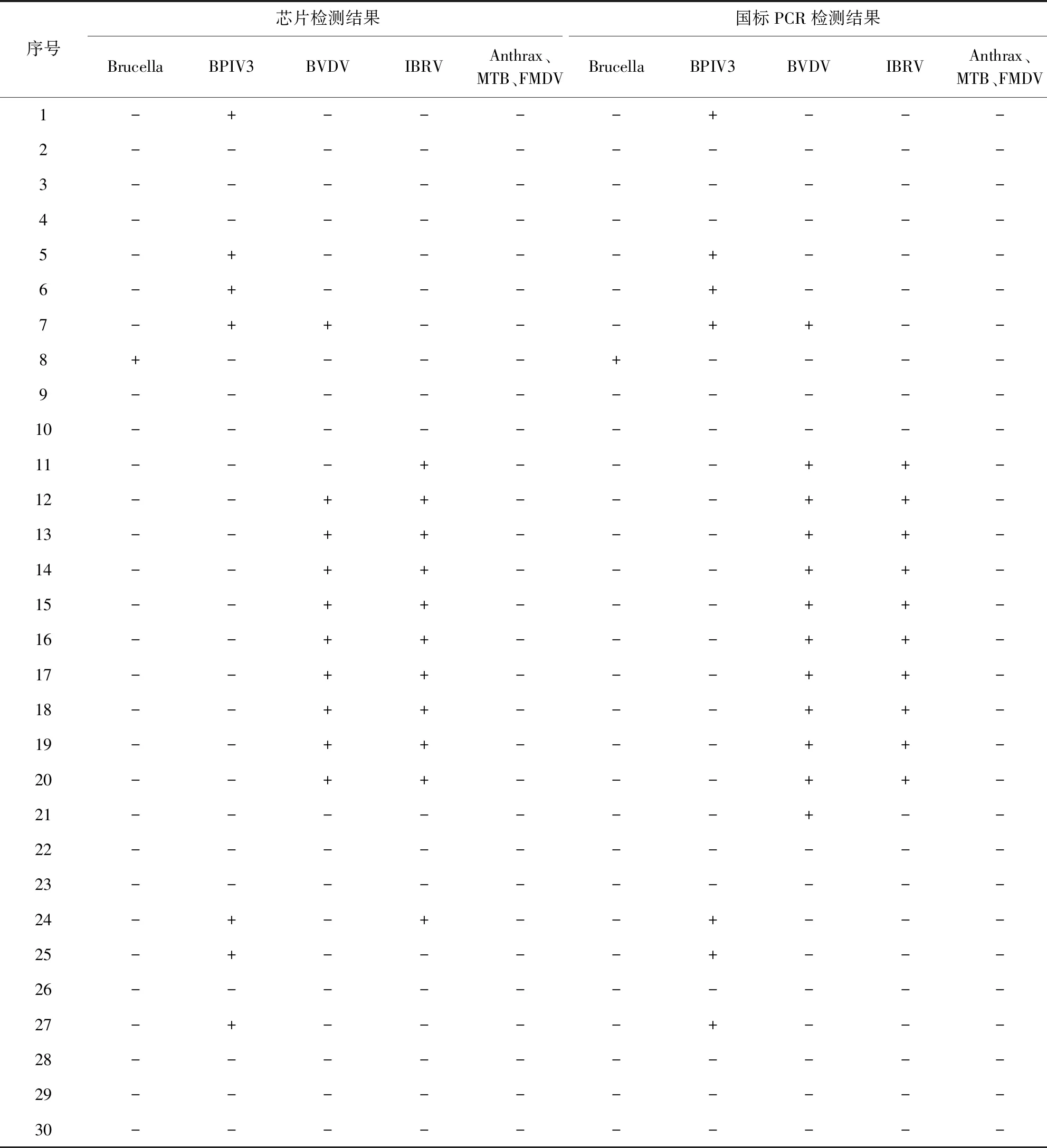
表6 临床样品检测结果Tab 6 Results of clinical samples
+:阳性;-:阴性
3 讨论与结论
基因芯片技术近些年来被广泛应用于医学领域,并在基因功能表达、致病机理、临床诊断、药物开发等研究方面取得突出成效[6]。目前针对这七种牛群常发病病原,国内检测方法一般为病毒分离试验、血清中和试验等方法。此类传统方法都需要耗费较多的人力和时间,每次只能检测一种病原。本实验所研制的基因芯片检测方法具有操作简单,快速、便捷、高通量等特点。
基因芯片检测技术一般包括芯片的制备,样品的制备,样品与芯片的生物反应以及反应信号的检测与分析等[7]。本研究建立的基因芯片方法以“0+X”纳米膜为支撑,与通常醛基化玻片为支撑的芯片检测方法相比可大大缩短杂交、洗涤、显色等芯片反应各步骤的时间,本检测方法仅需3 h,而采用醛基化玻片的芯片则需要至少5 h[8-10]。在样品制备方面,根据各病原的特异性保守区域设计探针引物。据文献可知探针大小及靶DNA的长度等因素会影响杂交信号[11],本实验各探针长度均在25 bp左右,各靶基因的目标片段均在80~150 bp,保证了响应信号的稳定清晰。生物素与链霉亲和素有良好的亲和性[12],用5'端标记生物素的引物来扩增目的片段,探针与带有生物素的扩增产物结合后再与HRP标记的链霉亲和素反应,最后在底物显色液的作用下,探针点可显现出肉眼可见的蓝紫色响应点。方便肉眼观察,且不需要复杂仪器来记录实验结果。同时该方法在点样时设置了三个阳性质控点及1个阴性质控点,用以监测操作过程的各步骤是否有效,保证检测结果可靠性。
利用多重PCR扩增特异性片段,引物浓度及引物间相互作用会影响扩增效率[13]。将七种病原的八对引物排列组合后进行双重PCR,发现本实验中设计的炭疽的两对引物和口蹄疫的引物对其他五种病原的扩增效率影响较大,但对他们自身扩增没有影响,故将这两种病原分开进行扩增,同时对各引物的最佳浓度进行优化,建立完整的扩增体系。芯片反应温度对芯片检测结果有一定影响,优化芯片反应温度可得47 ℃为最佳芯片反应温度。对阳性质控质粒的浓度进行优化,使其在检测样品不同浓度下可一直响应,同时不影响样品扩增的灵敏度。最终确定其浓度为1.0×10-3ng/μL时为最佳用量。
在确定的最优条件下,该基因芯片单一病原检测灵敏度可达1.0×10-6ng/μL,比普通PCR检测方法灵敏10~100倍,对七种混合病原的检测灵敏度达到1.4×10-5ng/μL。杨帆[14]建立了一种BPIV3、IBRV、BVDV和Mycoplasmabovis多重PCR检测方法,对BPIV3和BVDV最低检测量分别为100 pg和1 ng,对IBRV和Mycoplasmabovis的最低检测量分别为10 pg和100 pg。
基因芯片检测技术的应用提高了感染性疾病分子诊断的质量,同时缩短了分析时间,是一种独立的可以筛选大量病理标本中多个基因的方法[15-17]。用基因芯片方法与用国标方法同时检测30份临床样品,符合率为98.6%。本研究所建立的方法可同时检测牛七种病原,七种病原间无交叉响应,与牛其他病原及健康牛血清组织也无响应,芯片重复率可达100%,2~8 ℃保存期可达180 d,完全可以满足实验室临床样品检测及流行病学监察。
