山奈酚激活mTOR通路对心肌细胞缺氧损伤的保护作用①
2019-05-15郭长磊韩明磊侯永兰杨秀丽
王 成 郭长磊 李 霞 刘 振 韩明磊 侯永兰 杨秀丽
(新乡市中心医院心血管内一科,新乡453000)
缺血性心脏病经常表现为急性心肌梗死,是世界范围内导致死亡和心力衰竭的主要原因[1]。未能满足心脏的氧气需求通常是缺血性心脏病的直接原因之一。抗缺血疗法,通过增加心肌供氧和/或降低心肌耗氧量,使用抗心绞痛药物来缓解或预防急性缺血发作,已被证明是缺血性心脏病的一个非常重要的治疗手段。因此,保护心肌细胞免受低氧损伤是降低缺血性心脏病风险的合理治疗策略之一[2]。氯化钴(CoCl2)是著名的组织缺氧模拟剂[3]。据报道,CoCl2能够在许多方面模拟低氧反应,例如,减少细胞生存能力,线粒体膜电位消散,激活caspase-3和诱导细胞凋亡[3]。类黄酮是一种天然的多酚类化合物,具有广泛的生物活性。山奈酚(Kaempferol,KPF,3,4,5,7-四羟黄酮)是一种植物雌激素,结构如图1所示,是最常见的膳食类黄酮类化合物之一,常见于茶、花椰菜、柚子和其他植物[4]。山奈酚具有抗氧化、抗凋亡和抗炎性质[5-7]。已有研究表明山奈酚可保护心脏对抗阿霉素诱导的心脏毒性,说明山奈酚的心脏保护作用[8]。本文旨在研究山奈酚对缺氧H9C2细胞的保护作用和机制。
1 材料与方法
1.1材料 山奈酚购自美国Sigma-Aldrich(96353,Sigma)。化学式:C15H10O6,分子量:286.24,纯度>99%,用DMSO配制成1 mol/L的母液,使用时稀释至所需浓度。DMEM培养基、FBS和胰蛋白酶购自美国Gibco 公司。CCK-8试剂盒购自日本同仁化学公司。丙二醛(MDA)试剂盒(货号:A003-1)和超氧化物歧化酶(SOD)试剂盒(货号:A001-1)购自中国南京建城生物工程研究所。BCA试剂盒购自碧云天生物技术研究所。抗Beclin 1、 P62、 LC3-Ⅰ、LC3-Ⅱ、mTOR和Unc51-like kinase 1(ULK1)抗体购自美国Abcam公司。Hoechst染色试剂盒购自碧云天生物技术研究所。
1.2方法
1.2.1细胞培养与处理 人H9C2细胞来源于中科院上海生物研究所细胞库。H9C2细胞培养于10%胎牛血清(FBS)和1%青-链霉素的高糖DMEM培养基中,并放置在37℃,5% CO2恒温培养箱中。培养基每2~3 d更换1次,当需要收集细胞时,用 0.25% 胰蛋白酶消化。后续实验选择 5、10、 20 μmol/L的山奈酚进行处理。Hoechst染色。

图1 山奈酚化学结构Fig.1 Chemical structure of Kaempferol
1.2.2缺氧细胞模型建立和分组 H9C2细胞接种在96孔板,接种密度为(1.5~1.8)×104/孔或者接种在6孔板,接种密度为(8~10)×105/孔,然后用1 200 μmol/L CoCl2加入培养基处理细胞24 h 诱导细胞缺氧模型。H9C2细胞分为5组:对照组(H9C2),模型组(Hypoxia):1 200 μmol/L CoCl2处理对照组(H9C2)细胞24 h,处理组(KPF 5 μmol/L,KPF 10 μmol/L, KPF 20 μmol/L):分别用5、10、 20 μmol/L KPF+1 200 μmol/L CoCl2处理细胞24 h。
1.2.3CCK-8检测细胞增殖 各组细胞处理后,连续培养4 d,每天检测各组待测细胞的数量,制成增殖倍数曲线。首先用培养基将CCK-8溶液稀释到10%,再用上述溶液将待测细胞制成1×106个/ml的细胞悬液,然后在37℃培养1~4 h,最后在450 nm处检测吸光值,计算细胞增殖倍数。
1.2.4氧化应激标记物检测 根据试剂盒说明书,用MDA测定试剂盒测定细胞裂解液中MDA的含量;用SOD测定试剂盒测定细胞裂解液中SOD的含量。液氮研磨脑组织,按说明书进行操作。MDA 在532 nm 处测OD值,SOD在550 nm处测OD值。
1.2.5细胞凋亡检测 根据Hoechst染色试剂盒说明书进行操作:消化收集细胞,吸尽培养液,加入0.5 ml 固定液,固定10 min或更长时间(可4℃过夜);去固定液,用PBS洗2遍,每次3 min,弃液;加入0.5 ml Hoechst 33258染色液,染色5 min;去染色液,用PBS洗2遍,每次3 min,弃液;滴一滴抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,让细胞接触封片液,尽量避免气泡。荧光显微镜可检测到呈蓝色的细胞核。
1.2.6Western blot 首先将各组待测细胞用PBS将清洗3次,再加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取,BCA试剂盒测定蛋白质含量;提取等量的蛋白质样品(20 mg),100℃变性5 min。然后进行SDS-PAGE凝胶电泳分离并转移至PVDF膜,5%的BSA室温封闭1~2 h后加入相应的一抗,4℃过夜孵育,次日,清洗后再加入辣根过氧化物酶标记的二抗,室温孵育1 h,清洗。最后加入发光液后,于凝胶成像仪进行曝光拍照,并用Image J软件统计灰度值计算相对表达量。GAPDH作为上样量参照,至少重复3个独立的实验。
1.3统计学分析 采用SPSS16.0软件对实验数据进行统计学分析,两两比较用独立的t检验,分析比较处理组与对照组之间增殖倍数、凋亡率以及蛋白表达的差异。以P<0.05表示差异有统计学意义。
2 结果
2.1山奈酚促进缺氧心肌细胞增殖 连续培养各组(对照组和处理组)H9C2细胞4 d检测细胞增殖倍数。如图2所示,与对照组(H9C2)相比,模型组(Hypoxia)细胞增殖倍数明显减少(P<0.01);与模型组(Hypoxia)相比,处理组(KPF 5 μmol/L,KPF 10 μmol/L,KPF 20 μmol/L)增殖倍数依次提高。山奈酚浓度越高,缺氧心肌细胞增殖倍数越高(P<0.01);处理时间越长,增殖能力越强。说明山奈酚以剂量依赖和时间依赖的方式促进缺氧H9C2细胞的增殖能力。
2.2山奈酚抑制缺氧心肌细胞凋亡 为了检测山奈酚对缺氧H9C2细胞凋亡的影响,本研究采用Hoechst染色检测细胞凋亡情况。如图3A所示,致密浓染蓝色光点的斑点即为凋亡细胞细胞核,与对照组(H9C2)相比,模型组(Hypoxia)明显促进H9C2细胞凋亡(P<0.01);与模型组相比(Hypoxia),处理组(KPF 5 μmol/L,KPF 10 μmol/L,KPF 20 μmol/L)细胞凋亡率依次降低(图3B,P<0.01)。如图3C所示,凋亡蛋白caspase-3和caspase-9表达水平随KPF浓度升高而降低。说明山奈酚以剂量依赖的方式抑制缺氧H9C2细胞凋亡。
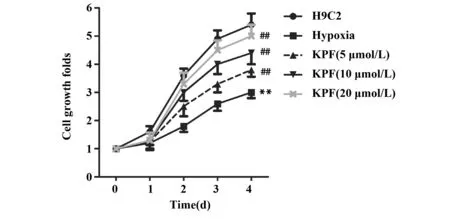
图2 山奈酚促进缺氧H9C2细胞增殖Fig.2 KPF promoted proliferation of hypoxic H9C2 cellsNote: **.P<0.01,vs H9C2 group;##.P<0.01,vs Hypoxia group.


图3 山奈酚抑制缺氧H9C2细胞凋亡
Fig.3 KPF inhibited apoptosis of hypoxic H9C2 cells
Note: **.P<0.01,vs H9C2 group;##.P<0.01,vs Hypoxia group.
2.3山奈酚降低缺氧心肌细胞ROS水平 如图4所示,与对照组(H9C2)相比,模型组(Hypoxia)SOD活性明显降低,MDA含量明显增加(P<0.01);与模型组相比(Hypoxia),处理组(KPF 5 μmol/L,KPF 10 μmol/L,KPF 20 μmol/L)血清中SOD活性显著升高(P<0.01),MDA水平显著下降(P<0.01)。证明山奈酚能增加缺氧心肌细胞SOD活性并降低脂质过氧化物产物MDA含量。

图4 山奈酚降低缺氧H9C2细胞ROS水平Fig.4 KPF reduced ROS level of hypoxic H9C2 cellsNote: **.P<0.01,vs H9C2 group;##.P<0.01,vs Hypoxia group.

图5 山奈酚抑制缺氧H9C2细胞自噬Fig.5 KPF inhibited autophagy of hypoxic H9C2 cellsNote: **.P<0.01,vs H9C2 group;##.P<0.01,vs Hypoxia group.

图6 山奈酚激活mTOR信号通路Fig.6 KPF activated mTOR pathwayNote: **.P<0.01,vs H9C2 group;##.P<0.01,vs Hypoxia group.
2.4山奈酚抑制缺氧心肌细胞自噬 检测自噬相关蛋白Beclin 1,p62和LC3的表达,结果如图5所示。CoCl2明显促进Beclin 1、LC3-Ⅱ表达,抑制p62表达;山奈酚呈剂量依赖显著上调P62蛋白水平,下调Beclin 1和LC3-Ⅱ蛋白水平(图5A)(P<0.01)。P62与自噬呈负相关,而Beclin 1和LC3-Ⅱ是自噬体形成的关键蛋白,暗示山奈酚抑制自噬通量。LC3-Ⅱ/LC3-Ⅰ比值增加(图5B),说明LC3-Ⅰ转换为LC3-Ⅱ,同样暗示证明山奈酚抑制自噬通量。
2.5山奈酚激活mTOR信号通路 为了山奈酚抑制自噬的潜在机制,本文检测缺氧相关通路ULK1和自噬通路哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的表达情况,如图6所示,山奈酚明显上调mTOR蛋白的表达,下调ULK1蛋白表达,且呈剂量依赖的特点。
3 讨论
缺血性心脏病已成为世界范围内的主要死亡原因,每年造成超过700万人死亡。在缺血性心脏病中,冠状动脉血管的堵塞会导致不可逆的细胞损伤甚至死亡。缺血损伤可降低心肌ATP含量,导致能量应激和活性氧(ROS)的过量产生[9]。缺血使心肌细胞缺氧,导致严重或不可逆的心脏损伤[10]。大量的证据表明,来源于线粒体的过量ROS与心血管疾病的发病机制密切相关,如动脉粥样硬化、心肌梗死和心力衰竭[9]。目前证据表明,CoCl2是一种非常重要的低氧诱导因子[11]。本文研究显示,CoCl2处理H9C2细胞24 h细胞增殖倍数明显降低、凋亡率明显提高、SOD水平降低和MDA水平增高说明ROS水平也增加,最终导致心肌细胞死亡,验证了CoCl2诱导低氧损伤的潜力。
研究表明,植物源性多酚类非甾体化合物,包括类黄酮和非黄酮类化合物在保护心脏特征中具有有效的抗氧化性。这些性质部分与羟基的取代有关,这可能直接导致自由基的消失[8]。诱导的心肌细胞死亡的主要分子机制是自由基的过度产生和严重的氧化应激。因此,具有强抗氧化性的化合物可以通过中和多氧诱导的氧化应激来发挥作用。山奈酚是最常见的膳食类黄酮之一,在许多组织(包括心脏)中都有抗凋亡、抗氧化和抗炎的作用[12]。本文研究表明山奈酚可以保护心肌细胞对抗CoCl2诱导的凋亡,提高SOD活性,清除MDA,降低ROS含量。从上述文献报道的机制来看,山奈酚作为类黄酮家族一员,除了能增加SOD活性,还可能直接参与消除自由基,从而减轻氧化应激造成的细胞凋亡。大量的实验和临床研究表明,在衰竭的心肌中,ROS积累是明显加重[11]。暴露于ROS会导致细胞凋亡、坏死、纤维化,最终引起心律失常、兴奋收缩耦合损伤、心脏重构[13]。细胞凋亡是缺氧心肌细胞死亡的主要方式[6]。之前研究表明,山奈酚可以通过抑制凋亡保护心肌细胞对抗缺氧/复氧损伤[8]。本研究结果与上述研究结果一致,山奈酚可以抑制缺氧心肌细胞凋亡。
自噬是细胞溶酶体在严格的调控下的动态自降解过程,也被认为参与了缺血性心脏病[14]。自噬通常在心脏中维持着较低水平,当出现ATP衰竭、过度ROS和线粒体功能障碍等环境应激时自噬通量急剧上升[15]。适度自噬可促进细胞存活,而过度自噬可加速细胞死亡[16]。因此,自噬作为治疗缺血性心脏病的潜在靶点已引起越来越多的关注。ULK1是一种丝氨酸/苏氨酸蛋白激酶,对自噬的初始阶段至关重要。ULK1抑制导致早期自噬体结构停滞[17]。自噬抑制最容易的途径发生在对mTOR途径的激活[18]。当ULK1蛋白激酶复合物被抑制时,ULK1对mTOR途径抑制作用被解除,mTOR途径自然被激活,从而抑制细胞自噬。mTOR信号通路可以调节细胞生长、增殖和死亡相关的多种相关功能和机制[19]。心脏mTOR的过表达,可以对心肌缺血损伤产生心脏保护作用,并抑制炎症反应[20]。在本研究中,观察到CoCl2显著诱导自噬,表现在CoCl2明显促进Beclin 1、LC3-Ⅱ和ULK1表达,抑制p62和mTOR表达;而山奈酚以剂量依赖的方式抵消CoCl2诱导的自噬,导致自噬抑制从而发挥对心肌细胞的保护功能。
总的来说,本研究揭示了山奈酚在体外对CoCl2诱导的缺氧心肌细胞的保护作用:促进缺氧心肌细胞增殖、抑制缺氧心肌细胞凋亡、降低ROS水平和抑制自噬。这种保护作用可能是通过激活mTOR通路来实现的。本研究结果阐明了山奈酚治疗缺血性心脏病的潜力。
