锥栗嫁接苗与实生苗叶片解剖特征及光合特性比较
2019-05-14李艳丽彭小博袁德义
李艳丽,熊 欢,彭小博,邹 锋,袁德义
(中南林业科技大学, 经济林培育与保护教育部重点实验室, 经济林育种与栽培国家林业局重点实验室, 经济林培育与利用湖南省2011协同创新中心, 湖南 长沙 410004)
【研究意义】锥栗(CastaneahenryiRehd.et Wils)属壳斗科(Fagaceae)栗属(Castanea)植物,是我国南方特有的木本粮食树种,分布于秦岭-淮河以南地区,其中在福建、浙江和湖南等山区资源分布最为集中[1]。我国现有锥栗的种植面积达100万 hm2,年产值数十亿元[2]。发展锥栗生产对于促进山区精准扶贫、建设美丽乡村具有重要的意义。近年来,锥栗在我国南方丘陵山区开始大规模的人工种植。实生苗适应性广、生长较快,由于遗传变异较大,存在童期长、挂果迟的问题,直接限制了当前锥栗产业化发展的进程。然而嫁接苗不仅可以保持亲本优良品种的性状,提高锥栗苗木对环境的适应能力,还可以缩短童期、提早开花结果[3]。苗木的光合能力影响其生长和发育,而叶片是植物进行光合作用的主要器官[4],特别是叶片内部各种组织的厚度和比例、叶肉细胞的大小和排列等结构特征会很大程度地影响叶片的光合功能[5]。【前人研究进展】目前,在植物叶片结构与光合特性的关系上已有一些研究报道。例如,黄娟等曾以杨树(Populustremula)为试材,发现杨树的叶肉组织厚度与其气体交换能力存在相关关系[6];梁文斌等曾以短梗大参(Macropanaxrosthornii)苗木为试材,发现叶绿素含量的增加有利于植物在低光强下更有效、更多地吸收光能[7];祁传磊等曾研究发现大青杨(PopulusussuriensisKom.)的叶片结构(叶面积、栅栏组织厚度及栅栏组织与海绵组织厚度的比值)与其光合能力的关系密切[8]。在锥栗的研究上,主要集中在良种选育[9]、高效栽培技术[10]以及加工利用[8]等方面。然而关于锥栗嫁接苗与实生苗在叶片生长状况、形态结构及光合特性上的研究则报道较少。【本研究切入点】因此,本文以2年生锥栗嫁接苗与实生苗为试材,对比分析叶片生长状况、形态结构及光合特性的差异,探明嫁接苗与实生苗叶片的结构与光合利用的相关关系,为锥栗的良种苗木繁育提供一定的参考依据。
1 材料与方法
1.1 供试材料
试验场所选在中南林业科技大学生命科学楼,位于112°59′32″ E,28°8′14″ N,海拔约100 m。试验以2年生盆栽锥栗嫁接苗与实生苗为材料,其中嫁接苗砧木为‘华栗4号’,接穗品种为‘华栗4号’;实生苗采用‘华栗4号’种子实生播种,基质为黄心土∶泥炭∶珍珠岩=4∶2∶1。
1.2 测试项目及方法
1.2.1 叶片显微结构和生长参数 2017年8月上旬,于晴天上午采集成熟锥栗叶片,采用无色透明的指甲油印迹法,进行气孔密度测定[11];采用30 % NaOH溶液浸泡和0.5 %甲苯胺蓝染色法[12], 进行叶脉密度测定;采用石蜡切片法[13],运用OLYMPUS-BX53型显微镜进行叶片显微结构观察;选取苗木第2~4节完全开展的叶片20个,进行叶片生长指标测定,即面积、周长、叶长、叶宽、干重和比叶面积(即叶面积/叶片干重)等[14]。
1.2.2 叶绿素含量(Cc) 取新鲜叶片0.02 dm2放入试管中,加10 mL的丙酮乙醇(V∶V=1∶1)提取液,用UV-1100型分光光度计(上海,中国)进行光合色素:叶绿素a(Chlorophyll a,Chla)和叶绿素b(Chlorophyll b,Chlb)含量的测定[15-16]。
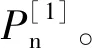
1.3 数据处理与分析
采用Excel2013和Origin8.5分别进行数据统计和绘制折线图,运用SPSS19.0进行单因素方差、差异显著性(P<0.05)及线性相关关系分析。
2 结果与分析
2.1 叶片生长参数
如表1所示,嫁接苗叶片的面积、周长、长度、宽度及干物质量均较实生苗高,而比叶面积则低于实生苗。嫁接苗叶面积44.23 cm2是实生苗(24.55 cm2)的1.80倍;嫁接苗叶片干质量0.29 g是实生苗(0.14 g)的2.07倍;然而实生苗比叶面积182.76 cm2·g-1是嫁接苗(152.10 cm2·g-1)的1.20倍。
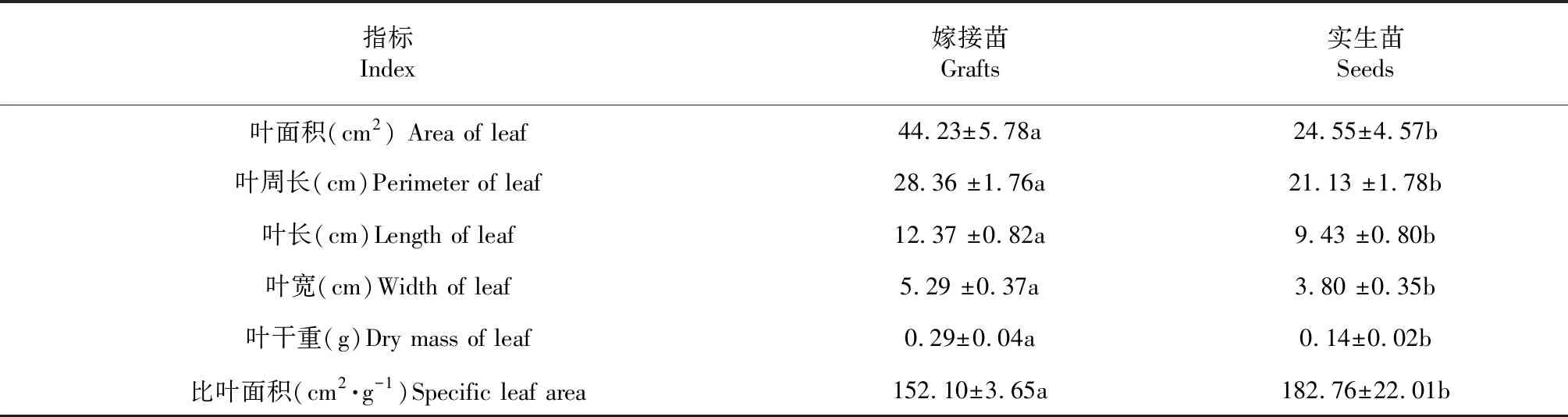
表1 锥栗嫁接苗与实生苗叶片生长情况比较
注:表中数据为平均值±标准差;同列不同小写字母表示P<0.05显著差异,下同。
Note:Values are means±SE.Values within a column followed by the different normal letters are significantly different atP<0.05.The same as below.
2.2 叶片显微结构特征
2.2.1 表皮细胞(EC) 比较锥栗苗木叶片的表皮细胞(表2和图1 A~B)后可以看出,锥栗不同苗木的上下表皮厚度差异显著(P<0.05),嫁接苗的上/下表皮细胞厚度均较实生苗厚。嫁接苗上/下表皮细胞体积较大、排列疏松呈不规则形状;而实生苗表皮细胞则排列紧密,形状较为规则。
2.2.2 叶肉细胞(MC) 锥栗叶片属于典型的异面叶,即栅栏组织细胞(Palisade cell)和海绵组织细胞(Spony mesophyll)分化明显(图1A~B)。一般而言,栅栏组织细胞呈柱状水平排列,深2层;海绵组织形状不规则,排列疏松。锥栗不同苗木的栅栏组织厚度和海绵组织厚度的差异显著(P<0.05)(表2)。嫁接苗的栅栏组织和海绵组织形状较实生苗不规则、排列较实生苗不够紧密。嫁接苗的栅海比值1.39是实生苗(1.26)的1.10倍。
2.2.3 叶脉特征(VC) 锥栗叶片的维管束属于外韧型,即主脉直径较大,机械组织(Mechanical organization,Mo)较发达(图1 C~D)。嫁接苗主脉厚度1168.43 μm是实生苗(848.43 μm)的1.38倍(表2)。嫁接苗与实生苗叶脉密度的差异显著(P<0.05),嫁接苗叶脉密度0.95 mm·mm-2>实生苗(0.72 mm·mm-2)(表2和图1E~F)。
2.2.4 气孔特征(SC) 锥栗叶片气孔属于典型的肾形气孔,主要分布在叶片下表皮(图1G~H)。锥栗不同苗木的气孔密度差异显著(P<0.05),嫁接苗气孔密度145.00 个·mm-2>实生苗73.00 个·mm-2。嫁接苗气孔数目较多且分布密集;实生苗气孔数目较少且分布稀疏。
2.3 叶片光合参数
2.3.1 光合-光响应曲线(Pn-PPFD) 由图2和表3可知,2种苗木叶片的Pn-PPFD曲线走势基本一致,曲线的形状可随PPFD状况的改变发生变化。在弱光(PPFD<200 μmol·m-2·s-1)条件下,Pn呈直线上升,但差异较小;随着光强的进一步增大(高于光补偿点),Pn的上升幅度逐渐减小,嫁接苗的Pn较实生苗高,且差异显著(P<0.05)。2种苗木的Pmax、LCP、Rd及AQY差异显著(P<0.05)(表3),嫁接苗的LSP为680.60 μmol·m-2·s-1<实生苗(705.20 μmol·m-2·s-1)、Pmax为6.77 μmol·m-2·s-1是实生苗(5.13 μmol·m-2·s-1)的1.32倍、AQY为0.05较实生苗(0.04)高出18 %。

表2 锥栗嫁接苗与实生苗叶片显微结构比较
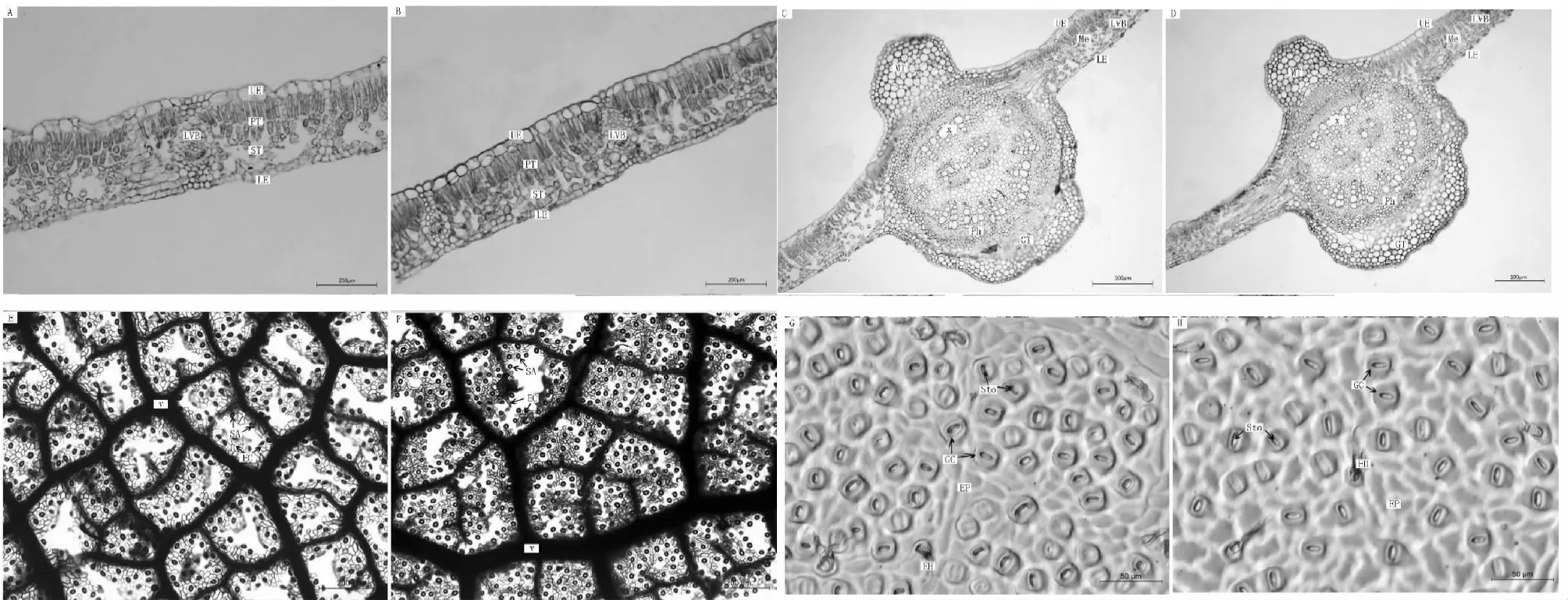
A嫁接苗叶肉组织横切面;B实生苗叶肉组织横切面;C嫁接苗叶片主脉横切面;D实生苗叶片主脉横切面;E嫁接苗叶脉结构;F实生苗叶脉结构;G嫁接苗叶片下表皮气孔;H实生苗叶片下表皮气孔。 UE:上表皮; PT:栅栏组织;ST:海绵组织;LE:下表皮;LVB:侧脉;MT:机械组织; Me:叶肉;X:木质部;Ph:韧皮部;GT:基本组织;V:叶脉;SA:气孔器;EC:表皮细胞;Sto:气孔;GC:保卫细胞;EP:表皮;EH:表皮毛。A~B, 标尺=100 μm;C~F, 标尺=200 μm;G~H, 标尺=50 μmA mesophyll cross section of grafts; B mesophyll cross section of seeds; C main vein cross section of grafts; D main vein cross section of seeds; E vein structure of grafts; F vein structure of seeds; G epidermal stomata of grafts; H epidermal stomata of seeds. UE, upper epidermis. PT: palisade tissue; ST: spongy tissue; LE, lower epidermis; LVB, lateral veins; MT, mechanical tissue; Me, mesophyll; X, xylem; Ph, phloem; GT: basic tissue; V: veins; SA: stomatal apparatus; EC: epidermal cells; Sto: stomata; GC: guard cells; EP: epidermis; EH: epidermal hair. A-B, Bar = 100 μm; C-F, Bar = 200 μm; G-H, Bar = 50 μm图1 锥栗嫁接苗与实生苗叶片结构特征Fig.1 Leaf structure characteristics of grafts and seeds ofC.henryi
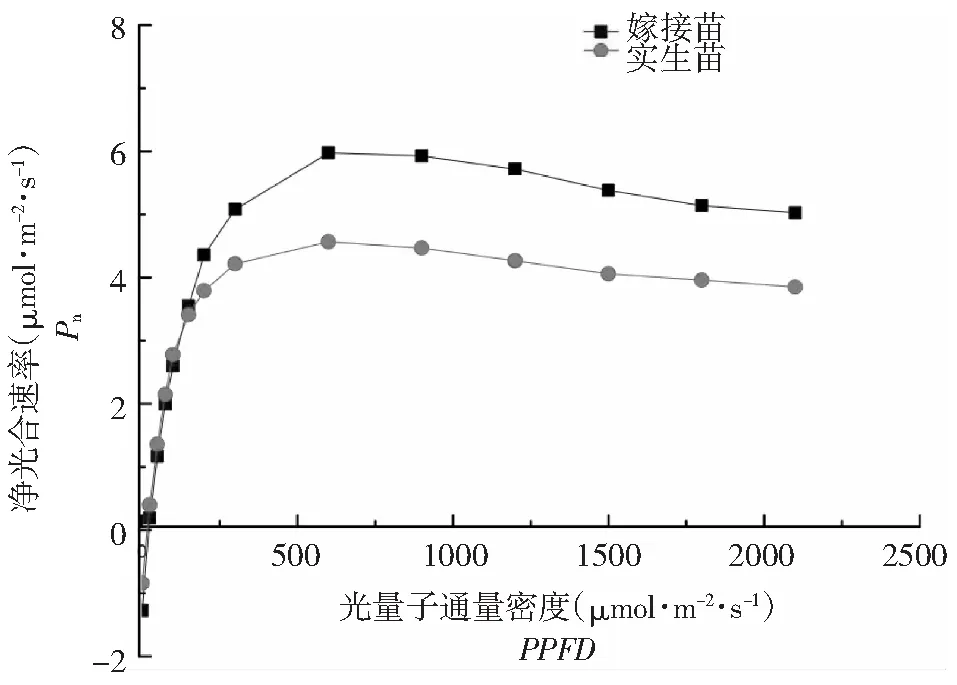
图2 锥栗嫁接与实生苗的净光合速率对不同光照强度的响应Fig.2 Response of net photosynthetic rate ofC.henryigrafts and seeds under different light intensities
2.3.2 光合参数 如表4所示,Pn、Gs及Ci呈显著性差异(P<0.05)。嫁接苗Tr、Pn、Gs及WUE较实生苗高,而嫁接苗Ci为299.49 μmol·mol-1则较实生苗(359.68 μmol·mol-1)低。2种苗木的叶绿素含量Cc呈显著差异(P<0.05),嫁接苗Cc:4.35 mg·dm-2>实生苗2.43 mg·dm-2。
2.4 叶片结构与光合特性的相关关系
由表5可知,2种苗木叶片的叶绿素含量(Cc)、栅栏组织厚度(FTT)、海绵组织厚度(STT)、上表皮细胞厚度(UECT)、叶面积(LA)以及气孔密度(SD)与净光合速率(Pn)呈极显著的正相关;叶片干物质量(LDMQ)与净光合速率(Pn)的正相关关系则不显著。两种苗木叶片的比叶面积(SLA)与Pn的负相关关系则未达到显著水平。2种苗木叶片的SD与气孔导度(Gs)呈极显著的正相关关系。
3 讨 论
光合-光响应曲线(Pn-PPFD)揭示了叶片的光合特性[19]。光补偿点LCP和光饱和点LSP分别表示植物利用弱光和强光的能力[1]。与实生苗相比,嫁接苗的LCP低和LSP高,说明了嫁接苗对弱光和强光环境的适应能力强于实生苗。Pmax表示了植物的潜在最大净光合效率,即光饱和点(LSP)时的光合速率[20-21]。本研究测得的嫁接苗Pmax值高于实生苗,且差异显著(P<0.05),表明了在相同的生长环境下,嫁接苗的光合能力较强。一般情况下,植物的光合能力与暗呼吸速率Rd呈正相关性,即LSP越高、Rd越大[22]。本文中,锥栗嫁接苗的LSP和Rd值都高于实生苗,这也表明了嫁接苗具有较强的光合能力。
表3 锥栗嫁接苗与实生苗的净光合速率对光合有效辐射响应的特征参数
Table 3 The characteristic parameters of the net photosynthetic rate of grafts and seeds ofC.henryion the photosynthetic active radiation response

最大净光合速率(μmol·m-2·s-1)Maximum netphotosynthetic rate光补偿点(μmol·m-2·s-1)Light compensationpoint光饱和点(μmol·m-2·s-1)Light saturationpoint表观量子效率Apparent quantum yield暗呼吸速率(μmol·m-2·s-1)Dark respiration嫁接苗Grafts6.77±0.02a17.79±0.08a705.20±6.240.05±0.00a1.02±0.01a 实生苗Seeds5.13±0.00b25.20±0.01b 680.60±4.360.04±0.00b0.83±0.00b
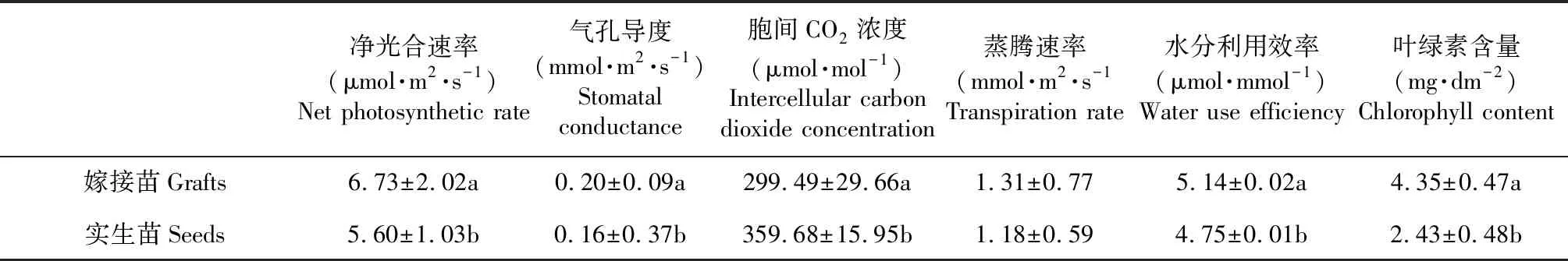
表4 锥栗嫁接苗与实生苗叶片光合参数的差异

表5 锥栗嫁接苗与实生苗叶片结构与光合特性的线性相关关系
植物叶片的光合速率是通过测定净CO2吸收得到的,而光合细胞内真正的CO2供应效率是受叶片表皮气孔细胞的控制[5]。比较锥栗不同苗木下表皮气孔的差异后发现,嫁接苗气孔的单位面积数目较多,同时期的开放程度较大,且分布密集。在光合指标(Pn、Ci和Gs)的方面,嫁接苗的Pn和Gs值高于实生苗,Ci较实生苗低,其中气孔导度Gs(即气孔开放程度)的大小变动直接影响光合作用所需底物CO2的供应,从而影响叶片的光合速率[5]。这表明嫁接苗较高的气孔密度、Gs及较低的比叶面积(即CO2进入细胞壁的阻力小)有益于光合作用底物CO2顺利地进入叶片,因而增强叶片的Pn。
叶片的解剖结构高度特化,以便更好地吸收阳光[23]。叶片表皮层细胞对可见光是完全透明的,单个细胞常呈平凸状起到聚光作用,聚集进入光合细胞的光线,因而使到达叶绿体的PPFD提高到周边光量的数倍之多[24]。本文中,嫁接苗的表皮层细胞较实生苗具有凹面突出、体积大、形状不规则及排列疏松的特征,更利于外界光线较多地聚集进入叶片内部,且对适应不同强度的光照也有较好的调节功能。植物的栅栏层细胞就像导光管,最外层叶绿素含量非常高,能够增加直射光的透射深度[24],而叶绿素是光合生物中的典型色素,具有吸收光以驱动光合作用的功能[25]。研究显示,锥栗苗木的栅栏组织呈柱状平行排列、深2层,其中嫁接苗的栅栏组织厚度显著高于实生苗。在叶绿素含量Cc的测定上,锥栗不同苗木Cc的差异显著(P<0.05),且与Pn之间呈极显著的正相关(P<0.01)。这表明,在嫁接苗栅栏组织中,叶绿体的分布数目可能多于实生苗,并在光合作用过程中吸收较多的光量,从而增强栅栏组织细胞的的光合效率。锥栗不同苗木的海绵组织细胞形状不规则,并被空气泡包围着,由空气泡所组成的气体空间为散射光线提供了大量的气-水界面。因此,光在细胞和气体的界面上可进行多次反射,从而很大程度上延长了光的传递路径,也因而增加了光能被吸收的可能性[26]。研究显示,与实生苗相比,嫁接苗的海绵组织细胞排列较疏松、包围在外的空气泡较大,因而气-水界面也较多。由此发现,嫁接苗的 栅栏组织结构特性利于光顺利进入叶片;海绵组织结构特性益于光的散射和反射,由此较实生苗就能更均衡地吸收和利用光,从而更好地进行光合作用。一般来讲,叶片主脉的厚度越大[27]、叶脉的密度越大,叶片内部的水分运送效率也越高。本文中,锥栗不同苗木叶片的主脉厚度、叶脉密度与水分利用效率WUE的相关性显著(P<0.05),且嫁接苗的主脉厚度、叶脉密度和WUE都高于实生苗,这表明了嫁接苗叶片较高的水分利用水平、合成的有机物运转能力与其叶片结构特征关系密切。
4 结 论
本文研究表明,2年生锥栗苗木叶片整体(气孔、光合机构和叶脉疏导组织等)相互协调响应对叶片的光合作用产生一定影响;嫁接苗与实生苗在叶片生长状况、叶片解剖结构及光合特性方面呈显著差异(P<0.05),嫁接苗对光的适应性和光能利用能力强于实生苗。
