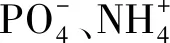钙镁复配药剂对污水的除磷脱氮作用
2019-05-14顾学林刘洪利刘宇童张晓敏
顾学林, 刘洪利, 刘宇童, 张晓敏, 陈 爽
(1.山东胜利水务有限责任公司,山东东营 257000; 2.青岛西海岸新区实验高级中学,山东青岛 266400; 3.中国石油大学(华东)化学工程学院,山东青岛 266580)
氮磷污染物[1-2]处理方法主要分化学沉降法、物理化学法和生物法[3-5]。化学沉淀法广泛应用于污水处理中,姜翠玉等[6]利用反滴加-化学共沉淀法合成了Fe3O4水基磁流体用于油田污水的处理;Osmanlioglu[7]使用亚铁氰化钾、硝酸镍等药剂利用两级化学沉淀法净化放射性废水。笔者以高氮磷含量滤液为处理对象,通过添加钙镁复配新型药剂进行除磷脱氮研究,考察pH值、镁源、钙盐投加量等因素对污水除磷脱氮的影响。
1 实 验
1.1 实验仪器与试剂
试剂:氢氧化钠(NaOH),分析纯;氯化钙(CaCl2),分析纯;氢氧化钙(Ca(OH)2),分析纯;氯化镁(MgCl2),分析纯;氧化镁(MgO),分析纯。
仪器:实验室pH计(STARTER 3100/B),奥豪斯公司;精密电子天平(ME103-E),梅特勒-托利多;立式自动电热压力蒸汽灭菌器(BXM-30R),上海博讯医疗生物仪器股份有限公司;紫外可见分光光度计(UV-1800),岛津;六联电动搅拌仪(JJ-6D),金坛市亿能仪器厂;高效率数控超声波清洗器(KQ-400KDE),昆山市超声仪器有限公司;电热恒温振荡水槽(DK-2-2),上海精宏实验仪器有限公司。
1.2 实验方法
取1 L污水于烧杯中,测定总磷(TP)、总氮(TN)和NH3-N质量浓度分别为3.87、24.41和15.76 mg/L,pH值为7.84。向水样中投入镁盐,用搅拌仪搅拌3 min。投入一定质量的NaOH,快速搅拌5 min,后慢速搅拌30 min;向污水中添加钙盐,慢速搅拌30 min,反应完成后,静置沉淀1 h,取上清液进行NH3-N、TP和TN的测定。
NH3-N质量浓度采用纳氏试剂分光光度法测定,参照HJ 535-2009方法执行;TP采用钼酸铵分光光度法测定,参照HJ 671-2013方法执行;TN采用碱性过硫酸钾消解紫外分光光度法测定,参照HJ 636-2012方法执行。pH值采用玻璃电极法测定,参照GB 6920-86方法执行。
2 结果分析
2.1 NaOH投加量对除磷脱氮的影响
NaOH投加量影响到污水pH值的变化,pH值是影响除磷脱氮效果的关键因素,以镁盐为药剂形成磷酸铵镁沉淀方程式如下:
Mg2++NH4++HPO42-→Mg(NH4)PO4·6H2O↓+H+.
在形成沉淀的过程中会产生H+,使污水pH值降低,加入NaOH后,反应产生的H+被OH-反应去除,使反应向沉淀产生的方向进行,从而提高除磷脱氮的效率[8]。本文中实验以NaOH作为pH调节剂;MgCl2为除磷剂,投加量分别为40、60、80 mg/L。结果表明:NaOH质量浓度分别为0、50、100、150、200、250和300 mg/L时,pH值分别为7.84、8.68、9.15、9.27、9.39、9.45和9.69。除磷脱氮效果见图1。
随NaOH投加量的增加,pH值呈现缓慢增长而非线性增加,原因是污水中含有大量的金属离子,会与投入的部分NaOH发生络合反应,使加入的NaOH不能完全用于改变pH值。NaOH与金属离子(Mn+)发生络合反应方程式如下:
nOH-+Mn+→M(OH)n↓.
络合反应形成的微量沉淀物可以作为晶种,破坏溶液的亚稳态,降低磷酸铵镁结晶的活化能,使结晶速率得到提高,促进除磷脱氮。由图1可看出,随NaOH投加量的增加,以MgCl2为除磷剂,氮磷的去除率随pH的升高先增大后降低,其原因是在一定的pH值范围内,NaOH的加入促进了磷酸铵镁沉淀的形成,去除率随pH值的升高而增大[9];而在高pH条件下Mg2+会优先生成Mg(OH)2沉淀,影响磷酸铵镁沉淀的形成;且当体系pH值过高时,溶液中的大部分NH4+转化为NH3·H2O,在一定温度下转化为氨气逸出,使溶液中NH4+质量浓度降低,影响磷酸铵镁沉淀的形成,从而使得除磷脱氮的效果降低。当NaOH的投加量为150 mg/L,MgCl2投加量为60 mg/L时,处理后污水TP质量浓度为0.41 mg/L,TN质量浓度为23.68 mg/L,NH3-N质量浓度为13.92 mg/L,此时除磷脱氮效率均达到最高,除磷率为84.32%,脱除TN效率为20.89%,脱除NH3-N效率为24.68%,其中TP含量达到国家污水处理一级A标准。
2.2 镁源对除磷脱氮的影响
分别以MgCl2和MgO作为镁源并研究不同投加量对污水处理的影响。通过向含有NH4+和PO43-的废水中添加镁盐,会形成磷酸铵镁(MgNH4PO4·6H2O)沉淀,从而可以达到同时除去污水中氨氮和磷酸盐形成MAP(鸟粪石)沉淀的目的,方程式如下[10]:
Mg2++NH4++HPO42-→Mg(NH4)PO4·6H2O↓+H+,
Mg2++NH4++PO43-→Mg(NH4)PO4↓,
Mg2++NH4++H2PO4-→Mg(NH4)PO4↓+2H+.
在NaOH投加量为150 mg/L,污水TP、TN和NH3-N质量浓度分别为3.87、24.41和15.76 mg/L条件下进行实验,结果见图2。
由图2看出,随镁源投加量的增加,污水TP的质量浓度逐渐降低,去除率在投加量为60 mg/L时基本不变;TN质量浓度随投加量的增加逐渐降低,去除率逐渐升高;NH3-N呈降低趋势,去除率在投加量超过60 mg/L不再变化。出现该现象的原因是镁源的增多对污水除磷脱氮起促进作用。当Mg2+质量浓度达到一定,晶粒逐渐产生,沉淀反应正向进行。在一定的TN、TP质量浓度下,当PO43-、NH4+与Mg2+的离子活度积大于MAP的浓度积时,晶体成核发生,因离子在晶核表面沉淀的活化能较成核所需活化能更低,晶体生长速率更快,晶体开始生长。溶液中的镁离子质量浓度越高,平衡向沉淀产生方向移动,反应接近完全,TP的去除作用越明显;当镁源投加量为60 mg/L时,磷酸铵镁微溶于水,此时PO43-、NH4+与Mg2+质量浓度达到该温度下的沉淀平衡,但过量增大镁盐投加量会使溶液中Mg2+和PO43-发生副反应生成Mg3(PO4)2的趋势增大,从而使氨氮的脱除效果降低。继续投加镁源,除磷脱氮效率无显著增加。MgCl2与MgO对比之后可以发现,前者的效果要优于后者,由于所处理污水原水pH值为7.84,呈弱碱性,且MgO在碱性环境下溶解度小, 在沉淀反应开始前未完全溶解, 生成的MAP沉积在未溶解的MgO表面, 导致部分MgO被MAP包裹在内部而无法与溶液充分接触,使反应不完全,因此MgO对于除磷脱氮的作用有限[11]。基于对成本和药剂需求量考虑,以NaOH质量浓度为150 mg/L,MgCl2质量浓度为60 mg/L为最佳投药量。
2.3 钙盐对除磷脱氮的影响
向污水中投加钙盐是利用结晶原理[12],在碱性条件下,Ca2+与PO43-在碱性条件下反应生成Ca10(OH)2(PO4)6。金属离子与磷酸根离子结合,长出晶核至结晶,以沉淀形式过滤脱除磷。方程式如下:
10Ca2++2OH-+6PO43-→Ca10(OH)2(PO4)6↓.
随着溶液的碱度越强,Ca10(OH)2(PO4)6越易结晶沉降,当pH值大于7时,游离磷与晶体内核碰撞,Ca10(OH)2(PO4)6在晶核表面沉着以此除磷。
2.3.1 NaOH投加量
在污水中单独添加镁源对除磷脱氮有一定作用,为保证高去除率,防止污水指标波动对进出水造成冲击,添加钙盐与镁盐复配,在控制磷含量基础上,继续提高磷的去除率。在污水TP质量浓度为3.87 mg/L、TN质量浓度为24.41 mg/L、NH3-N质量浓度为15.76 mg/L,CaCl2质量浓度为80 mg/L的条件下进行实验,结果见图3。
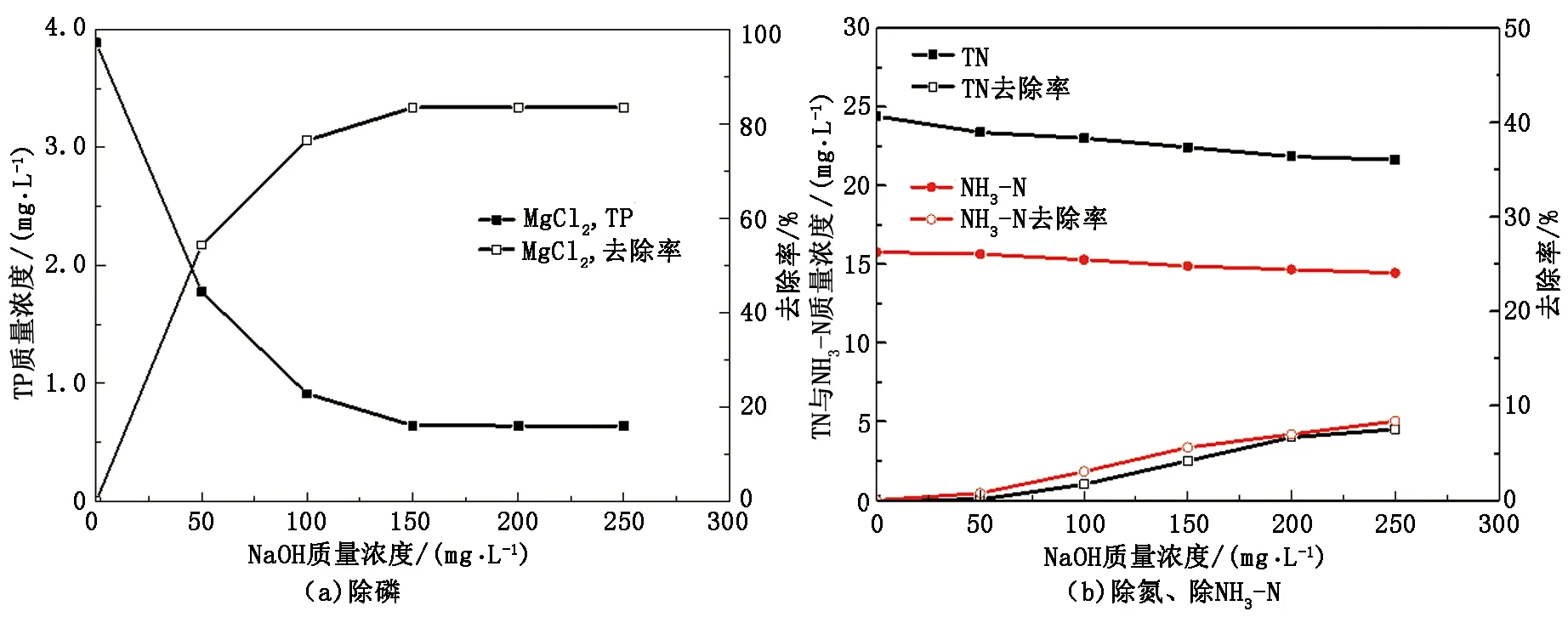
图3 w(CaCl2)为80 mg/L时NaOH对去除TP、TN、NH3-N的影响Fig.3 Effects of NaOH concentration on TP, TN and NH3-N removal whilew(CaCl2)=80 mg/L
从图3可知,CaCl2质量浓度为80 mg/L时,NaOH投加量由50 mg/L增加至250 mg/L时,污水TP含量逐渐降低,当NaOH质量浓度为150 mg/L时,TP趋于稳定,除磷率为83%。其原因是羟基磷酸钙随pH的增加溶解度降低;从羟基磷酸钙的方程式中可以看出,当溶液中的磷元素以PO43-形式存在时,沉淀才会产生,从而达到除磷的目的。而水中磷元素的存在形式有H2PO4-、HPO42-、PO43-,随pH值的逐渐增加,PO43-所占分数越大,越有利于磷酸羟基钙的形成[13]。且当溶液pH值过高时,Ca2+会与OH-结合形成Ca(OH)2沉淀,从而影响羟基磷酸钙的形成,使除磷率没有得到进一步的提高。当NaOH质量浓度为150 mg/L时,pH值约为9.2,此时PO43-所占分数趋于平稳,TP去除率稳定为77.2%。然而NaOH的投加量增多,pH值升高会造成污水碱度过高,故以下实验NaOH质量浓度固定在150 mg/L。
2.3.2 CaCl2投加量
污水TP质量浓度为3.87 mg/L、TN质量浓度为24.41 mg/L、NH3-N质量浓度为15.76 mg/L,NaOH投加量为150mg/L时,改变CaCl2的投加量,结果见图4。
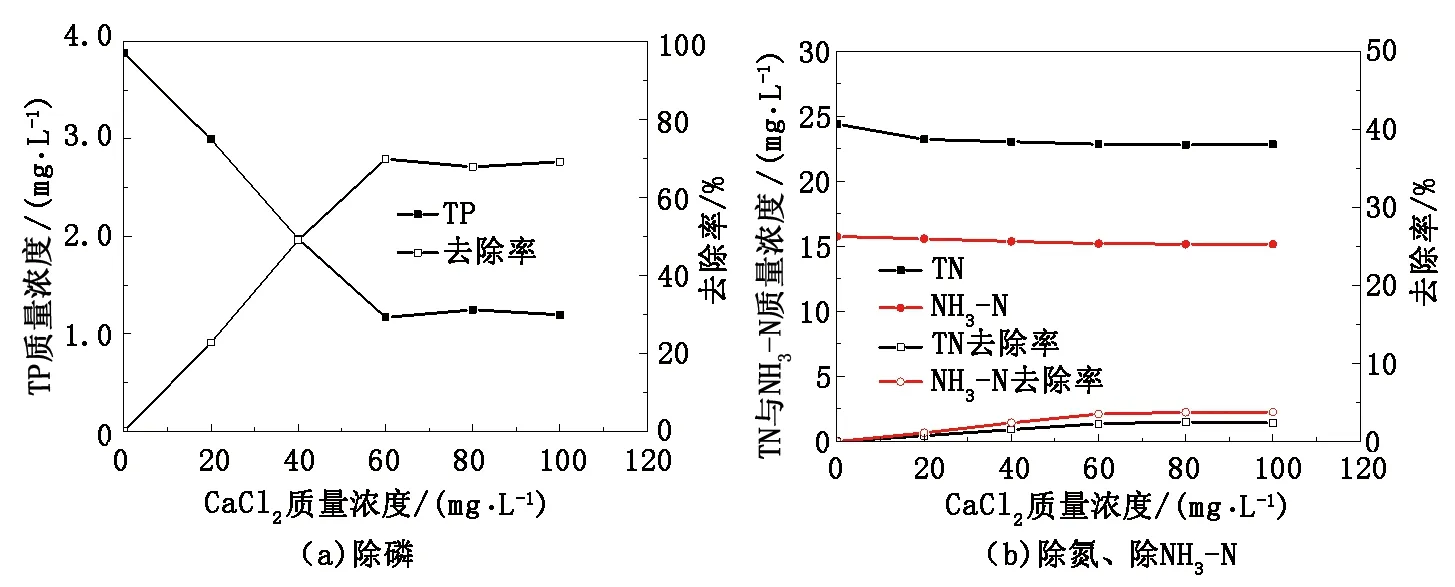
图4 CaCl2对去除TP、TN、NH3-N的影响Fig.4 Influences of CaCl2 concentration on TP,TN and NH3-N removal
从图4看出,随CaCl2投加量的增加,TP去除率达到69%。由于原污水中的TP质量浓度高,处理后的TP质量浓度为1.19 mg/L,未达到0.5 mg/L以下,并未实现达标处理。当Ca2+、PO43-、OH-的质量浓度积达到磷酸羟基钙Ksp时,溶液过饱和析出结晶,形成沉淀。由实验结果可知,钙盐法对TP有明显作用,但对TN和NH3-N影响较弱。TN和NH3-N略有降低的原因是产物羟基磷酸钙作为一种沉淀吸附剂可以吸附周围少量的铵根离子,但吸附能力有限。经过钙盐与镁盐研究可发现,当二者单独投加量增加到一定值时,此时同种离子达到饱和,反应接近平衡,继续投加药剂,TP、TN、NH3-N质量浓度不再变化。为有效除磷脱氮,本实验将钙盐与镁盐进行复配,探究钙镁最佳配比,实现除磷脱氮的最佳配方。
2.3.3 以CaCl2为变量与镁盐进行复配
从图5看出,在NaOH质量浓度为150 mg/L,MgCl2质量浓度为60 mg/L条件下,CaCl2的质量浓度从20 mg/L升高到60 mg/L时,TP从3.87 mg/L降至0.31 mg/L,去除率超过90%,与单独投加镁盐相比,去除率提高了8%;在CaCl2质量浓度升高的过程中,TN和NH3-N质量浓度出现先降低后升高的现象,出现峰值时 TN从24.41 mg/L降至18.97mg/L,NH3-N从15.76 mg/L降至11.87 mg/L,去除率达到25%。文献[14]指出,Ca2+加入过多会导致Ca2+掺入 MAP 晶体中,导致晶体结构改变,将生成的产物加热后发现 Ca2+替代部分Mg2+,形成共价化合物白化石(Ca,Mg)3(PO4)2,故加入过量CaCl2会影响MAP沉淀的产生进而影响TN、NH3-N的去除。钙镁复配方法与镁盐法相比,除磷率提高了90%。
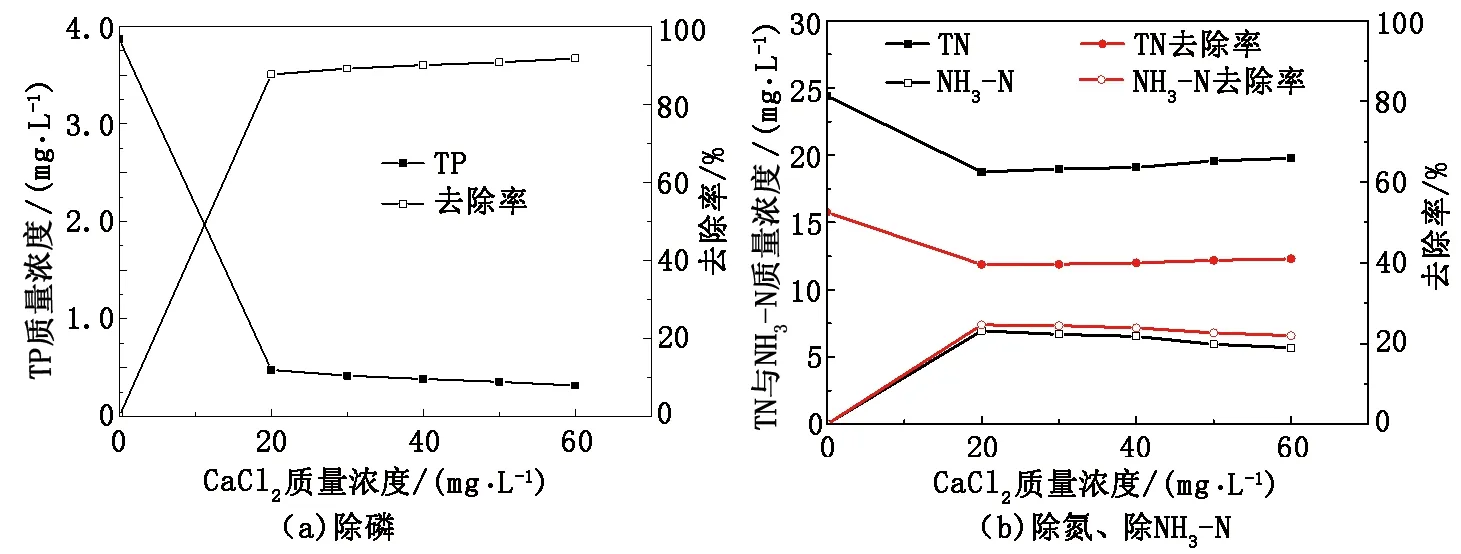
图5 钙镁复配对去除TP、TN、NH3-N的影响Fig.5 Effect of calcium and magnesium composite on TP,TN and NH3-N removal
2.4 钙镁复配除磷动态试验
基于对钙镁复配静态实验的数据,在保证TP、TN、NH3-N去除率的基础上,为降低成本对药剂量进行调整,现搭建一套小试装置进行试验(动态试验),考察NaOH、MgCl2、CaCl2投加量对除磷脱氮的影响,试验流程见图6。
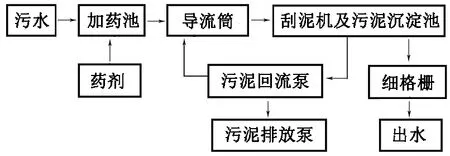
图6 动态试验流程Fig.6 Dynamic testflow diagram
2.4.1 NaOH投加量
在静态实验中利用NaOH作为pH调节剂,得知pH值与除磷脱氮的关系。在动态试验中缩小pH值范围,确定适宜NaOH投加量。在污水TP、TN、NH3-N质量浓度分别为3.87、24.41和15.76 mg/L,MgCl2投加量为60 mg/L条件下进行试验,结果见图7。
由图7可知,随NaOH投加量增多,TP质量浓度逐渐降低,最低降至0.23 mg/L。当NaOH质量浓度为105 mg/L时,TP质量浓度为0.48 mg/L,小于0.5 mg/L,已达到国家污水处理一级A标准,此时除磷率达到84%;TN可达到的最低质量浓度为18 mg/L,当NaOH投加量为105 mg/L时,TN质量浓度为19.3 mg/L,去除率达到30%,NH3-N可达到的最低质量浓度为15.92 mg/L,其中当NaOH投加量为105 mg/L时,NH3-N质量浓度为17.05 mg/L,去除率为30%;为控制成本,选取NaOH投加量为105 mg/L,此时TP已达到国家标准,TN和NH3-N去除率达到30%。动态试验中NaOH最佳投加量小于静态实验,是因为在静态试验中使用的是固体NaOH,影响离子结合的速度,造成局部质量浓度过高,不利于反应进行,在动态试验中将NaOH配制溶液,有利于离子结合,加快反应速度,促进反应进行。
2.4.2 MgCl2投加配比
为了调整动态试验中各项药剂的配比,降低成本,在一定NaOH投加量下,考察MgCl2投加量对污水除磷脱氮效果的影响。在NaOH质量浓度为105 mg/L,污水TP质量浓度为3.87 mg/L、TN质量浓度为24.41 mg/L、NH3-N质量浓度为15.76 mg/L条件下进行,结果见图8。
从图8看出,随MgCl2投加量的增多,TP、TN、NH3-N质量浓度逐渐降低,去除率升高,此结论与静态实验一致;TP质量浓度最低降至0.35 mg/L,TN质量浓度最低降至16.08 mg/L,NH3-N质量浓度最低降至10.03 mg/L。在MgCl2投加量为48 mg/L时,TP质量浓度为0.412 mg/L,去除率为85%;TN质量浓度为17.4 mg/L,去除率为28%;NH3-N质量浓度为10.89 mg/L,去除率为30%。在动态实验中,氯化镁最佳投加量较静态实验较低,其原因是试验过程中将氯化镁配制成溶液,有利于离子自由移动,促进Mg2+参与反应,加快了磷酸铵镁晶体结晶速度,利于反应进行。由此可见,当NaOH质量浓度为105 mg/L,MgCl2投加量为48 mg/L时,TP已达到国家污水处理一级A标准,而且氨氮去除率达到30%。
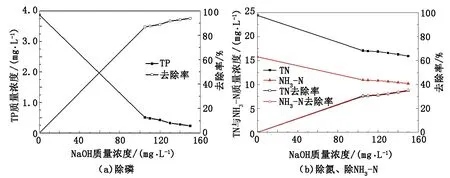
图7 动态试验中NaOH对去除TP、TN、NH3-N的影响Fig.7 Influence of NaOH on TP,TN and NH3-N removal in dynamic test
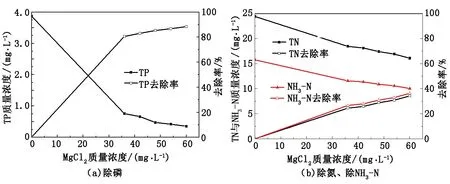
图8 动态试验中MgCl2对去除TP、TN、NH3-N的影响Fig.8 Effect of MgCl2 on TP,TN and NH3-N removal in dynamic test
2.4.3 CaCl2投加配比
基于静态实验中所用的钙镁复配法除磷脱氮效率较高,对于动态试验中的各项药剂配比需进行重新调整,在实现磷达标的基础上,降低成本。在NaOH和MgCl2质量浓度分别为105和48 mg/L,改变CaCl2的质量浓度,在污水TP、TN和NH3-N质量浓度分别为为3.87、24.41和15.76 mg/L条件下进行试验,结果见图9。
由图9看出,随CaCl2投加量的增加,TP质量浓度逐渐降低,除磷率升高,TN、NH3-N变化并不明显。与镁盐法相比除磷率有所提高,TP质量浓度从3.87 mg/L降到0.34 mg/L,达到国家标准,并且去除率达到90%以上。TN、NH3-N去除率达到30%以上;在CaCl2质量浓度为24 mg/L时,除磷率已达90%,氨氮去除率达到30%,考虑到成本问题,在动态试验中,钙镁复配配方中NaOH、MgCl2、CaCl2的质量浓度分别调整为105、48和24 mg/L。
3 结 论
(1)使用钙镁复配药剂对高氮磷含量污水的除磷脱氮实验中,NaOH、MgCl2和CaCl2的质量浓度分别为150、60和40 mg/L时,TP去除率达到90%,TN和NH3-N去除率达到25%。
(2)动态试验中,NaOH、MgCl2和CaCl2的投加量分别为105、48和24 mg/L时,TP去除率达到90%,TN和NH3-N去除率均达到30%。