米曲霉固态发酵程度对大豆拉丝蛋白特性的影响
2019-05-13蒋肇样贾冬英张佳琪
柳 旺,蒋肇样,贾冬英,张佳琪,姚 开
(四川大学 轻纺与食品学院,成都 610065)
大豆拉丝蛋白(DSP)是以脱脂豆粕为主要原料,通过热塑性挤压形成的组织化高蛋白制品[1],具有与肌肉纤维相似的黏弹性和咀嚼性,可以替代部分畜禽肉添加于肉制品(香肠、饺子馅等)中,也可直接加工成素食制品(素香肠、素火腿等),提高其营养价值或改善其口感[2]。然而,由于DSP加工过程的高温和高压作用使其蛋白质高度变性,导致其溶解度和再加工性较差,难以与其他物料有效复合,致使DSP应用范围受到一定的限制,其产品的市场接受度较低[3-4]。采用生物技术水解蛋白质可以改变DSP的某些特性,如Kim等[5]发现枯草芽孢杆菌发酵的DSP多肽含量提高了64倍,Lee等[6]发现蛋白酶水解的DSP溶解度提高了53.28%。米曲霉固态发酵酿造调味品过程中产酶效率高,且蛋白质等大分子物质的水解产物可以较好地保留于产品中[7]。鉴于此,本文采用米曲霉固态发酵法处理DSP,研究了发酵程度对DSP特性的影响,分析了DSP水解度与持水性、溶解度、质构特性之间的相关性,以期为DSP某些加工特性的改善提供参考。
1 材料与方法
1.1 实验材料
米曲霉孢子,百惠生物科技有限公司;DSP,某食品有限公司;PDA培养基,北京陆桥技术有限公司;ANS荧光探针,梯希爱上海化成工业发展有限公司;其他试剂均为国产分析纯。
KDN-04A定氮仪,上海昕瑞仪器仪表有限公司;TA.XT.Plus物性测试仪,英国Stable Micro System公司;F-7000荧光分光光度计,日本HITACHI公司。
1.2 实验方法
1.2.1 菌悬液制备
取少量米曲霉孢子接入PDA培养基,30℃活化72 h,无菌生理盐水洗下孢子,四层纱布过滤,血球计数板计数,无菌生理盐水调节孢子悬浮液浓度为107个/mL。
1.2.2 DSP发酵
将DSP于室温下复水至无硬芯,成型为5 mm厚片状,隔水蒸制15 min,冷却,挤压,控制其含水量为70%,接种1%的米曲霉孢子悬浮液,混匀,30℃发酵一定时间。
1.2.3 检测方法
1.2.3.1 水解度的测定
参照邓露芳等[8]方法并略作修改。称取2.00 g发酵样品,充分研磨,加入100 mL去离子水,振荡,5 000 r/min离心10 min,取上清液5 mL,加入60 mL去离子水,混匀,用0.1 mol/L NaOH溶液滴定至pH 8.2,加入pH 8.2甲醛溶液10 mL,室温静置3 min后用0.1 mol/L NaOH溶液滴定至pH 9.2,记录NaOH消耗量(V2,mL);以未发酵的复水样品作为空白对照(水解度为0),记录NaOH消耗量(V1,mL)。按下式计算样品氨基酸态氮含量。
氨基酸态氮含量=(V2-V1)×0.1×20/2×0.014×100%
样品总氮含量的测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,按下式计算样品水解度。
水解度=氨基酸态氮含量/总氮含量×100%
1.2.3.2 持水性的测定
定量称取DSP发酵样品(W1),离心脱水(4 500 r/min)20 min,称重(W2)。按下式计算样品持水性。
持水性=W2/W1×100%
1.2.3.3 溶解度的测定
参照Shen等[9]方法并略作修改。称取2.00 g发酵样品,充分研磨,加入100 mL去离子水,磁力搅拌1 h,5 000 r/min离心10 min,按GB 5009.5—2016的方法测定上清液中氮含量。按下式计算样品溶解度。
溶解度=上清液氮含量/样品总氮含量×100%
1.2.3.4 表面疏水性的测定
参照Li等[10]的方法并略作改进。用去离子水将1.2.3.1中上清液蛋白质的质量浓度稀释至0.01~0.5 mg/mL,取4 mL不同蛋白质质量浓度的上清液,分别加入40 μL 0.1 mol/L的磷酸盐缓冲液(内含8 mmol/L ANS,pH 7.0),振荡,室温静置3 min,然后进行荧光强度检测。荧光强度的检测条件为:激发波长375 nm,发射波长494 nm。以荧光强度对蛋白质的质量浓度作图,以其直线方程中斜率表示此水解度下DSP的表面疏水性。
1.2.3.5 质构特性的测定
样品成型为20 mm×20 mm×5 mm片状。DSP质构剖面分析(TPA)包括硬度、咀嚼性、弹性和内聚性,其测定参数为:P/36R探头两次压缩,间隔3 s,下压距离15 mm,测前速度、测定速度和测后速度均为2.0 mm/s,下压程度75%,触发力5 g。组织化度测定参数为:HDP/BSW探头,测前速度、测定速度和测后速度均为2.0 mm/s,下压程度75%,用横向剪切力与纵向剪切力的比值表征组织化程度。
1.2.4 数据分析
实验平行重复3次,结果以“均数±标准偏差”表示。采用Origin Pro 9.0软件作图、SPSS 17.0软件分析差异显著性和相关性。
2 结果与讨论
2.1 发酵时间对DSP水解度的影响(见图1)

图1 发酵时间对DSP水解度的影响
由图1可以看出,随着发酵时间的延长,DSP的水解度增大,表明DSP可以被米曲霉分泌的蛋白酶水解,其水解度与发酵程度有关。当发酵时间为84 h时,水解度为8.39%,此时DSP失去原有的组织化结构,表明其水解过度。
2.2 水解度对DSP持水性的影响
持水性表现为DSP保持自身水分的能力,是蛋白质与水相互作用能力的重要体现,持水性不仅与蛋白质分子的大小和结构有关,还受到蛋白质交联作用的影响[11]。水解度对DSP持水性的影响如图2所示。

图2 水解度对DSP持水性的影响
由图2可以看出,随着水解度的增加,DSP持水性先增加后降低,这是由于水解度的提高会减弱蛋白质分子间的共价交联作用,增大其分子间的空隙,有利于蛋白质溶胀程度和截留水分子能力的提高,但过高的水解度会导致蛋白质分子间的空隙过大,对水的截留反而不利[12]。当DSP的水解度为3.63%时,持水性最高(78.24%),较之未发酵样品提高了21.41%。
2.3 水解度对DSP溶解度的影响
溶解度是蛋白质的重要特性之一,与其加工特性紧密相关。水解度对DSP溶解度的影响如图3所示。

图3 水解度对DSP溶解度的影响
由图3可以看出,随着水解度增大,DSP溶解度增加,这是由于DSP的水解会破坏其凝胶结构,使蛋白质分子亲水基团暴露,导致蛋白质分子间相互排斥力增大[13]。当水解度为3.63%时,溶解度较未发酵样品提高了115.26%。
2.4 水解度对DSP表面疏水性的影响
DSP的疏水作用是维持凝胶结构的重要作用力之一,且蛋白质的表面疏水性是反映变性程度的重要指标。水解度对DSP表面疏水性的影响如图4所示。

图4 水解度对DSP表面疏水性的影响
由图4可以看出,随着水解度增大,DSP表面疏水性下降,这是由于DSP的部分水解使其高级结构发生改变,位于其结构内部的羧基和氨基等亲水基团暴露的缘故[14]。该结果进一步佐证了米曲霉发酵水解DSP可在一定程度上改变其溶解性和持水性。
2.5 水解度对DSP质构特性的影响(见表1)

表1 水解度对DSP质构特性的影响
由表1可以看出,DSP硬度和咀嚼性随水解度增大呈现先增大后减小的趋势,硬度变化的原因是较低水解度时米曲霉菌丝的包裹作用使其硬度增大[15],但过高的水解度会使其纤维化碎片增多,硬度降低。DSP的弹性表现出随水解度增大逐渐减小的趋势,这是由于其纤维化凝胶结构的破坏导致了其恢复原有形状的能力降低;内聚性的变化趋势与弹性相同,这是由于发酵后维持DSP凝胶结构的蛋白质分子间疏水作用和二硫键受到破坏,导致其蛋白凝胶网络对外力的抵抗作用降低[16]。当水解度为3.63%时,DSP的硬度提高了13.04%,咀嚼性提高了20.00%,弹性和内聚性分别降低了7.30%和13.33%。
2.6 水解度对DSP组织化度的影响
组织化度常用于表征DSP的纤维化程度。水解度对DSP组织化度的影响如图5所示。

图5 水解度对DSP组织化度的影响
由图5可以看出,随着水解度的增大,DSP组织化度逐渐降低,这是由于DSP纤维化凝胶结构的破坏使其横向剪切力的降低程度高于纵向剪切力[17]。当水解度为3.63%时,组织化度降低了10.41%。
2.7 水解度与DSP特性的相关性
皮尔逊相关系数可以用来表征不同指标之间的相关性。米曲霉发酵DSP的水解度与其特性之间的相关性见表2。
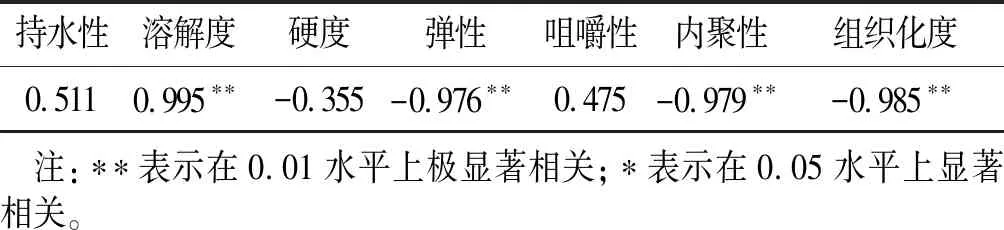
表2 水解度与DSP特性的相关系数
由表2可以看出,DSP水解度与溶解度呈极显著正相关(P<0.01),与弹性、内聚性和组织化度呈极显著负相关(P<0.01),与持水性、硬度和咀嚼性无相关性。
3 结 论
采用米曲霉固态发酵法可以使DSP的特性发生某些变化,适宜水解度可以改善DSP的部分特性。当水解度为3.63%时,其持水性、溶解度、硬度和咀嚼性分别提高了21.41%、115.26%、13.04%和20.00%,但其弹性、内聚性和组织化度分别降低了7.30%、13.33%和10.41%。大豆拉丝蛋白的水解度与其溶解度呈极显著正相关,与其弹性、内聚性和组织化度呈极显著负相关。
