心房颤动患者外周血淋巴细胞β3 肾上腺素受体的表达水平及临床意义
2019-05-13张梓桑张薪茹张庄李光宇张劲松杜荣增
张梓桑,张薪茹,张庄,李光宇,张劲松,杜荣增
心房颤动(房颤)是临床上最常见、治疗上最具挑战性的快速性心律失常[1],其具有高致残率、高病死率、高复发率的特点[2]。近年来,房颤已成为一个全球公共卫生问题。房颤的发病率不断提高,预计到2050 年,房颤患者人数将达到7 200 万,其中290 万有发生房颤相关卒中的风险[3-5]。近期研究发现,β3-肾上腺素受体(AR)表达水平在房颤犬模型中明显升高,且激动β3-AR 可导致心房肌细胞凋亡以及间质纤维化进一步加剧,相反,使用β3-AR拮抗剂可抑制心房重构[6]。虽然已有基础研究报道β3-AR 与动物房颤模型存在相关性,但β3-AR 在房颤患者中的表达变化却鲜有报道。本研究通过比较健康对照受试者与房颤患者外周血淋巴细胞β3-AR的表达水平,旨在分析β3-AR 表达水平与房颤已知影响因素的相关性,了解其对房颤的预测价值,为房颤治疗提供新的潜在靶点。
1 资料与方法
研究对象:选取2017 年6 月至2018 年7 月在江苏大学附属医院管内科住院的98 例房颤患者作为房颤组,包括35 例阵发性房颤患者、33 例持续性房颤患者和30 例永久性房颤患者。另外选择门诊健康体检者31 例作为对照组。房颤根据2016 年欧洲房颤管理指南[7]中的相关标准进行诊断。阵发性房颤:自行终止,大多数持续时间在48 小时内;持续性房颤:持续时间超过7 天或使用电复律、药物复律;永久性房颤:不能转复为窦性心律或在转复后24 小时内复发。排除标准:(1)纽约心脏协会心功能分级Ⅲ或Ⅳ级;(2)左心室射血分数(LVEF)<50%;(3)近期(6 个月内)发生血栓栓塞的患者;(4)风湿性心脏病患者;(5)心肌病患者;(6)甲亢患者;(7)控制不良的高血压或糖尿病患者;(8)细菌感染或病毒感染患者。所有受试者均知情同意,该研究经江苏大学附属医院伦理委员会审查通过。
研究方法:比较两组受试者以及不同类型房颤患者的一般临床资料、生化指标、主要心脏结构功能指标、β3-AR 信使核糖核酸(mRNA)表达水平,评估房颤患者β3-AR mRNA 相对表达水平与房颤潜在影响因素的相关性及β3-AR mRNA 相对表达水平对心房颤动预测价值。
一般临床资料收集和心脏结构功能检查:收集两组受试者包括病史、吸烟史和饮酒史等在内的基本临床资料。经全自动血液生化分析仪获取两组受试者血清总胆固醇(TC)、甘油三酯(TG)、载脂蛋白A(ApoA)、载脂蛋白B(ApoB)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、C 反应蛋白(CRP)、血肌酐水平。经超声科专人对两组受试者进行超声心动图检查,获取左心房内径(LAD)、左心室舒张末期内径(LVIDd)、LVEF 和肺动脉压力(PAP)等指标数据。比较两组受试者上述指标的差异。
试剂、仪器及β3-AR 的引物:淋巴细胞分离液Ficoll-Paque Plus(通用电气医疗集团,美国)、荧光实时定量聚合酶链式反应(PCR)试剂盒(TaKaRa公司,日本)、SYBR®Premix Ex Taq™(TaKaRa 公司,日本)、LightCycler®96 实时荧光定量PCR 仪(赛默飞世尔科技公司,美国)。β3-AR、β 肌动蛋白基因引物序列由生工生物工程(上海)股份有限公司设计合成。β3-AR、β 肌动蛋白基因引物序列见表1。引物合成后用焦碳酸二乙酯水溶解,并于-20℃保存备用。
外周血淋巴细胞分离:所有受试者入院后空腹于肘静脉处予肝素抗凝管抽取血5 ml,加入等体积的磷酸缓冲盐溶液(PBS)稀释后充分混匀,再于另一试管中加入与稀释抗凝血等体积的淋巴细胞分离液,用滴管沿管壁缓慢将其加于分离液面上,始终保持两液面界面清晰,水平离心1 800 r/min,共35 min(15℃)。吸出中上层液面处的白色云雾状淋巴细胞,加入4~5 倍体积PBS 液混匀,水平离心1 500 r/min,每次7 min,离心2 次(4℃)。本过程均于采血后3 h 内完成。
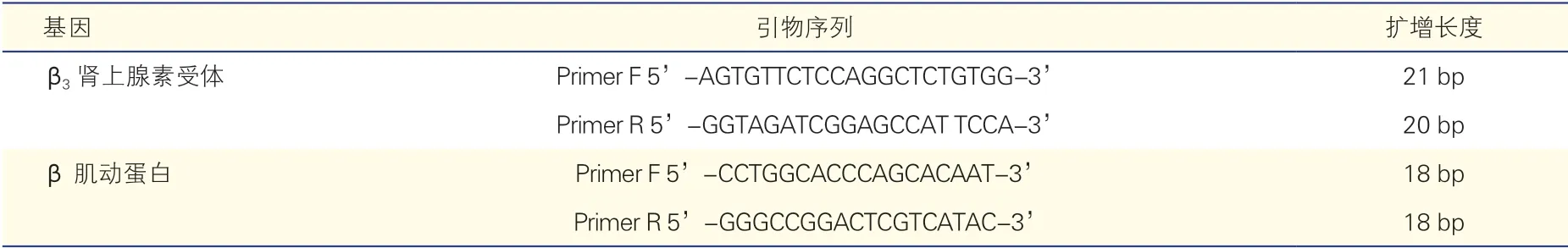
表1 β3 肾上腺素受体和β 肌动蛋白基因的引物序列及扩增长度
总核糖核酸(RNA)提取及互补脱氧核糖核酸(cDNA)合成:TRIZOL 法提取分离得到的淋巴细胞总RNA;使用紫外分光光度计测定RNA 浓度及纯度,要求所有样本的吸光度(OD)260/280 处于1.8~2.0的范围内。cDNA 的合成参照TaKaRa 公司试剂盒说明书,所得cDNA 存放于-20℃冰箱备用。
荧光实时定量PCR 检测β3-AR mRNA 的表达水平:PCR 反应在25 μl 反应体系中进行,反应条件:95℃ 6 min;95℃ 12 s;62℃ 40 s,循环40 次,组内重复3 次取平均值,以ct 值表示,β3-AR 的相对表达量用2-ΔΔct表示。Δct 和ΔΔct 值通过以下公式计算:Δct=ctβ3-AR-ctβ肌动蛋白和ΔΔct=Δct房颤组-Δct对照组。将对照组β3-AR 表达量的测量值设定为1.00±0.00,房颤组数据与之进行比较,得到相对表达量。
统计学方法:所有实验数据使用SPSS 22.0 统计软件进行分析。如果连续变量呈正态分布,以均数±标准差(±s)表示,组间比较采用独立样本t 检验。如果连续变量非正态分布,以中位数(四分位数间距)表示,组间比较则采用非参数Mann-Whitney U 检验。多组间均数比较采用ANOVA 方差分析。分类变量采用卡方检验或Fisher 精确检验。相关性分析采用Pearson 相关分析。用受试者工作特征(ROC)曲线分析β3-AR 表达水平对房颤的预测价值。P<0.05 为差异有统计学意义。
2 结果
两组受试者的一般临床资料、生化指标及主要心脏结构功能指标比较(表2):房颤组与对照组在性别、年龄、吸烟史、饮酒史、糖尿病病史及血清TC、TG、ApoA、ApoB、HDL-C、血肌酐水平、LVIDd 等方面的差异均无统计学意义(P 均>0.05);两组间高血压和冠心病患者比例差异均有统计学意义(P 均<0.05)。与对照组相比,房颤组的血清LDL-C、CRP 水平升高,LAD 增大,而LVEF 降低,差异均有统计学意义(P 均<0.05)。
不同类型房颤患者的一般临床资料、生化指标及主要心脏结构功能指标比较(表3):阵发性房颤、持续性房颤和永久性房颤患者的LAD、LVEF、PAP和血清CRP 水平差异均有统计学意义(P 均<0.05),其余资料和指标上的差异均无统计学意义(P 均>0.05)。
两组受试者β3-AR mRNA 表达水平比较:房颤组的β3-AR mRNA 表达水平明显高于对照组,相对表达水平为3.16±2.50,差异有统计学意义(P<0.05)。随着房颤持续时间越长,阵发性房颤、持续性房颤和永久性房颤患者的β3-AR mRNA 相对表达水平依次升高[依次为1.90±0.96、2.92±1.45、4.89±3.54],组间比较差异均有统计学意义(P 均<0.05)。
房颤患者β3-AR mRNA 相对表达水平与房颤潜在影响因素的相关性分析(表4):Pearson 相关分析显示,房颤患者β3-AR mRNA 相对表达水平与LAD 呈正相关(r=0.314,P<0.05)。偏相关分析表明,调整性别、年龄、高血压等因素后,房颤患者β3-AR mRNA 相对表达水平仍与LAD 呈正相关(r=0.256,P<0.05)。
多因素Logistic 回归分析及 ROC 曲线分析(表5、图1):对两组差异具有统计学意义的LAD、LVEF、CRP、LDL、β3-AR mRNA 相对表达水平进行多因素Logistic 回归分析后发现,LAD(OR=1.326,95%CI:1.012~1.431,P=0.036)、CRP(OR=3.581,95%CI:1.670~7.676,P=0.001)、β3-AR mRNA 相对 表 达 水 平(OR=16.644,95%CI:1.106~250.503,P=0.027)为房颤的独立预测因素。ROC 曲线分析表明,β3-AR mRNA 相对表达水平预测房颤的曲线下面积为0.734(95%CI:0.639~0.829,P<0.05)。
表2 两组受试者的一般临床资料、生化指标和及主要心脏结构功能指标比较

表2 两组受试者的一般临床资料、生化指标和及主要心脏结构功能指标比较
注:LVIDd:左心室舒张末期内径;LVEF:左心室射血分数;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇。*:非正态分布数据,用中位数(四分位数间距)表示。1 mmHg=0.133 kPa
项目 对照组 (n=31) 房颤组 (n=98) P 值年龄 (岁) 58.45±9.95 63.93±7.64 0.054性别 (男/女) 17/14 52/46 0.863吸烟史[例 (%)]9 (29.03) 22 (22.45) 0.455饮酒史[例 (%)]14 (45.16) 28 (28.57) 0.086高血压[例 (%)]0 (0) 28 (28.57) 0.001冠心病[例 (%)]0 (0) 17 (17.35) 0.013糖尿病[例 (%)]0 (0) 9 (9.18) 0.080左心房内径 (mm) 34.32±4.16 45.70±6.88 0.005肺动脉压力 (mmHg) 28.16±5.29 31.05±4.27 0.139甘油三酯 (mmol/L) 1.15±0.47 1.32±0.42 0.483 LVIDd (mm)* 41 (9.00) 41 (8.25) 0.996 LVEF (%)* 60 (9.00) 54 (6.00) 0.000总胆固醇 (mmol/L)* 3.93 (1.90) 4.09 (1.58) 0.482载脂蛋白A (mmol/L)* 1.33 (0.43) 1.30 (0.44) 0.591载脂蛋白B (mmol/L)* 0.81 (0.25) 0.82 (0.35) 0.565 LDL-C (mmol/L)* 2.28 (1.56) 2.96 (1.90) 0.002 HDL-C (mmol/L)* 1.29 (0.63) 1.33 (0.72) 0.507 C 反应蛋白 (mg/L)* 1.29 (1.04) 5.15 (2.80) 0.000血肌酐 (μmol/L)* 62.70 (28.30) 64.45 (25.83) 0.297
表3 不同类型心房颤动患者一般临床资料、生化指标及主要心脏结构功能指标比较(s)

表3 不同类型心房颤动患者一般临床资料、生化指标及主要心脏结构功能指标比较(s)
注:LAD:左心房内径;LVIDd:左心室舒张末期内径;LVEF:左心室射血分数;PAP:肺动脉压力;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;CRP:C 反应蛋白。1 mmHg=0.133 kPa
项目 阵发性心房颤动患者 (n=35) 持续性心房颤动患者 (n=33) 永久性心房颤动患者 (n=30) P 值性别 (男/女, 例) 16/19 18/15 18/12 0.505年龄 (岁) 62.11±8.64 63.52±6.87 66.50±6.84 0.063吸烟史[例 (%)]9 (25.71) 7 (21.21) 6 (20.00) 0.841饮酒史[例 (%)]10 (28.57) 12 (36.36) 9 (30.00) 0.767高血压[例 (%)]8 (22.86) 10 (30.30) 10 (33.33) 0.624冠心病[例 (%)]6 (17.14) 6 (18.18) 5 (16.67) 0.987糖尿病[例 (%)]3 (8.57) 2 (6.06) 4 (13.33) 0.600 LAD (mm) 39.57±5.15 45.76±4.07 52.80±3.40 0.000 LVIDd (mm) 42.03±5.49 42.39±5.50 43.57±4.90 0.489 LVEF (%) 57.66±4.87 54.55±2.97 51.40±2.53 0.000 PAP (mmHg) 28.57±4.05 32.48±3.78 32.37±3.81 0.000总胆固醇 (mmol/L) 4.18±0.88 4.19±0.82 3.86±1.00 0.245甘油三酯 (mmol/L) 1.33±0.39 1.42±0.46 1.20±0.41 0.128载脂蛋白A (mmol/L) 1.21±0.25 1.36±0.24 1.28±0.33 0.071载脂蛋白B (mmol/L) 0.87±0.25 0.80±0.21 0.87±0.23 0.331 LDL-C (mmol/L) 2.96±1.01 2.88±0.96 3.06±1.27 0.792 HDL-C (mmol/L) 1.34±0.54 1.52±0.39 1.35±0.50 0.256 CRP (mg/L) 4.26±1.81 5.88±2.46 6.46±2.44 0.000血肌酐 (μmol/L) 64.60±20.90 68.17±22.61 70.10±22.78 0.594

表4 心房颤动患者β3 肾上腺素受体 mRNA 相对表达水平与心房颤动潜在影响因素的相关性分析

表5 心房颤动潜在预测因素的多因素Logistic 回归分析

图1 β3 肾上腺素受体mRNA 相对表达水平对心房颤动预测价值的受试者工作特征曲线分析
3 讨论
房颤是风湿性心脏瓣膜病、冠心病、高血压、先天性心脏病等多种心血管疾病的常见临床表现[8]。房颤导致心房血流不规则,形成血栓,最终发生脑卒中或心力衰竭等恶性心脑血管事件,严重危害人类健康[9-10]。在心力衰竭患者中,合并房颤者死亡率明显上升[11]。目前房颤治疗效果不理想,因此房颤的预防和治疗一直是心血管领域的热点问题。
本研究结果表明,不同类型房颤患者的LAD、LVEF、PAP、CRP 水平有明显差异。如果房颤持续存在,心房结构将发生不可逆的损坏,导致左心功能下降,表现为LAD 增大,LVEF 降低,这也再次验证了木胡牙提等[12]的研究结果。
在房颤的发生与维持过程中,心房电、结构和代谢会发生一系列显著的改变[13-14],这些改变反过来又促进房颤的发展和自我维持,造成恶性循环[15]。Wang 等[16]通过实验发现,β3-AR 在犬房颤模型中的表达上调,随后诱导型一氧化氮合酶(iNOS)解偶联,一氧化氮产生减少,氧化应激进一步加重,最终导致心房结构重构。已有实验证明,iNOS 与炎症和氧化应激密切相关,而炎症和氧化应激都参与房颤患者的心房结构重构[17]。本研究发现,房颤患者的血清CRP 水平较对照组显著升高,验证了炎症参与房颤的发生。
β3-AR 是具有7 个跨膜结构域的G 蛋白偶联受体。随着β3-AR 与心血管疾病的研究逐渐深入,目前已有许多研究证明β3-AR 与动脉粥样硬化和心力衰竭有关[18-21]。Dong 等[22]在兔房颤模型中通过激动β3-AR 发现,兔心脏线粒体功能受损,心房有效不应期缩短,房颤诱导率升高,β3-AR 激动后通过过氧化物酶体增殖物激活受体γ 共激活因子1α(PGC-1α)/核呼吸因子1(NRF-1)/线粒体转录因子A(Tfam)信号通路促进心房代谢重构。Yu 等[23]在兔房颤模型中发现,激动β3-AR可减少L 型钙通道亚型以及增加内向整流钾电流(IK1)和瞬时外向钾电流(Ito),心房电重构加剧,这可能是缩短心房肌细胞动作电位持续时间的潜在机制。此外,Liu 等[24]在房颤兔模型中发现β3-AR 被激活,能量代谢相关蛋白被破坏,拮抗β3-AR 则能够通过过氧化物酶体增殖物激活受体α(PPARα)/ 过氧化物酶体增殖物激活受体γ 共激活因子1α(PGC-1)途径抑制房颤诱导的代谢相关蛋白受损。
本研究发现,房颤患者β3-AR mRNA 相对表达水平较健康体检者显著升高,并且与LAD 呈正相关;校正各种房颤潜在相关危险因素后,β3-AR mRNA相对表达水平仍与LAD 呈正相关;而且随着房颤持续时间延长,β3-AR mRNA 相对表达水平升高。以上结果提示,β3-AR 可能参与了心房结构重构。但β3-AR 参与房颤患者的心房结构重构及电重构的机制还需进一步研究。本研究表明,β3-AR mRNA 相对、表达水平LAD、CRP 是房颤的独立危险因素,ROC曲线分析显示β3-AR mRNA 相对表达水平预测房颤的曲线下面积为0.734,提示β3-AR mRNA 相对表达水平预测房颤的准确性较高,可作为房颤发生和维持的预测因子。然而,患者存在不同的基础疾病以及患者个体间存在差异,这些差异是否会对结果产生影响尚不清楚。
本研究的创新点在于,我们用淋巴细胞代替心房组织,减少了患者所受的创伤,更便于临床研究;本研究发现,房颤患者外周血淋巴细胞中β3-AR mRNA 相对表达水平升高,外周血淋巴细胞中β3-AR mRNA 相对表达水平可考虑作为房颤诊断及风险评估的新指标,未来有可能成为房颤诊治的新靶点。
本研究仍存在一些局限性。首先,入选患者病例数相对较少,不能代表所有房颤患者;其次,研究时间较短,患者不同房颤类型的转变以及房颤患者的不同基础疾病对β3-AR mRNA 相对表达水平可能会产生影响;另外,本研究未验证β3-AR在房颤发生、发展中的病理机制,也没有研究β1-AR、β2-AR、β3-AR 在房颤发生、发展中的相互作用,因为这三种类型的β-AR 都在心血管系统中发挥作用。
综上所述,我们的研究表明,房颤患者外周血淋巴细胞中β3-AR mRNA 相对表达水平升高,并且与LAD 大小及房颤持续时间密切相关,外周血淋巴细胞β3-AR mRNA 相对表达水平可能是评估房颤发生风险的一个预测指标。未来还需要开展更大规模、随访时间更长的研究来验证;另外,还需进一步开展研究来验证是否可以通过降低β3-AR mRNA 相对表达水平的干预措施来减少房颤的发生以及逆转心房结构重构。相信未来随着对β3-AR 更深入的探索,房颤的病因及发病机制会进一步明确,从而为房颤的诊疗提供新思路。
